
| 一般情况 | |
|---|---|
 | 品种:英国短毛猫 |
| 年龄:8个月 | |
| 性别:雄 | |
| 是否绝育:否 | |
| 诊断:先天性结核病 | |
01 主诉及病史
因呼吸困难和腹式呼吸就诊。
02 预后
病情迅速恶化,入院12小时后死亡。
03 尸检
在征得主人同意后,进行尸体解剖和病理检查。在全身尸检时,在肺部(下图A)和脾脏(下图B)观察到直径为3.00-5.00 mm的白色圆形病灶。
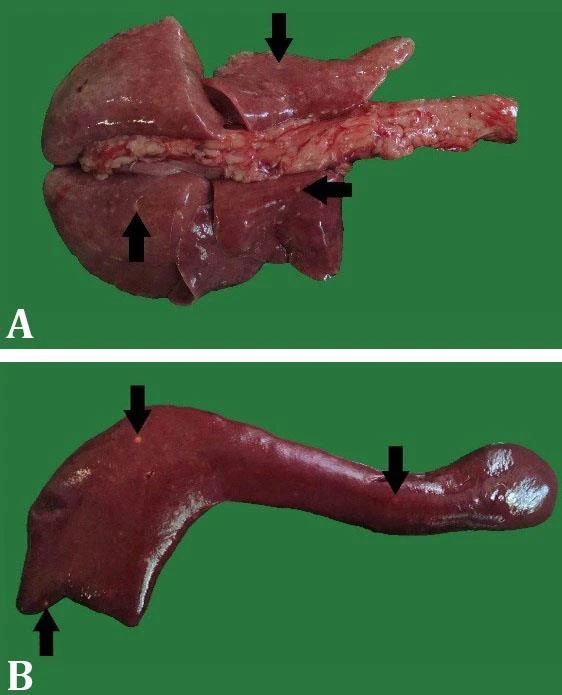
还发现了胸腔积水和心包积水。此外,还观察到脑膜充血以及肝脏和肾脏变性。淋巴结或其他器官未发现宏观病理异常。显微镜下,在肺部(下图AB)和脾脏(下图C)也发现了由坏死组成的多灶性结节区,但没有纤维囊和核变性细胞。这些结核病灶广泛存在于肺部和脾脏。在结节周围观察到一些淋巴组织细胞浸润。肺和脾脏病变周围有极少数上皮样组织细胞,但未发现巨细胞类型。肺部(下图D)和脾脏(下图E)切片的ZN染色显示,渗出型病理坏死区域存在酸性固有菌。其他器官经ZN染色后未发现酸性病菌。肺部(下图F)和脾脏切片的免疫组化染色显示,分枝杆菌抗体呈阳性免疫染色,尤其是在坏死区域。
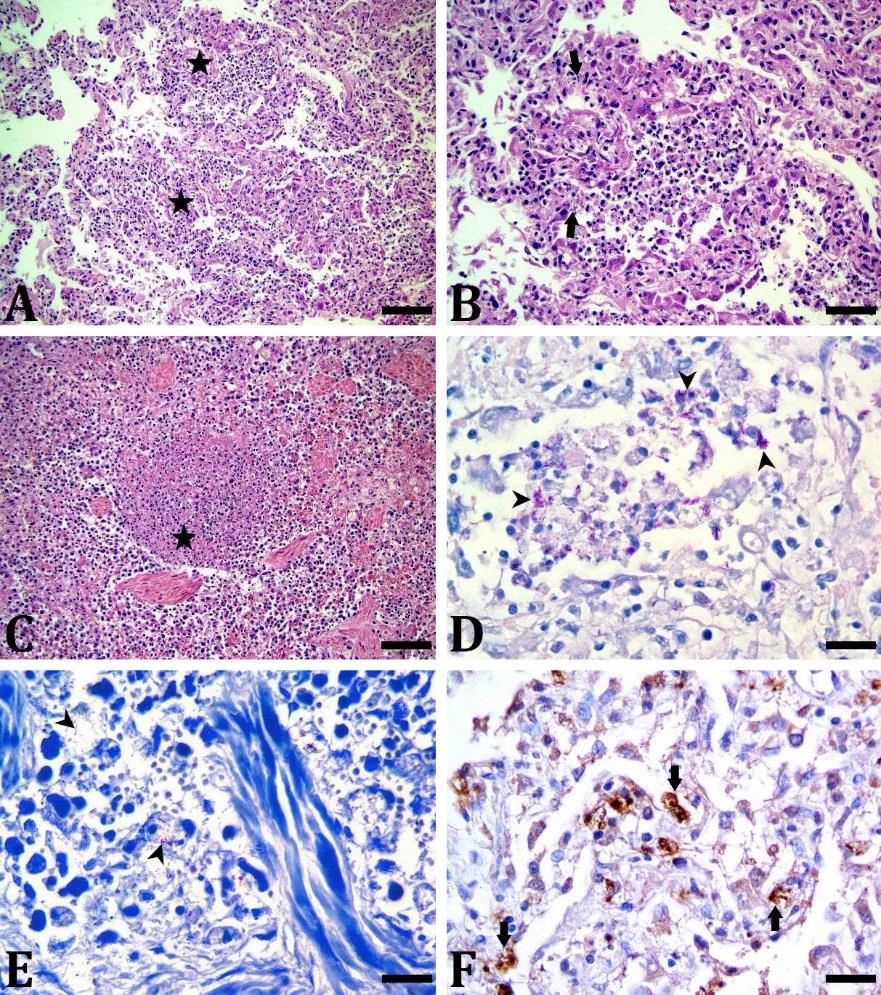
在肝脏,肝细胞明显变性,肝门区有单核细胞浸润。在肾脏,发现肾小管变性,肾小球内有淀粉样堆积物。此外,脑膜出现充血和炎性细胞浸润。心脏和纵隔淋巴结未发现组织病理学改变。
04 讨论
动物结核病是一种世界性疾病,由结核分枝杆菌引起,可感染人类及多种家养和野生哺乳动物[1]。结核分枝杆菌是革兰氏阳性、无芽孢、无运动性、耐酸的杆菌,在显微镜下呈直或稍弯曲的棒状,长度为1.00-4.00 微米,宽度为0.30-0.60 微米[2]。结核分枝杆菌主要通过呼吸道和消化道传播,生殖器、先天性和皮肤传播途径很少见[3]。
先天性结核病可能是母体结核病影响生殖系统或胎盘所致。在怀孕或分娩期间,结核病可通过脐带血管或吸入受感染的羊水传播给胎儿[3-5]。在牛结核病流行的地区,大约0.50%的新生犊牛感染了结核病。由于结核性子宫内膜炎仅常见于奶牛,因此这种传播途径在其他物种(如猫和狗)中并不常见。
先天性结核病传播迅速,动物通常会在几周或几个月内死亡。在此期间,疾病会变得全身化,尤其是肺部、区域淋巴结和脾脏会出现病变。在成年动物中,结核病的脾脏病变非常罕见,无论动物的年龄如何,一旦出现这种病变,就会被视为先天性感染的指标[3]。
本报告的目的是利用组织病理学和免疫组化方法描述世界上首例猫先天性结核病病例,并提高学术界、临床兽医和猫主人对该病的认识,因为该病具有人畜共患病的潜能,因此是一个公共卫生问题。
先天性结核病可能发生于生殖道或胎盘[8]。结核杆菌可通过脐静脉血源性传播给胎儿,或在妊娠或分娩期间通过吸入受感染的羊水传播给胎儿[4,9]。在本病例中,传播途径被认为是吸入受感染的羊水或通过脐静脉血源性传播。只有脾脏和肺部存在结核病灶和病原体,而纵隔淋巴结没有结核病灶或病原体,这支持了这一观点。
食肉动物的结核病灶与其他物种不同。典型的结核性肉芽肿并不常见,即使出现肉芽肿,病理坏死也不是突出的大体特征。更常见的是一种非特异性肉芽组织,其中巨噬细胞随机散布,巨细胞罕见或不存在[3]。
有报道称,猫结核相关性坏死的特征是,由于嗜酸性或嗜碱性(核变性)残留物堆积,细胞和结构特征丧失的区域被称为干酪性坏死[10]。在本病例中,发现坏死区域无纤维囊,可见大量核变性细胞,仅有少量上皮样组织细胞,未观察到巨细胞。
总之,这是世界上首例使用组织病理学和免疫组化方法证实的猫先天性结核病病例报告。该病例凸显了如果不采取适当的预防和控制措施,可能会导致疾病的严重性。由于结核病是一种动物人畜共患疾病,因此应定期对有呼吸道症状的疑似或感染猫进行检查,因为它们可能对猫主人、儿童和临床兽医构成人畜共患病风险。
文献来源:Dağar O, Ateş MB, Ortatatlı M, Öztürk FM. Congenital feline tuberculosis: the first case report. Vet Res Forum. 2024;15(4):203-205.
参考文献
1. Thomas J, Balseiro A, Gortázar C, et al. Diagnosis of tuberculosis in wildlife: a systematic review. Vet Res. 2021;52:31.
2. Barry 3rd CE, Lee RE, Mdluli K, et al. Mycolic acids: structure, biosynthesis and physiological functions. Prog Lipid Res. 1998;37(2-3):143–179.
3. Jubb K, Kennedy P, Palmer N. Pathology of domestic animals. 3rd ed. Cambridge, USA: Academic Press ; 1985. pp. 493–504.
4. Gnehm HE, Stähelin-Massik J, Zeilinger G. Congenital tuberculosis in a premature infant. Swiss Med Wkly. 2002;132(4142).
5. M’Fadyean J. Congenital tuberculosis in the calf. J Comp Pathol Ther. 1899;12:156–162.
6. Luna L. Manual of histologic staining methods of the armed forces institute of pathology. 3rd ed. New York, USA: McGraw-Hill ; 1968. pp. 43–43.
7. Ates MB, Çiftçi MK, Oruç E, et al. Mycobacterium bovis tuberculosis in a neonatal Holstein calf [Turkish] Eurasian J Vet Sci. 2019;35(3):175–179.
8. Ozyigit MO, Senturk S, Akkoc A. Suspected congenital generalised tuberculosis in a newborn calf. Vet Rec. 2007;160(9):307–308.
9. Dungworth D. The respiratory system. In: Jubb KVF, Kennedy PC, Palmer N, editors. Pathology of domestic animals. 3rd ed. London, UK: Academic Press ; 1993. pp. 641–648.
10. Mitchell JL, Del Pozo J, Woolley CSC, et al. Histological and immunohistochemical features suggesting aetiological differences in lymph node and (muco)cutaneous feline tuberculosis lesions. J Small Anim Pract. 2022;63(3):174–187.