
| 一般情况 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:7岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:虹膜黑色素瘤伴腰椎硬膜外转移 | |
01 主诉及病史
3周前出现进行性后肢共济失调和截瘫,并伴有严重的胸腰椎疼痛。转诊前接受了泼尼松龙和头孢氨苄治疗,病情得到了短暂改善。血液分析和脊柱X光片检查均未发现异常。
一年半前,该猫的左眼虹膜上出现了黑斑,并伴有青光眼,当时对左眼进行了摘除手术。组织学分析显示,虹膜增厚达3 mm,肿瘤增生呈环状,无包膜,界限不清,浸润并取代了睫状体,并延伸至边缘区的巩膜。一些肿瘤细胞与巩膜毛细血管壁紧密接触。细胞密度很高,肿瘤细胞从纺锤形到圆形不等,细胞质呈颗粒状、淡嗜酸性,80%以上的细胞质中含有棕黑色颗粒。有丝分裂指数较高:每个视野有多达6个,连续10个高倍(×400)视野中超过20个。这些结果证实了弥漫性虹膜恶性黑色素瘤的诊断,组织学分级为晚期。胸部X光片未发现转移。
02 检查
体格检查显示直肠温度为39.2℃,其他生命指标均在正常范围内。无排尿障碍。腹部触诊膀胱较小,有弹性。神经系统检查显示,患者有轻度后肢共济失调,伴有活动性截瘫。后肢姿势反应减弱,但双侧肢体的髌骨反射、颅胫反射和退缩反射正常。
胸腰椎部位有严重的脊柱过度紧张。其余的神经系统检查,包括颅神经评估、胸肢姿势反应和肌反射均在正常范围内。根据这些检查结果,病变被定位在T3-L3脊髓节段。
MRI在椎管背侧发现了一个界限相对清晰的肿块,T2W呈中度异质低密度(下图ab),T1W呈高密度但无对比度增强(下图cd)。肿块与L3-L4椎间盘间隙周围的椎板有较宽的接触基底,符合脊髓硬膜外压迫性病变的特征。肿块约占椎管横截面的60%,导致硬膜外脂肪和蛛网膜下腔压迫。肿块局部延伸至左侧L3-L4椎孔(下图c)。与对侧相比,神经根远端似乎对称增厚。

腰椎脑脊液检查显示,有核细胞总数略有升高(19 个白细胞/μL,参考值:<5),以单核细胞为主,尤其是淋巴细胞,蛋白质浓度为51 mg/dL(参考值:<45)。脑脊液样本中未发现肿瘤细胞。
03 手术
第二天在第三和第四腰椎处进行了左侧半椎板切除术,以切除压迫性病变(下图)。术中发现硬膜外腔背外侧有棕色易碎物质,压迫脊髓下层,并浸润左侧第三和第四腰椎的邻近椎板和椎弓根。切除肿块后,脊髓的外观正常。

术后药物包括止痛药物(丁丙诺啡 20 μg/kg iv,q8h,持续 1 天;加巴喷丁 10 mg/kg po,q8h)、非甾体抗炎药(美洛昔康 0. 1 mg/kg,每天一次,连续5天)、抗生素治疗(阿莫西林/克拉维酸 12.5 mg/kg po,q12h,连续10天)和物理治疗。术后第四天,猫咪可以活动,但背部仍有轻微疼痛,随后出院。
组织学评估显示,肿瘤呈致密的恶性增生,细胞呈圆形至纺锤形,形成小叶和束状(下图)。

细胞核不典型(多核、周边染色质强化、核变性、核凹陷),丰富的嗜酸性细胞质偶尔含有少量球状黑色素(下图)。有丝分裂指数为每视野2个(×40),中度异形细胞增多和异形核增多。培养液中未发现厌氧或需氧细菌生长。
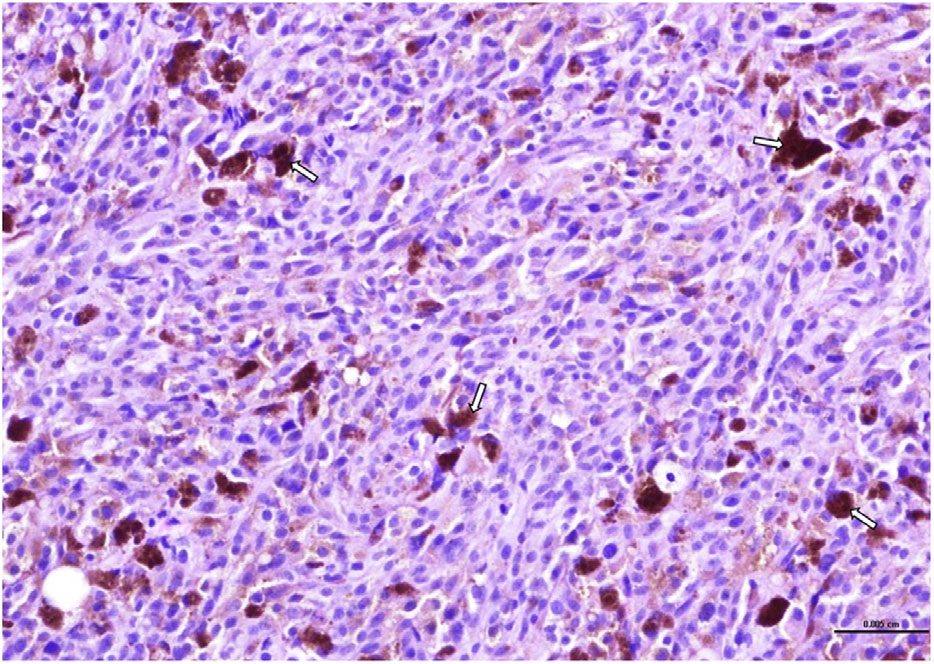
组织学检查结果证实,第三和第四腰椎水平的脊髓受压,继发于硬膜外恶性黑色素瘤,考虑到该动物的病史、原发肿瘤的高转移风险、肿瘤部位不寻常以及转移瘤与原发肿瘤部位相比分化程度较低且细胞色素减少等因素,该肿瘤很可能是弥漫性虹膜恶性黑色素瘤转移。
04 预后
术后3个月,该猫一般状况良好,临床症状也有所缓解,但又开始出现背痛,服用镇痛药后症状短暂好转。
术后6个月,该猫出现呼吸困难,胸片上发现了大量肺转移灶。由于没有进行进一步治疗,主人选择了安乐死。
05 讨论
弥漫性虹膜黑色素瘤是猫最常见的原发性眼内肿瘤[1]。黑色素瘤的发病机制涉及许多因素,包括环境、遗传和免疫因素[2],这使得猫眼黑色素瘤的生物学行为多变。尽管存在这种多变性和不确定性,但人们还是为这种类型的黑色素瘤制定了各种宏观和组织学标准,试图提供一些预后价值[3]。
弥漫性虹膜黑色素瘤转移到中枢神经系统的病例在猫科动物中非常罕见。在人类医学中,转移瘤最常通过视神经侵犯而累及大脑;当它们累及脊髓时,大多位于椎体、硬膜外间隙或髓内区域[4]。硬膜外转移极为罕见[5]。因此,如何对此类转移瘤进行最佳治疗极具挑战性。
本报告描述了一例猫腰椎硬膜外黑色素瘤转移病例,无论是在人类医学还是兽医学中,硬膜外黑色素瘤都是一个非常罕见的部位。
弥漫性虹膜黑色素瘤具有局部浸润性,转移率高(19%-63%),偏爱肝、肺、脾、淋巴结和肾等远处器官[3],此外还有一些不寻常的转移部位,包括桡骨头和近端干骺端[6],以及在多个器官的广泛传播,表明存在空腔、淋巴和血源性传播[2]。然而,转移性疾病的临床症状可能需要3年才能显现出来[7]。
原发性弥漫性虹膜黑色素瘤的各种宏观和组织学标准具有一定的预后价值。研究发现,继发性青光眼[8]、局部肿瘤侵犯(如巩膜外或脉络膜扩展)、肿瘤内坏死[9]或有丝分裂指数高(10个高倍视野中有丝分裂数大于7个)[3]与转移增加有关[10]。然而,与之前的报告不同的是,最近一项针对47只诊断为猫弥漫性虹膜黑色素瘤的摘除眼球的研究[3]并未显示巩膜静脉丛穿透与转移率之间存在关联。在本病例中,虽然脉络膜未受侵犯,也未发现肿瘤坏死,但继发性青光眼和高有丝分裂指数表明该猫转移风险很高。
MRI是诊断脊髓肿瘤的首选成像方法,因为它具有较高的软组织分辨率,可将这些肿瘤分为硬膜外肿瘤、硬膜内-髓外肿瘤或髓内肿瘤,这对肿瘤的特征描述非常有用[11]。黑色素细胞肿瘤的MRI并不总是显示出均匀的模式。T1W信号取决于黑色素、急性或慢性瘤内出血和脂肪沉积的存在[4]。T1W图像上的高强度并非出血的特异性表现,黑色素、高蛋白、血流伪影或顺磁效应也可能导致高强度[12]。黑色素瘤转移的预期信号模式是T1W高强,T2W低强,在T2*W图像上伴有信号空洞[12]。含黑色素细胞的百分比与信号强度相关[13]。
在人类医学中,一旦确诊脊柱黑色素瘤转移,中位总生存期为2.9至5.9个月[14]。由于预后较差,姑息治疗是首要治疗目标。手术切除和放射治疗是治疗的主要手段,适用于保留神经功能。人类医学中有关脊柱黑色素瘤转移手术作用的文献十分有限,在兽医学中更是如此,因为兽医大多对动物实施安乐死[11],但对于因转移性黑色素瘤而接受脊柱手术的人类患者来说,已经形成了一些预后因素。本病例有积极的预后因素,仅有一处脊柱转移灶,但是手术时的扩展检查缺失,这可能会让兽医对未来的预后有更准确的认识。
尽管最佳治疗方法仍在争论之中,也没有一种治疗方式被证明对脊柱转移性黑色素瘤的治疗完全有效[15],但过去二十年来免疫疗法和靶向疗法的最新进展带来了令人鼓舞的结果。据描述,大多数人类转移性黑色素瘤都携带BRAFV600基因突变,因此使用抗体和BRAF激酶抑制剂是治疗转移性黑色素瘤的新策略[16]。
最近一项关于猫眼黑色素瘤突变分析和基因表达谱分析的研究[17]表明,人类黑色素瘤中常见的突变并不存在于猫科动物的肿瘤中。例如,基因表达分析表明,猫眼黑色素瘤中的KIT显著上调,而BRAF则下调,这突显了KIT作为猫眼黑色素瘤辅助治疗靶点的潜力[18]。
在KIT突变肿瘤中使用伊马替尼,在狗和猫中显示出了良好的临床反应和可耐受的毒性[19],这可能为KIT突变猫科动物黑色素瘤提供了一种治疗选择。当然仍需要进一步的临床研究。
由于脊柱临床症状出现的时间与眼部黑色素瘤最初出现的时间相比较晚,而且病变在MRI图像上位于硬膜外,因此本病例最初并未怀疑是转移性黑色素瘤。尽管目前还没有一种治疗方法被证明对黑色素瘤及其转移完全有效,而且该病预后仍然很差,但在过去十年中对免疫和肿瘤细胞生物学的进一步研究很可能会改善未来对猫这种疾病的治疗效果。
参考文献
[1] Sandmeyer, L. S., Leis, M. S., Bauer, B. S., & &Grahn, B. H. (2017). Diagnostic ophtalmology. The Canadian Veterinary Journal, 58(7), 757–758.
[2] Calado, A., Silva, T., Santos, C., Figueira, A. C., Praday, J., & Canavarro, I. (2014). Diffuse iris melanoma with atypical metastatic behaviour in a cat. Journal of Comparative Pathology, 150(1), 114.
[3] Wiggans, K. T., Reilly, C. M., Kass, P. H., & Maggs, D. J. (2016). Histologic and immunohistochemical predictors of clinical behavior for feline diffuse iris melanoma. Veterinary Ophthalmology, 19, 44–55.
[4] Sun, L., Song, Y., & Gong, Q. (2013). Easily misdiagnosed delayed metastatic intraspinal extradural melanoma of the lumbar spine: A case report and review of the literature. Oncology Letters, 5(6), 1799–1802.
[5] Peters, B., Peters, R., De Praeter, G., & Vanhoenacker, F. (2015). Epidural metastatic melanoma. Eurorad. European Society of Radiology.
[6] Planellas, M., Pastor, J., Torres, M. D., Pena, T., & Leiva, M. (2010). Unusual presentation of a metastatic uveal melanoma in a cat. Veterinary Ophthalmology, 13, 391–394.
[7] Stiles, J. (2013). Feline ophthalmology. In K. N. Gelatt, B. C. Gilger, & T. J. Kern (Eds.), Veterinary ophthalmology (pp. 1477–1559). Wiley-Blackwell.
[8] Kalishman, J. B., Chapell, R., Flood, L., & Dubielzig, R. R. (1998). A matched observational study of survival in cats with enucleation due to diffuse iris melanoma. Veterinary Ophthalmology, 1, 25–29.
[9] Gelatt, K. N., Gilger, B. C., & Kern, T. J. (2021). Veterinary ophthalmology (Vol. 28). Wiley-Blackwell.
[10] Kayes, D., & Blacklock, B. (2022). Feline uveal melanoma review: Our current understanding and recent research advances. Veterinary Sciences, 9(2), 46.
[11] Besalti, O., Caliskan, M., Can, P., Vural, S. A., Algin, O., & Ahlat, O. (2016). Imaging and surgical outcomes of spinal tumors in 18 dogs and one cat. Journal of Veterinary Science, 17(2), 225–234.
[12] Mai, W. (2018). Diagnostic MRI in dogs and cats. Taylor & Francis Group.
[13] Atlas, S. W., Grossman, R. I., Gomori, J. M., Guerry, D., Hackney, D. B., Goldberg, H. I., Zimmerman, R. A., & Bilaniuk, L. T. (1987). MR imaging of intracranial metastatic melanoma. Journal of Computer Assisted Tomography, 11(4), 577–582.
[14] Sellin, J. N., Gressot, L. V., Suki, D., St Clair, E. G., Chern, J., Rhines, L. D., McCutcheon, I. E., Rao, G., & Tatsui, C. E. (2015). Prognostic factors influencing the outcome of 64 consecutive patients undergoing surgery for metastatic melanoma of the spine. Neurosurgery, 77(3), 386–393.
[15] Zheng, D. X., Soldozy, S., Mulligan, K. M., Levoska, M. A., Cohn, E. F., Finberg, A., Alsaloum, P., Cwalina, T. B., Hanft, S. J., Scott, J. F., Rothermel, L. D., & Nambudiri, V. E. (2023). Epidemiology, management, and treatment outcomes of metastatic spinal melanoma. World Neurosurgery: X, 18, Article 100156.
[16] Kim, A., & Cohen, M. S. (2016). The discovery of vemurafenib for the treatment of BRAF mutated metastatic melanoma. Expert Opinion on Drug Discovery, 11, 907–916.
[17] O’Day, S. J., Maio, M., Chiarion-Sileni, V., Gajewski, T. F., Pehamberger, H., Bondarenko, I. N., Queirolo, P., Lundgren, L., Mikhailov, S., Roman, L., Verschraegen, C., Humphrey, R., Ibrahim, R., de Pril, V., Hoos, A., & &Wolchok, J. D. (2010). Efficacy and safety of ipilimumab monotherapy in patients with pretreated advanced melanoma: A multicenter single-arm phase II study. Annals of Oncology, 21, 1712–1717.
[18] Rushton, J. G., Ertl, R., Klein, D., & Nell, B. (2017). Mutation analysis and gene expression profiling of ocular melanomas in cats. Veterinary and Comparative Oncology, 15, 1403–1416.
[19] Bonkobara, M. (2015). Dysregulation of tyrosine kinases and use of imatinib in small animal practice. The Veterinary Journal, 205(2), 180–188.