
| 一般情况 | |
|---|---|
 | 品种:标准贵宾犬 |
| 年龄:3.5岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:药物引起的系统性红斑狼疮 | |
01 主诉及病史
出现急性嗜睡和厌食。
5周前因癫痫反复发作口服苯巴比妥(3.16 mg/kg,q12h)治疗。第3周复查未出现癫痫发作,血清苯巴比妥浓度为102 μmol/L,处于治疗范围(70-170)。
02 检查
发热(39.5℃)和轻度脱水。全血细胞计数显示血细胞比容偏低(40%,区间:39-56),中性粒细胞减少(1.4×10^9/L,区间:2.9-10.6),血小板明显减少(55×10^9/L,区间:117-418)。
血清肌酐(288 μmol/L,区间:44-133)和尿素氮(42.4 mmol/L,区间:7.3-11)升高,表明该患有氮质血症。对称二甲基精氨酸浓度也升高(15 μg/dL,区间:<14)。尿比重1.020,尿蛋白与肌酐比率明显升高,达到11.4(<0.5),尿沉渣不活跃。
没有观察到左移或中性粒细胞毒性,血涂片没有发现血小板结块。直接库姆斯氏试验呈阴性,虫媒传播疾病的ELISA试验也呈阴性。
接受静脉输液、广谱抗生素(氨苄西林和恩诺沙星)和胃肠道支持治疗。由于怀疑苯巴比妥会诱发骨髓抑制,停用了苯巴比妥,并开始使用左乙拉西坦作为替代药物。患者对治疗产生了积极的反应。发热在12小时内缓解,第二天食欲恢复。
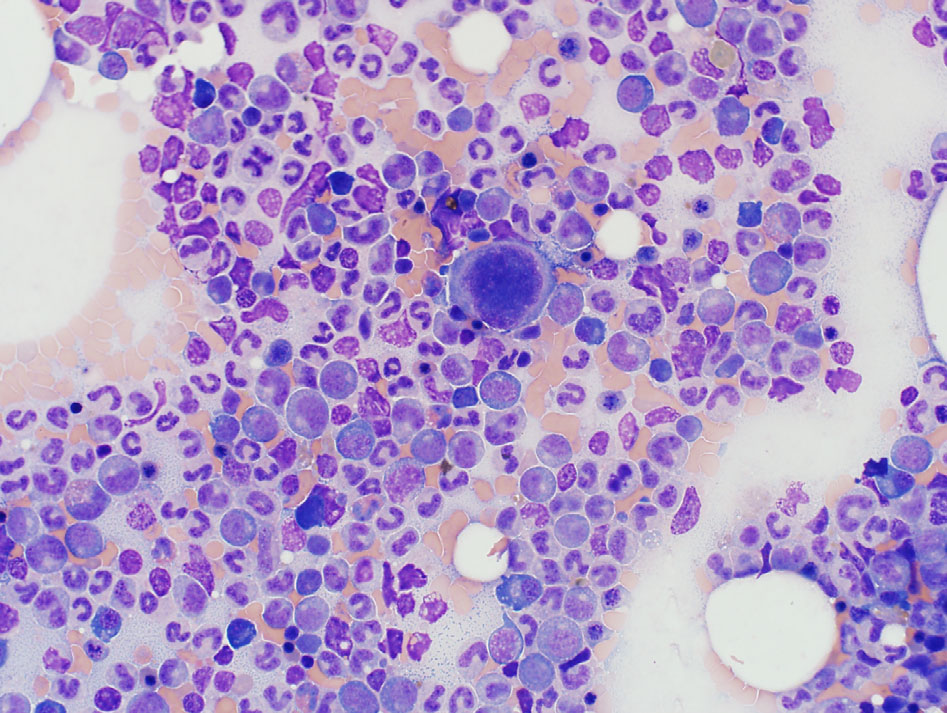
第2天采集了胸骨骨髓抽吸物进行细胞学检查(下图)。可见粒细胞明显增生,巨核细胞也可能增生,粒细胞和巨核细胞生成无效。推测是苯巴比妥的不良反应或潜在的(原发性或继发性)免疫相关性疾病。
03 预后
经静脉输液治疗后,氮质血症得到缓解,蛋白尿有所改善。中性粒细胞减少症和血小板减少症没有变化,并出现了贫血。尿培养和尿钩端螺旋体PCR均为阴性。
第4天采血检测抗核抗体 (ANA),结果呈强阳性,抗体滴度为1:640。
由于该犬出现泛血小板减少,第8天再次进行了胸骨骨髓抽吸。细胞学结果进一步证实了免疫相关性疾病引起的细胞减少症(下图)。
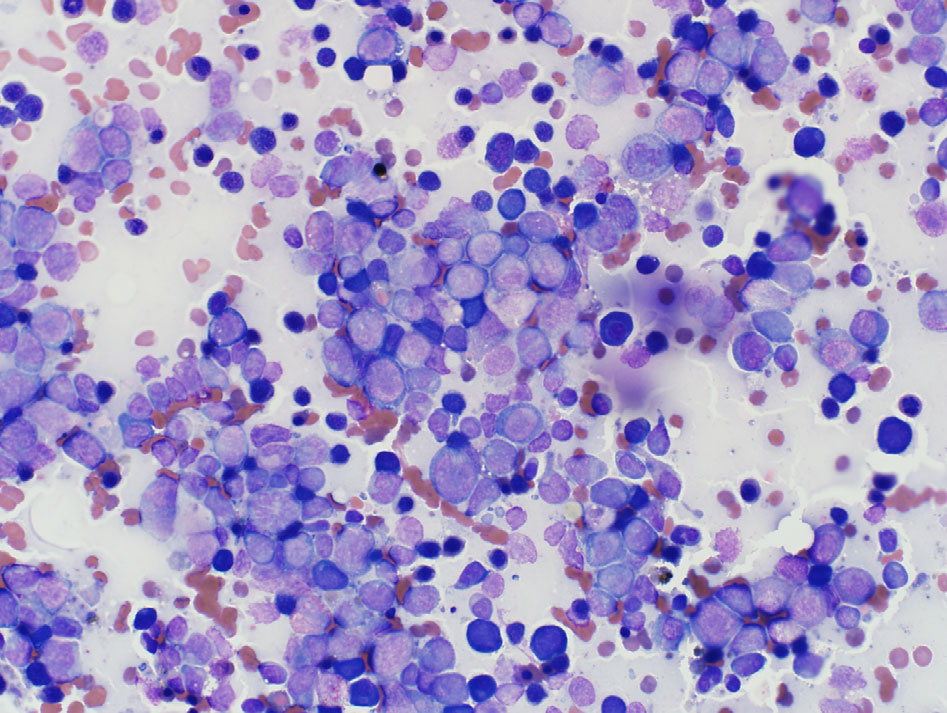
虽然临床表现强烈提示患者对苯巴比妥产生了不良反应,但骨髓细胞学检查结果却让人怀疑患者可能患有骨髓增生异常或白血病。因此采用了流式细胞术进一步研究骨髓中的细胞群。评估结果显示单核细胞前体占多数。
由于出现了贫血相关临床症状,患者在第8天接受了输血。临床症状在第9天有所改善。第10天该犬出院,症状稳定,食欲良好。在家中继续接受阿莫西林-克拉维酸和恩诺沙星治疗。
在接下来的几周里进行了多次复查。在此期间,血小板减少症和蛋白尿得到缓解,贫血也逐渐改善。中性粒细胞减少症在第34天缓解。
11周后复查,所有细胞减少症均已缓解,ANA下降至1:10。估计骨髓细胞率为60%,骨髓与红细胞的比例为2:1。观察到粒细胞完全同步成熟,中期和晚期红细胞以及大量未成熟巨核细胞的比例相对增加。根据这些结果,推测药物诱发的狼疮已得到缓解。
04 讨论
系统性红斑狼疮(Systemic lupus erythematosus,SLE)是一种全身性自身免疫性疾病,其特点是存在抗核抗体和多系统免疫介导的炎症[1-3]。药物诱发的狼疮是指由于服用某种药物而导致符合狼疮标准的自身免疫性疾病的发生。在人类医学中,有超过100种药物与此病有关[4]。例如抗惊厥药继发的狼疮与苯巴比妥、乙琥胺、三甲双酮等药物有关。
狼疮和类狼疮综合征在犬身上已有很好的描述[9],该病有全身性和皮肤性两种形式,还有几种狼疮样(类狼疮)症状。
苯巴比妥的不良反应在兽医学中已有大量报道,包括镇静、共济失调和嗜睡等靶向效应,以及细胞增生症和肝病等非靶向或特异性药物反应[13]。
本报告描述了一只成年犬在服用苯巴比妥后出现蛋白尿、急性肾损伤、多种细胞增生症和抗核抗体滴度阳性,所有这些症状均在未接受特殊治疗的情况下得到缓解。
美国风湿病学协会将人类狼疮的诊断标准定义为ANA阳性且评分至少达到10分[1]。虽然在犬身上还没有建立起公认的SLE诊断系统,但之前的研究已将人类标准应用于犬身上[2,3]。
在本病例中,ANA滴度阳性、发热(2分)、白细胞减少(3分)、血小板减少(4分)和蛋白尿(4分)共13分,符合人类使用的狼疮诊断标准。虽然癫痫发作是人类狼疮的诊断标准之一,但这只狗的癫痫发作早于其他临床症状,因此被认为与狼疮无关。
本患者的发热可能是多因素引起的。原发性免疫介导的发热在人类狼疮患者中也有报道,可能就是本患者的病因[1]。鉴于中性粒细胞减少症的存在,继发于白细胞数量降低和宿主防御能力不足的发热也是可能的,并且在使用抗菌药治疗后可以缓解,但缓解与停用苯巴比妥有关。
本病例的蛋白尿可能来自肾脏。此外,根据蛋白尿的程度,还怀疑是肾小球引起的。在人类SLE患者中,蛋白尿可能是抗体在肾小球内沉积的结果,并可能以多种形式出现(如膜性、增殖性、局灶节段性肾小球肾炎)。确诊免疫介导型肾小球肾炎需要进行肾活检,但本患者没有进行肾活检。全身性疾病(如发热、低度败血症)也可能影响肾小球功能,导致蛋白尿。
该病例的贫血最初似乎是轻微的、非再生性的,但随着病情的加重,贫血变成了再生性贫血。显微镜下未发现免疫介导的破坏迹象,库姆斯氏试验也呈阴性。因此,不太可能是由于溶血。可能的原因包括肠道出血(临床上未发现,但BUN浓度升高可能与之有关)、骨髓抑制导致红细胞生成不足或肾脏受损导致红细胞生成素缺乏,但可能性较小。
兽医文献中曾报道过苯巴比妥诱导的多系细胞减少症,既有急性过量的反应[16],也有对治疗浓度的特异性药物反应[17,18]。特别是在使用苯巴比妥治疗的犬中出现了无效的骨髓增生和中性粒细胞减少[18],本病例中也出现了这种情况。
由于停用苯巴比妥8天后,该犬的细胞减少症仍然存在,因此再次进行了骨髓穿刺,结果显示未成熟髓系前体大量增生,但成熟粒细胞很少。在这有限的时间内细胞减少症没有得到改善并不出人意料,因为之前的一项研究显示,停药后中性粒细胞减少症的中位缓解时间为14天[18]。此外,苯巴比妥在犬体内的半衰期约为3天[19],预计健康狗需要15-21天(即5-7个半衰期)才能清除药物。
流式细胞术显示,大单核细胞和淋巴细胞分别约占所有细胞的40%和25%。大单核细胞表达单核细胞标记(MHCII和CD14),被认为代表单核细胞和单核细胞前体(单核细胞和原核细胞)。向单核细胞生成的转变被认为反映了骨髓的重新增殖,在某些情况下,骨髓的重新增殖往往比粒细胞生成更快。根据MHCII的均匀阳性,急性单核细胞白血病被认为是不可能的[20]。鉴于粒细胞前体和成熟粒细胞的缺乏,也考虑了针对该系的免疫介导过程。
在几例苯巴比妥诱导的贫血病例中,根据阴性的库姆斯氏试验[16-18],外周免疫机制被认为不太可能。然而,库姆斯氏试验阴性并不能排除外周或骨髓水平的红细胞前体破坏,许多动物都可能出现这种情况。在某些情况下,可能存在免疫介导的病因。
总之,本病例报告描述了首例因苯巴比妥治疗而诱发的SLE的兽医报告。当出现苯巴比妥不良反应时,这种情况应被视为可能的鉴别诊断。在本病例中,医生建议患者接受免疫抑制治疗,但主人拒绝了,临床症状在停药后3个月内得到了缓解。
参考文献
[1] Aringer M, Costenbader K, Daikh D, et al. 2019 European League Against Rheumatism/American College of Rheumatology Classification Criteria for systemic lupus erythematosus. Arthritis Rheumatol. 2019; 71(9): 1400-1412.
[2] Fournel C, Chabanne L, Caux C, et al. Canine systemic lupus erythematosus. I: A study of 75 cases. Lupus. 1992; 1(3): 133-139.
[3] Jones DRE. Canine systemic lupus erythematosus: new insights and their implications. J Comp Pathol. 1993; 108(3): 215-228.
[4] Solhjoo M, Goyal A, Chauhan K. Drug-induced Lupus Erythematosus. StatPearls; 2022. https://www.ncbi.nlm.nih.gov/books/NBK441889/. Accessed October 19, 2022.
[5] Meier VS, Beatrice L, Turek M, et al. Outcome and failure patterns of localized sinonasal lymphoma in cats treated with first-line single-modality radiation therapy: a retrospective study. Vet Comp Oncol. 2019; 17(4): 528-536.
[6] Singsen BH, Fishman L, Hanson V. Antinuclear antibodies and lupus-like syndromes in children receiving anticonvulsants. Pediatrics. 1976; 57(4): 529-534.
[7] Beernink DH, Miller JJ. Anticonvulsant-induced antinuclear antibodies and lupus-like disease in children. J Pediatr. 1973; 82(1): 113-117.
[8] Crespel A, Velizarova R, Agullo M, Gélisse P. Ethosuximide-induced de novo systemic lupus erythematosus with anti-double-strand DNA antibodies: a case report with definite evidence. Epilepsia. 2009; 50(8): 2003.
[9] Lewis RM, Schwartz RS. Canine systemic lupus erythematosus. Genetic analysis of an established breeding colony. J Exp Med. 1971; 134(2): 417-438.
[10] Olivry T, Linder KE, Banovic F. Cutaneous lupus erythematosus in dogs: a comprehensive review. BMC Vet Res. 2018; 14(1): 1-18.
[11] Balazs T, Robinson CJG, Balter N. Hydralazine-induced antinuclear antibodies in beagle dogs. Toxicol Appl Pharmacol. 1981; 57(3): 452-456.
[12] Aucoin DP, Rubin RL, Peterson ME, et al. Dose-dependent induction of anti-native DNA antibodies in cats by propylthiouracil. Arthritis Rheum. 1988; 31(5): 688-692.
[13] Charalambous M, Shivapour SK, Brodbelt DC, Volk HA. Antiepileptic drugs’ tolerability and safety—a systematic review and meta-analysis of adverse effects in dogs. BMC Vet Res. 2016; 12(1): 1-44.
[14] Potschka H, Fischer A, Löscher W, et al. International veterinary epilepsy task force consensus proposal: outcome of therapeutic interventions in canine and feline epilepsy. BMC Vet Res. 2015; 11(1): 177.
[15] Defarges A, Abrams-Ogg A, Foster RA, Bienzle D. Comparison of sternal, iliac, and humeral bone marrow aspiration in beagle dogs. Vet Clin Pathol. 2013; 42(2): 170-176.
[16] Khoutorsky A, Bruchim Y. Transient leucopenia, thrombocytopenia and anaemia associated with severe acute phenobarbital intoxication in a dog. J Small Anim Pract. 2008; 49(7): 367-369.
[17] Oberholster O. Pancytopenia secondary to suspected idiosyncratic phenobarbital reaction in a dog. Can Vet J. 2021; 62(12): 1341-1343.
[18] Scott TN, Bailin HG, Jutkowitz LA, Scott MA, Lucidi CA. Bone marrow, blood, and clinical findings in dogs treated with phenobarbital. Vet Clin Pathol. 2021; 50(1): 122-131.
[19] Ravis WR, Nachreiner RF, Pedersoli WM, Houghton NS. Pharmacokinetics of phenobarbital in dogs after multiple oral administration. Am J Vet Res. 1984; 45(7): 1283-1286.
[20] Stokol T, Schaefer DM, Shuman M, Belcher N, Dong L. Alkaline phosphatase is a useful cytochemical marker for the diagnosis of acute myelomonocytic and monocytic leukemia in the dog. Vet Clin Pathol. 2015; 44(1): 79-93.