
| 病例1 | |
|---|---|
 | 品种:西施犬 |
| 年龄:8岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:病因不明的脑膜脑炎 | |
01 主诉及病史
急性震颤和共济失调。
02 检查
神经系统检查发现患者表现出左侧头倾斜和转向、阵挛性震颤和腰痛,双侧颅神经和姿势反射异常。
碱性磷酸酶285 U/L(参考值:20-150),血糖、尿素氮、血氨正常。全血细胞计数显示轻度贫血,血细胞比容35.4%(参考值:37-55),血钾2.8 mmol/L(参考值:3.5-5.8)。
核磁共振检查显示,在大脑和下丘脑以及双侧左脑干观察到弥漫性和多灶性T2/FLAIR高强度信号及轻度对比度增强(下图)。

脑脊液检查中性粒细胞占主导地位,有少量淋巴细胞,未检测到病原体。
03 治疗
免疫抑制治疗:阿糖胞苷(200 mg/m2,8小时持续输注,每3周一次)和泼尼松龙(1 mg/kg第2天开始口服,12小时一次)。泼尼松龙用量逐渐减少。
第68天,该犬被诊断为细菌性膀胱炎,进行了抗生素治疗和定期尿路冲洗。
第83天,泼尼松龙剂量为0.75 mg/kg时,神经症状再次出现,将药物剂量增加到1 mg/kg,神经症状再次好转。随后泼尼松龙剂量减至0.3 mg/kg,此时后肢共济失调和头后仰症状再次出现。
第186天,泼尼松龙剂量再次增加到0.7 mg/kg(下图),神经症状再次消失。随后泼尼松龙用量逐渐减少。
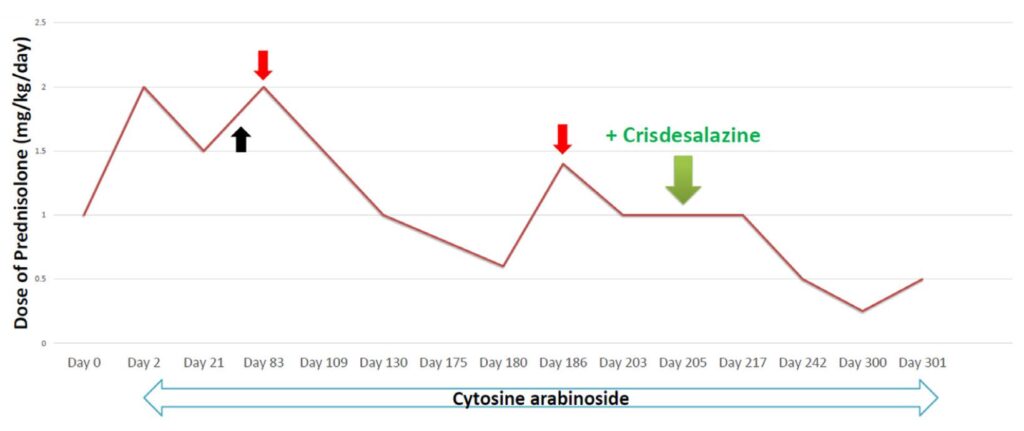
第205天,泼尼松龙剂量为0.5 mg/kg时添加了Crisdesalazine作为抗炎药。在添加Crisdesalazine作为辅助治疗药物后,泼尼松龙的用量可以减少到0.25 mg/kg,且神经症状未复发。
04 预后
阿糖胞苷的用药间隔从4周延长至9周。尚未出现免疫抑制剂的副作用,如细菌性膀胱炎等。
| 病例2 | |
|---|---|
 | 品种:约克夏梗 |
| 年龄:4岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:病因不明的脑膜脑炎 | |
05 主诉及病史
头部后仰、转头、向左绕圈,并对着空气吠叫。
06 检查
神经系统检查显示,患者双侧威胁反射和瞳孔对光反射消失,颅神经反射出现右侧位置性眼球震颤。体位反射中,右侧反射普遍较弱。
生化指标及全血细胞计数正常,胸、腹部放射线检查和超声波检查均无特殊发现。
核磁共振结果显示,左脑室周围、外侧膝状体、中脑和脑干观察到T2/FLAIR信号增强。脑室明显扩大,尤其是左脑室。中度对比度增强(下图)。
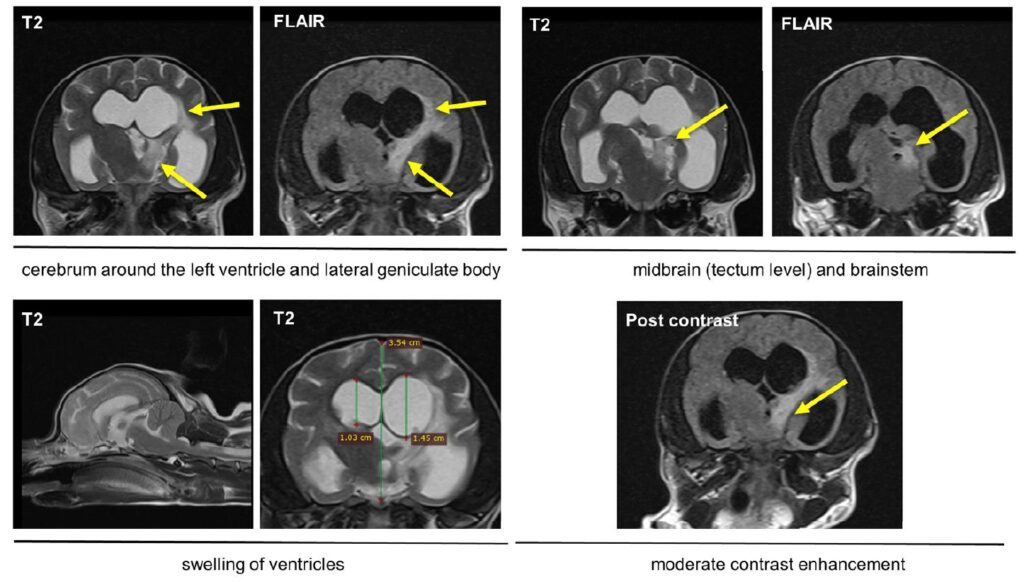
由于主人拒绝进行脑脊液分析,因此无法排除颅内感染的可能。
07 治疗
使用支持性药物(左乙拉西坦20 mg/kg PO q8h和甘露醇1 g/kg 30分钟持续输注)后神经系统症状没有改善。
征得主人同意后使用免疫抑制剂治疗。首先用了霉酚酸酯(MMF)和泼尼松龙1 mg/kg q12h,但神经症状没有明显改善。
第48天改为阿糖胞苷(200 mg/m2,8小时持续输注,每3周一次),神经症状得到部分改善。泼尼松龙的剂量逐渐减少。
第152天,在泼尼松龙剂量为0.75 mg/kg时神经症状再次出现。泼尼松龙再次增加到1 mg/kg。随后症状有所改善,药物再次减量。
第188天,联合使用Crisdesalazine和泼尼松龙0.75 mg/kg(下图)。
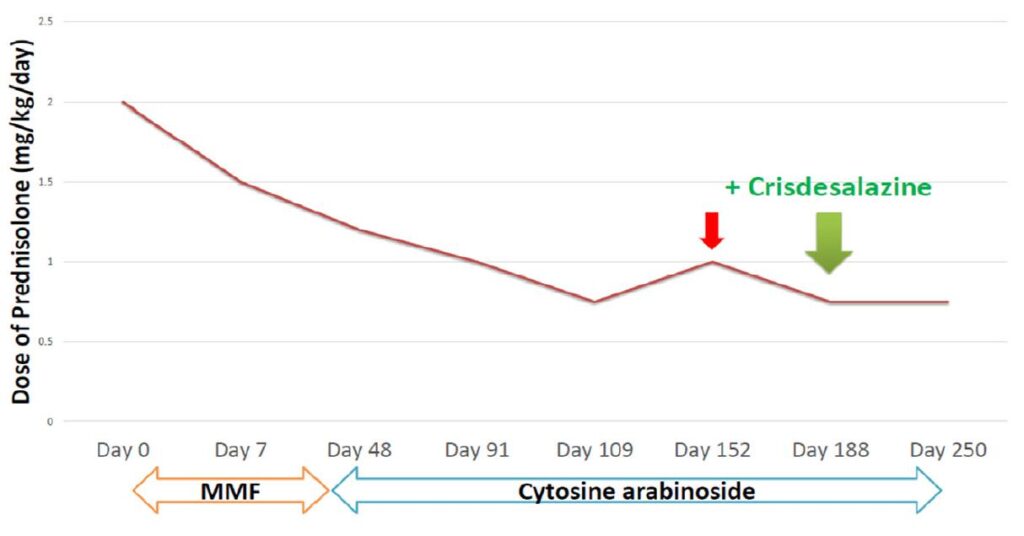
08 预后
联合用药的第二天,该犬向空中吠叫的症状停止。两周后(第202天),头部倾斜和行走距离都明显改善。迄今为止(第280天),患者的状况得到了很好的控制。
09 讨论
犬脑膜脑炎(meningoencephalitis,ME)可分为肉芽肿性脑膜脑炎、坏死性脑膜脑炎和坏死性白质脑炎[1]。这些都是犬中枢神经系统常见的炎症。确切的诊断可通过尸体解剖和组织病理学检查做出[1]。初步诊断可根据磁共振成像结果和脑脊液分析做出[2]。如果在脑脊液中未检测到感染源,则使用病因/起源不明的脑膜脑炎(MUE/MUO)一词进行诊断[1,2,3]。
目前,MUO通常采用免疫抑制剂治疗[3],如糖皮质激素和阿糖胞苷或环孢素的联合应用[4,5],病犬的中位生存时间从26天到1834天不等[2,3]。尽管使用了这些免疫抑制剂,但大多数MUO病例的病情仍在进展[2,3,6]。在本病例报告中,作者将具有抗炎和抗氧化作用的药物Crisdesalazine作为标签外适应症用于治疗两只正在接受免疫抑制剂治疗的MUO犬,结果发现它对这种病症有额外的益处。
Crisdesalazine,即 2-羟基-5-[2-(4-三氟甲基苯基)-乙氨基苯甲酸](AAD-2004),是一种从阿司匹林和磺胺嘧啶衍生而来的双重功能药物[10],被广泛用于治疗炎症性疾病[11]。该药物作为一种强效的自旋捕获分子具有抗氧化特性,同时作为一种微粒体前列腺素E合酶-1抑制剂具有抗炎作用[10]。
在肌萎缩性脊髓侧索硬化症小鼠模型中,AAD-2004能明显延缓疾病的发作,延长存活时间,而且与利鲁唑或布洛芬等传统非甾体抗炎药相比安全性更高[10]。非甾体抗炎药会造成胃损伤,与之不同的是,口服1000 mg/kg的AAD-2004(比小鼠模型的最大药效剂量高400倍)也不会导致胃出血[10]。
该药物还通过阻断脂质过氧化的增加和抑制脑内活性氧水平,对阿尔茨海默病小鼠模型显示出神经保护作用[12]。2021年,韩国动植物检疫局批准将 Crisdesalazine用于治疗犬痴呆症。虽然这种药物尚未获准用于脑膜脑炎,但猜测它的抗炎作用可能会对MUO犬产生额外的治疗效果。
虽然目前尚不清楚MUO的确切病因和病理生理学机制,但怀疑其诱因包括环境因素和抗原因素[1,2]。考虑到患者对免疫抑制治疗普遍反应良好,人们认为MUO的可能由免疫介导[16,17]。在本研究中,作者将Crisdesalazine作为免疫抑制治疗的附加疗法,期望它能对这种炎症性脑病产生抗炎和抗氧化作用,从而补充免疫抑制药的效果。
长期免疫抑制治疗的并发症包括感染和恶性肿瘤[21,22]。长期糖皮质激素治疗的副作用包括胃肠道出血、胰腺炎风险增加、肌病、皮肤功能不全、白内障和青光眼等眼科疾病、神经精神症状以及易感染[7]。这些副作用可以通过减小皮质类固醇剂量来解决[21,22]。
病例1出现了细菌性膀胱炎,并在泼尼松龙减量的情况下反复发作。而在加入Crisdesalazine后,泼尼松龙更容易减量,症状也没有复发。病例2在泼尼松龙减量时神经症状复发,但在加入Crisdesalazine后,该剂量下不再复发,犬的行为有所改善。
然而,本病例报告存在一些局限性。首先,本报告只包括两个病例。其次,这些狗没有接受超过12个月的随访。因此,仍需要更多的样本进行Crisdesalazine药物相关的前瞻性研究。
参考文献
[1] Talarico, L.R.; Schatzberg, S.J. Idiopathic granulomatous and necrotising inflammatory disorders of the canine central nervous system: A review and future perspectives. J. Small Anim. Pract. 2010, 51, 138–149.
[2] Cornelis, I.; Van Ham, L.; Gielen, I.; De Decker, S.; Bhatti, S.F.M. Clinical presentation, diagnostic findings, prognostic factors, treatment and outcome in dogs with meningoencephalomyelitis of unknown origin: A review. Vet. J. 2019, 244, 37–44.
[3] Jeffery, N.; Granger, N. New insights into the treatment of meningoencephalomyelitis of unknown origin since 2009: A review of 671 cases. Front. Vet. Sci. 2023, 10, 1114798.
[4] Brady, S.L.; Woodward, A.P.; le Chevoir, M. Survival time and relapse in dogs with meningoencephalomyelitis of unknown origin treated with prednisolone and ciclosporin: A retrospective study. Aust. Vet. J. 2020, 98, 491–498.
[5] Barber, R.; Downey Koos, L. Treatment with Cytarabine at Initiation of Therapy with Cyclosporine and Glucocorticoids for Dogs with Meningoencephalomyelitis of Unknown Origin Is not Associated with Improved Outcomes. Front. Vet. Sci. 2022, 9, 925774.
[6] Lawn, R.W.; Harcourt-Brown, T.R. Risk factors for early death or euthanasia within 100 days of diagnosis in dogs with meningoencephalitis of unknown origin. Vet. J. 2022, 287, 105884.
[7] Beasley, M.J.; Shores, A. Perspectives on pharmacologic strategies in the management of meningoencephalomyelitis of unknown origin in dogs. Front. Vet. Sci. 2023, 10, 1167002.
[8] Bhatti, S.F.; De Risio, L.; Muñana, K.; Penderis, J.; Stein, V.M.; Tipold, A.; Berendt, M.; Farquhar, R.G.; Fischer, A.; Long, S.; et al. International Veterinary Epilepsy Task Force consensus proposal: Medical treatment of canine epilepsy in Europe. BMC Vet. Res. 2015, 11, 176.
[9] Podell, M.; Volk, H.A.; Berendt, M.; Löscher, W.; Muñana, K.; Patterson, E.E.; Platt, S.R. 2015 ACVIM Small Animal Consensus Statement on Seizure Management in Dogs. J. Vet. Intern. Med. 2016, 30, 477–490.
[10] Shin, J.H.; Lee, Y.A.; Lee, J.K.; Lee, Y.B.; Cho, W.; Im, D.S.; Lee, J.H.; Yun, B.S.; Springer, J.E.; Gwag, B.J. Concurrent blockade of free radical and microsomal prostaglandin E synthase-1-mediated PGE2 production improves safety and efficacy in a mouse model of amyotrophic lateral sclerosis. J. Neurochem. 2012, 122, 952–961.
[11] Ryu, B.R.; Lee, Y.A.; Won, S.J.; Noh, J.H.; Chang, S.Y.; Chung, J.M.; Choi, J.S.; Joo, C.K.; Yoon, S.H.; Gwag, B.J. The novel neuroprotective action of sulfasalazine through blockade of NMDA receptors. J. Pharmacol. Exp. Ther. 2003, 305, 48–56.
[12] Baek, I.S.; Kim, T.K.; Seo, J.S.; Lee, K.W.; Lee, Y.A.; Cho, J.; Gwag, B.J.; Han, P.L. AAD-2004 attenuates progressive neuronal loss in the brain of Tg-betaCTF99/B6 mouse model of Alzheimer disease. Exp. Neurobiol. 2013, 22, 31–37.
[13] Ikeda-Matsuo, Y. The role of mPGES-1 in inflammatory brain diseases. Biol. Pharm. Bull. 2017, 40, 557–563.
[14] Chaudhry, U.A.; Zhuang, H.; Crain, B.J.; Doré, S. Elevated microsomal prostaglandin-E synthase-1 in Alzheimer’s disease. Alzheimers Dement. 2008, 4, 6–13.
[15] Lee, H.H.; Moon, Y.; Shin, J.S.; Lee, J.H.; Kim, T.W.; Jang, C.; Park, C.; Lee, J.; Kim, Y.; Kim, Y.; et al. A novel mPGES-1 inhibitor alleviates inflammatory responses by downregulating PGE2 in experimental models. Prostaglandins Other Lipid Mediat. 2019, 144, 106347.
[16] Herzig, R.; Beckmann, K.; Körner, M.; Steffen, F.; Rohrer Bley, C. A shortened whole brain radiation therapy protocol for meningoencephalitis of unknown origin in dogs. Front. Vet. Sci. 2023, 10, 1132736.
[17] Nessler, J.N.; Oevermann, A.; Schawacht, M.; Gerhauser, I.; Spitzbarth, I.; Bittermann, S.; Steffen, F.; Schmidt, M.J.; Tipold, A. Concomitant necrotizing encephalitis and granulomatous meningoencephalitis in four toy breed dogs. Front. Vet. Sci. 2022, 9, 957285.
[18] Kedare, S.B.; Singh, R.P. Genesis and development of DPPH method of antioxidant assay. J. Food Sci. Technol. 2011, 48, 412–422.
[19] Ranguelova, K.; Mason, R.P. The fidelity of spin trapping with DMPO in biological systems. Magn. Reson. Chem. 2011, 49, 152–158.
[20] Buettner, G.R. Spin trapping: ESR parameters of spin adducts. Free Radic. Biol. Med. 1987, 3, 259–303.
[21] Günther, C.; Steffen, F.; Alder, D.S.; Beatrice, L.; Geigy, C.; Beckmann, K. Evaluating the use of cytosine arabinoside for treatment for recurrent canine steroid-responsive meningitis-arteritis. Vet. Rec. 2020, 187, e7.
[22] Fukushima, K.; Lappin, M.; Legare, M.; Veir, J. A retrospective study of adverse effects of mycophenolate mofetil administration to dogs with immune-mediated disease. J. Vet. Intern. Med. 2021, 35, 2215–2221.