
| 一般情况 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:12岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:心房动脉血栓栓塞症 | |
01 主诉及病史
突然出现后肢麻痹和发冷,无外伤史。
02 检查
体温过低(35.8°C)、呼吸急促(42次/分)。后肢疼痛,粘膜苍白。双侧股动脉搏动消失。
胸部听诊有噼啪声,但无心脏杂音。心率为192次/分,收缩压为130 mmHg。左右后肢外周静脉乳酸分别为10.8和15.2 mmol/L(0.39-2.87),明显高于前肢(右侧4.2,左侧5.8)。
血清肌酐浓度升高(3.0 mg/dL,范围:0.3-2.1)、血糖升高(342 mg/dL,范围:70-150)。尿素氮正常。肌酸磷酸激酶明显偏高(>10,000 IU/L,范围:42-530)。AST和ALT升高(1,398和252 U/L,范围:6-44和20-107),碱性磷酸酶和γ-谷氨酰转移酶活性在正常范围内。活化部分凝血活酶时间和凝血酶原时间分别延长至200秒(75-105)和35秒(14-19),血小板减少得到证实(131×10^3/μL,范围:151-600)。
胸片显示心脏增大,在心尖周围观察到弥漫性肺间质形态。根据影像学表现,怀疑是心源性肺水肿,于是静脉注射呋塞米2 mg/kg和丁吗啡醇0.2 mg/kg镇静镇痛,并补充氧气。使用芬太尼贴片控制疼痛。两小时后呼吸急促症状缓解。
超声心动图显示,左心房与主动脉根部比值增大(2.02,范围<1.5),舒张末期室间隔和左心室游离壁增厚(6.8和6.7 mm,范围<6.0)(下图AB)。缩张率降至25.3%(30%-50%),表明心脏收缩功能障碍。未观察到左心室流出道阻塞或二尖瓣收缩期前移(下图C)。

腹部超声检查未发现主动脉闭塞。彩色多普勒超声显示,股动脉血流未流向后肢。甲状腺素浓度正常,排除甲状腺功能亢进。根据临床表现及放射学、超声心动图和实验室结果,怀疑是心肌病引起的动脉血栓栓塞症(ATE)和充血性心力衰竭。
03 治疗
为防止新血栓形成,皮下注射达肝素(150 IU/kg,q8h)、口服利伐沙班(2 mg/kg,q24h)和氯吡格雷(1 mg/kg,q24h)。溶栓药物组织纤溶酶原激活剂(tPA)以1 mg/kg静脉注射4小时。
8小时后,猫出现唾液分泌过多和心动过缓,芬太尼贴片换成了丁啡诺,后涎液分泌过多和心动过缓症状消失,猫也没有出现任何疼痛反应。为改善心肌收缩力,给猫口服皮莫本丹(1.25 mg/cat,q12h)。
12小时后,体温改善至38.9°C,但观察到了高钾血症和代谢性酸中毒(静脉血pH值7.09,静脉血碳酸氢盐9.6,钾7.5 mmol/L)。给猫静脉注射普通胰岛素0.5 IU/kg和50%葡萄糖1 g/kg以纠正高钾血症,并每隔2小时监测一次血糖。
3天后,双侧股动脉搏动可轻微触及,表明供血情况有所改善。多普勒超声证实双侧股动脉的血流量。然而后肢瘫痪并未缓解,后肢周围出现水肿,表明可能存在肌肉损伤。生化分析结果显示,AST(3250 U/L)和CPK(>10,000 U/L,范围:42-530)严重升高,表明肌肉损伤;SAA(141.82 mg/L,范围:0-10)升高,表明缺血导致炎症状态。尿素氮和肌酐浓度分别升高至110.1 mg/dL(18-33)和9.1 mg/dL(0.7-1.8)。双脚垫上都发现了疑似缺血造成的瘀青坏死伤口。为了达到抗血栓和调节血管的效果,氯吡格雷的剂量增加到了1.5 mg/kg(PO,q24h)。
6天后,左足垫上的坏死病灶向近端区域发展。超声显示降主动脉到股动脉之间没有血栓形成。猫没有任何疼痛反应,运动功能也没有恢复。BUN升至176.3 mg/dL,SAA升至318.06 mg/L。检测到中性粒细胞减少(1.47×10^3/μL,范围:1.48-10.29)和左移。考虑到缺血性坏死可能导致细菌栓塞的风险增加,截肢被认为是一种积极的治疗方法。
04 预后
进行18F-FDG PET/CT检查以评估肌肉的代谢活动并确定截肢程度。PET图像显示,双侧胫骨周围的肌肉和双侧大腿肌肉的尾部没有摄取18F-FDG,而左侧大腿肌肉部分摄取增加(下图A)。左侧胫骨区域的平均SUV为0.29,最大SUV为1.75,右侧胫骨区域的平均SUV为0.08,最大SUV为0.48。股骨周围两块尾部肌肉的18F-FDG摄取也较低,平均SUV为0.06,最大SUV为0.24。左大腿肌肉平均SUV值为3.78,最大SUV值为8.26(下图BC)。前肢平均SUV值和最大SUV值分别为0.92和1.47。
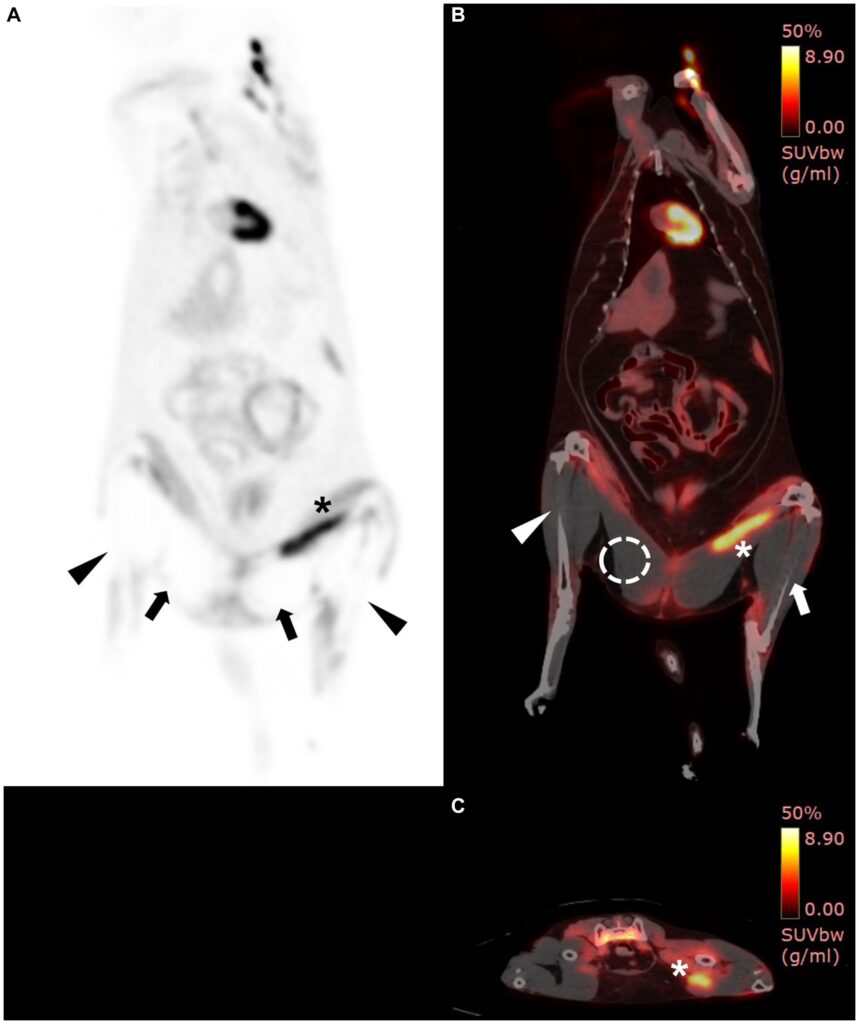
上述结果显示,该猫的大部分区域没有新陈代谢活动,因此考虑进行积极的截肢手术,包括双侧后肢、盆骨和泌尿生殖系统。然而,由于怀疑截肢后生活质量会下降,预后不佳,因此没有实施截肢手术,而是应主人的要求实施了安乐死。
05 尸检
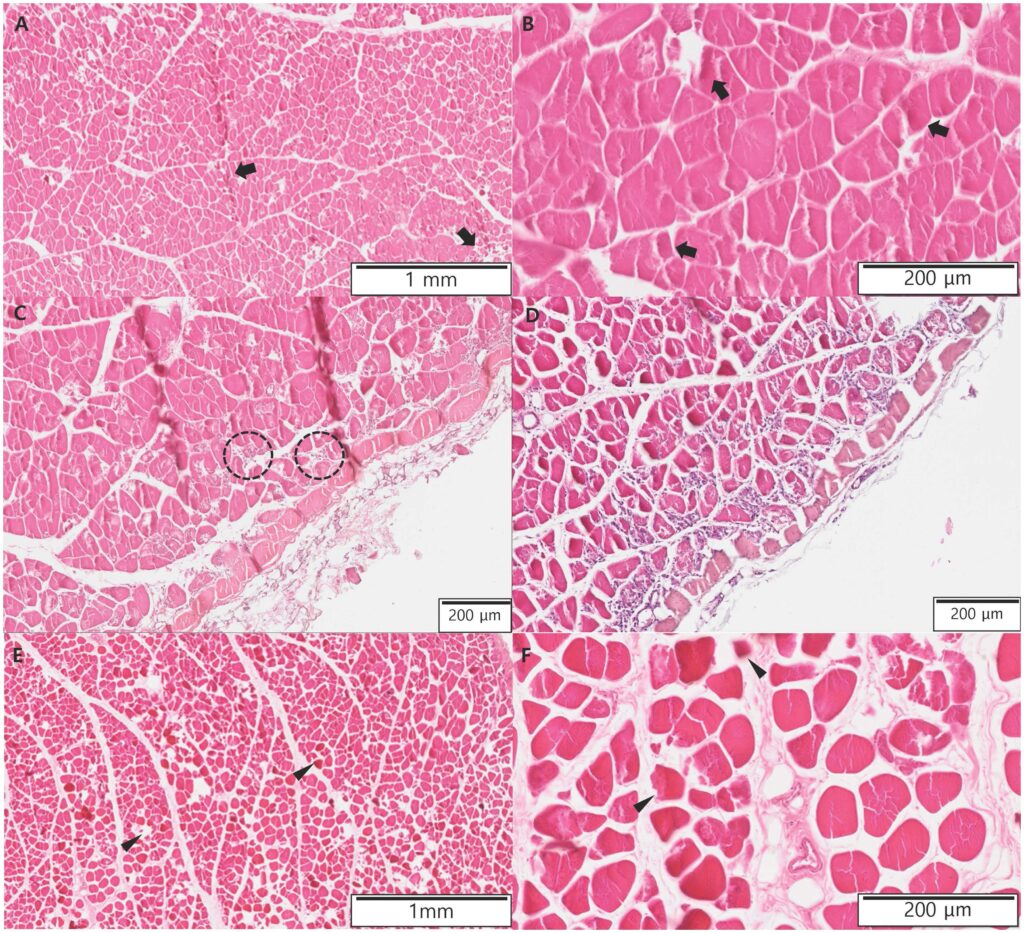
对左股骨和右小腿的部分肌肉进行了活检。组织病理学显示,左股骨肌肉中的一些肌纤维呈嗜酸性细胞增生并萎缩(下图AB)。在平均SUV值较高的左大腿部位观察到肌肉炎症区域(下图CD)。与此相反,在右小腿,大多数肌肉纤维呈高嗜酸性、萎缩,周围有明显的空隙(下图EF)。组织病理学结果与缺血性周围神经损伤和神经病变导致的肌纤维去神经支配性萎缩一致。
06 讨论
动脉血栓栓塞症(Arterial thromboembolism,ATE)是指由栓塞物(主要是血栓)引起的一个或多个动脉床的梗塞[1]。肥厚性心肌病是与猫科动物ATE相关的最常见的潜在疾病[1,2]。其他疾病,包括肿瘤(如肺癌)和甲状腺机能亢进也是猫科动物ATE的已知危险因素[3]。ATE可能会导致身体部位的血流中断,从而引起缺血性神经肌病(INM)[4]。INM最常见的症状是骨盆肢体瘫痪或麻痹,没有节段反射或肌肉僵硬疼痛。
INM的治疗包括防止形成新的血栓,通过使用抗血栓药物改善梗死器官的血流,以及控制潜在的病因[2,5,6]。如果无法恢复神经功能,截肢可降低因组织坏死、细菌栓塞和炎症导致的死亡风险[3,7]。
要进行截肢手术,就必须区分缺血性外周血管疾病患者的不可存活组织和可挽救组织。评估组织灌注的方法包括正对比血管造影、多普勒超声和热成像。然而这些方法检测毛细血管灌注的能力有限,因为这些方法最适合评估浅表或大血管灌注。核技术,如闪烁照相和正电子发射断层扫描/计算机断层扫描(PET/CT),使用放射性核素来评估组织的灌注情况[8]。PET/CT还能提供三维信息。
使用18F-氟脱氧葡萄糖(18F-FDG)的PET/CT已被用于评估外周血管疾病患者的骨骼肌活力[9]。18F-FDG是一种用18F放射性同位素标记的葡萄糖分子,用于评估器官和组织的葡萄糖代谢[10,11]。组织对18F-FDG的摄取不足表明组织已失去活力或坏死[12]。
在兽医学中,18F-FDG在健康猫体内的分布情况已经有所描述,而在患有肿瘤的猫体内使用18F-FDG的信息有限[13,14]。还没有描述过使用PET/CT评估患有动脉疾病(如ATE)猫的骨骼肌肉缺血情况。因此,本病例报告旨在描述使用PET/CT评估心源性ATE引起的INM猫后肢肌肉的代谢活动。
在本病例中,猫被怀疑患有心源性ATE。尽管进行了抗血栓和溶栓治疗,但左足垫上的坏死病灶仍向近端发展。虽然超声检查证实双侧股动脉血流通畅,但后肢运动功能仍未恢复,因此考虑截肢,以防止缺血组织坏死导致败血症恶化。
PET/CT显示后肢18F-FDG摄取较低,根据组织病理学检查诊断为骨骼肌肉萎缩。根据神经系统的临床症状(如后肢麻痹和感觉减退)和组织病理学结果显示的肌纤维坏死和肌纤维变性萎缩,该猫被诊断为INM。
在兽医学中,符合五个P时即可诊断为ATE:无脉(pulselessness)、疼痛(pain)、苍白(pallor)、瘫痪(paresis)和体温过低(poikilothermia)。使用多普勒超声对动脉血流进行评估可为ATE诊断提供额外支持。多普勒超声检查显示无血流提示可能存在ATE[3]。
这只猫有五个P症状,受影响的后肢乳酸浓度高于前肢,表明后肢血流不畅和低氧血症[26]。根据超声心动图,怀疑血栓栓塞源于肥厚性心肌病导致的左心房扩张。根据甲状腺检查结果,排除了甲状腺功能亢进。根据PET/CT检查结果排除肿瘤的可能性。
虽然使用外源性溶栓药物不是标准的治疗方法,但在本病例中还是使用了tPA,因为该猫表现出急性临床症状和不良预后因素,如体温过低和双侧后肢受累。值得注意的是,tPA可直接作用于特定血栓,从而溶解交联纤维蛋白。
先前研究表明,在同时进行血栓预防的过程中,服用tPA不会恶化预后或导致更高的出血风险[27,28]。为避免再灌注损伤等不良反应,每4小时对电解质进行一次监测。在补充液体和纠正电解质后,双侧股动脉搏动恢复。尽管进行了药物治疗,但患者的运动功能并未恢复,坏死病灶扩大。为了减少缺血性坏死病灶引起的全身影响,如败血症和细菌栓塞,考虑采取截肢手术作为积极的治疗手段。
在这种情况下,有三种假设可以解释为什么尽管血流恢复了但后肢功能却没有恢复。首先,灌注改善后肌肉恢复的时间可能不足。由于INM的恢复通常需要7天到3周,肌肉需要更多的时间从缺血性损伤中恢复过来[29]。然而在本病例中,没有进一步确认肌肉恢复情况,因为本病例在PET成像后应主人要求进行了安乐死。
其次,血流阻断可能是局部的,血管活性物质(如血小板中的血清素)可能导致侧支血管塌陷,从而导致侧支血流不畅[8,30,31]。使用多普勒超声确认了双侧股动脉的血流情况,但直接通向组织的微循环可能已被阻断,多普勒无法确认这种微循环[3]。最后,潜在心脏病导致的心输出量下降可能加剧了后肢血流的不足[3]。
目前,在兽医学中使用核医学技术评估肢体灌注的情况非常有限[8]。这是首例在组织学诊断为ATE缺血性骨骼肌萎缩的临床病例中显示PET/CT结果的报道。该研究结果表明,PET/CT可以通过确认组织的新陈代谢损失来确定其存活能力和截肢程度。还需要进一步的研究来评估PET/CT作为诊断猫缺血性骨骼肌病工具的作用。
参考文献
[1] Hogan DF, Brainard BM. Cardiogenic embolism in the cat. J Vet Cardiol. (2015) 17:S202–14.
[2] Atkins CE, Gallo AM, Kurzman ID, Cowen P. Risk factors, clinical signs, and survival in cats with a clinical diagnosis of idiopathic hypertrophic cardiomyopathy: 74 cases (1985-1989). J Am Vet Med Assoc. (1992) 201:613–8.
[3] Smith SA, Tobias AH. Feline arterial thromboembolism: an update. Vet Clin North Am Small Anim Pract. (2004) 34:1245–71.
[4] Sykes JE. Ischemic neuromyopathy due to peripheral arterial embolization of an adenocarcinoma in a cat. J Feline Med Surg. (2003) 5:353–6.
[5] Hogan DF, Fox PR, Jacob K, Keene B, Laste NJ, Rosenthal S, et al.. Secondary prevention of cardiogenic arterial thromboembolism in the CAT: the double-blind, randomized, positive-controlled feline arterial thromboembolism; clopidogrel vs. aspirin trial (FAT CAT). J Vet Cardiol. (2015) 17:S306–17.
[6] Fuentes VL, Abbott J, Chetboul V, Côté E, Fox PR, Häggström J, et al.. ACVIM consensus statement guidelines for the classification, diagnosis, and management of cardiomyopathies in cats. J Vet Intern Med. (2020) 34:1062–77.
[7] McAndrew MP, Lantz BA. Initial Care of Massively Traumatized Lower Extremities. Clin Orthop Relat R. (1989) 243:20–9.
[8] Goggin JM, Hoskinson JJ, Carpenter JW, Roush JK, McLaughlin RM, Anderson DE. Scintigraphy assessment of distal perfusion in 17 patients. Vet Radiol Ultrasoun. (1997) 38:211–20.
[9] Chou TH, Stacy MR. Clinical applications for radiotracer imaging of lower extremity peripheral arterial disease and critical limb ischemia. Mol Imaging Biol. (2020) 22:245–55.
[10] Yao Y, Li YM, He ZX, Civelek AC, Li X-F. Likely common role of hypoxia in driving 18F-FDG uptake in Cancer, myocardial ischemia. Inflamm Infection Cancer Biother Radiopharm. (2021) 36:624–31.
[11] Yun T, Koo Y, Kim H, Lee W, Kim S, Jung D-I, et al.. Case report: long-term chemotherapy with hydroxyurea and prednisolone in a cat with a meningioma: correlation of FDG uptake and tumor grade assessed by histopathology and expression of Ki-67 and p53. Front Vet Sci. (2021) 8:576839.
[12] Cheng G, Akers SR, Chamroonrat W, Alavi A, Zhuang H. Absence of FDG uptake in a trauma patient with compromised vasculature as evidence of tissue nonviability. Clin Nucl Med. (2011) 36:959.
[13] Chae Y, Yun T, Koo Y, Lee D, Kim H, Yang M-P, et al.. Characteristics of physiological 18F-Fluoro-2-deoxy-D-glucose uptake and comparison between cats and dogs with positron emission tomography. Front Vet Sci. (2021) 8:708237.
[14] Randall EK, Kraft SL, Yoshikawa H, LaRue SM. Evaluation of 18F-FDG PET/CT as a diagnostic imaging and staging tool for feline oral squamous cell carcinoma. Vet Comp Oncol. (2016) 14:28–38.
[15] Redavid LA, Sharp CR, Mitchell MA, Beckel NF. Plasma lactate measurements in healthy cats. J Vet Emerg Crit Care. (2012) 22:580–7.
[16] Litster AL, Buchanan JW. Vertebral scale system to measure heart size in radiographs of cats. J Am Vet Med Assoc. (2000) 216:210–4.
[17] Campbell FE, Kittleson MD. The effect of hydration status on the echocardiographic measurements of Normal cats. J Vet Intern Med. (2007) 21:1008–15.
[18] Fox PR, Liu SK, Maron BJ. Echocardiographic assessment of spontaneously occurring feline hypertrophic cardiomyopathy: an animal model of human disease. Circulation. (1995) 92:2645–51.
[19] Kang S, Koo Y, Yun T, Chae Y, Lee D, Kim H, et al.. Use of 18F-2-deoxy-2-fluoro-D-glucose positron emission tomography/computed tomography for staging thyroid carcinoma in a cat. Vet Med Sci. (2023) 9:1026–30.
[20] Goggs R, Bacek L, Bianco D, Koenigshof A, Li RHL. Consensus on the rational use of Antithrombotics in veterinary critical care (CURATIVE): domain 2-defining rational therapeutic usage. J Vet Emerg Crit Care. (2019) 29:49–59.
[21] Smith SA, Tobias AH, Jacob KA, Fine DM, Grumbles PL. Arterial thromboembolism in cats: acute crisis in 127 cases (1992–2001) and long-term management with low-dose aspirin in 24 cases. J Vet Intern Med. (2003) 17:73–83.
[22] Borgeat K, Wright J, Garrod O, Payne JR, Fuentes VL. Arterial thromboembolism in 250 cats in general practice: 2004-2012. J Vet Intern Med. (2014) 28:102–8.
[23] Lascelles BD, Robertson SA. Antinociceptive effects of hydromorphone, butorphanol, or the combination in cats. J Vet Intern Med. (2004) 18:190–5.
[24] Hogan DF, Widmer W. In vivo vasomodulating effects of clopidogrel in an experimental feline infarction model. Arterioscler Thromb Vasc Biol. (2006) 26:e105.
[25] Valentine BA. Chapter 15 – skeletal muscle. Pathol Basis of Vet Dis (Sixth Edition). (2017) 908–953.e1.
[26] Tosuwan J, Hunprasit V, Surachetpong SD. Usefulness of peripheral venous blood gas analyses in cats with arterial thromboembolism. Int J Vet Sci Med. (2021) 9:44–51.
[27] Moore K, Morris N, Dhupa N, Murtaugh R, Rush J. Retrospective study of streptokinase administration in 46 cats with arterial thromboembolism. J Vet Emerg Crit Care. (2000) 10:245–57.
[28] Guillaumin J, DeFrancesco TC, Scansen BA, Quinn R, Whelan M, Hanel R, et al.. Bilateral lysis of aortic saddle thrombus with early tissue plasminogen activator (BLASTT): a prospective, randomized, placebo-controlled study in feline acute aortic thromboembolism. J Feline Med Surg. (2022) 24:e535–45.
[29] Griffiths I, Duncan I. Ischaemic neuromyopathy in cats. Vet Rec. (1979) 104:518.
[30] Olmstead ML, Butler HC. Five-hydroxytryptamine antagonists and feline aortic embolism. J Small Anim Pract. (1977) 18:247–59.
[31] Schaub RG, Meyers KM, Sande RD, Hamilton G. Inhibition of feline collateral vessel development following experimental thrombolic occlusion. Circ Res. (2018) 39:736–43.