
| 病例1 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:14岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:肠道腺癌伴骨样化生 | |
01 主诉及病史
1-2个月前出现排便困难。
02 检查
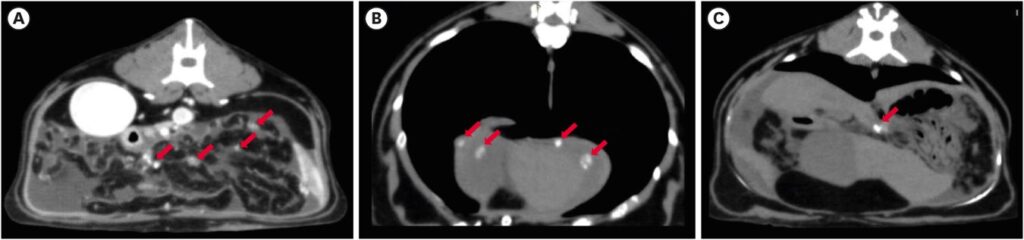
体格检查没有发现明显异常。CT显示膀胱附近的结肠壁局灶性增厚,大小为1.42 cm。增强对比后发现边缘强化(下图A)。在结肠腔外区域发现了两个肿大淋巴结,分别为1.34×0.78 cm和1.03×0.76 cm,增强对比后显示边缘强化(下图B)。其他器官未发现转移迹象。

03 手术
进行了结肠切除和吻合术。病理学检查显示,相当一部分肠粘膜被肿瘤组织取代,并侵入粘膜下层、肌肉、浆膜和邻近肠系膜(下图A)。肿瘤细胞形成小管,管腔中含有不同数量的蛋白物质(下图B)。
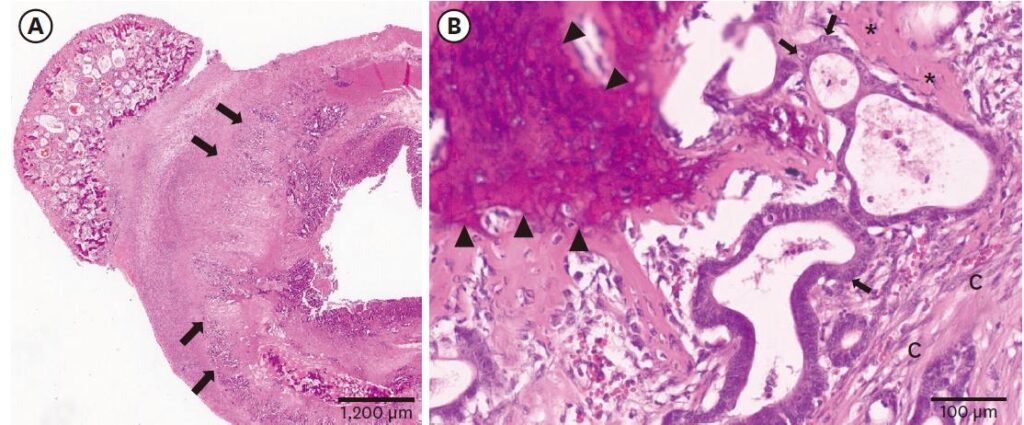
单个肿瘤细胞呈柱状,具有中度嗜酸性胞质和圆形带明显核仁的核仁。核质比为中度到高度,异形核为轻度到中度。有丝分裂指数较高,每个高倍视野有1-3个有丝分裂。肿瘤细胞周围偶尔可见明显的纤维结缔组织增生。在肿瘤表面和浆膜表面出现由骨小梁和类骨基质组成的多灶性骨化区。根据形态学特征,患者被诊断为伴有骨样化生的肠腺癌。
04 预后
术后七周,患者出现腹胀,腹腔穿刺取出了400 mL腹水。CT显示肠系膜、膈肌和胃贲门有多个钙化结节,表明腹腔内有播散性转移(下图)。
此外,肠系膜上有脂肪滞留的迹象,表明存在严重的腹膜炎。检查中未发现任何潜在疾病。初步诊断后约两个月,猫在家中死亡。
| 病例2 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:13岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:肠道腺癌伴骨样化生 | |
05 主诉及病史
一个月前开始频繁呕吐。
06 检查
体格检查未发现异常。CT显示小肠上有一个2.61×1.39 cm肿块(下图)。在肠系膜上还发现了多个钙化结节,提示有钙化的播散性转移灶。

07 手术
一周后进行了小肠切除和吻合术(下图)。

病理学检测发现,小肠肿块由肿瘤细胞组成,显示出对粘膜下层、肌层、浆膜层和邻近肠系膜的侵袭(下图A)。大多数肿瘤细胞呈柱状上皮,形成管状结构,内含大量嗜碱性粘液物质。异形细胞和异形核明显,有丝分裂计数约为每高倍视野1-3个(下图B)。在肿瘤多灶区域和浆膜表面观察到骨样分化,可见骨小梁,内衬成骨细胞和散在的破骨细胞。在肠系膜中观察到肿瘤侵入肠浆膜和骨样分化(下图CD)。患者被诊断为肠粘液腺癌伴骨样化生。

08 预后
术后主人拒绝化疗,选择了临终关怀。术后5个月未发现复发或转移,但猫开始出现厌食和嗜睡。这只猫在确诊约7个月后被安乐死。
09 讨论
猫的肠腺癌骨样化生比其他物种更常见[1]。虽然已有多篇关于猫肠道肿瘤的系统性综述,但这些研究大多只关注骨样化生的发生频率[2,3,4,5]。由于病例报告的数量较少,有关猫科动物肠腺癌伴骨样化生的临床和病理特征(如易感性、信号和生物学行为)的信息仍然有限。本病例报告描述了在两只韩国短毛猫中诊断出的转移性猫肠道腺癌伴骨样化生的临床和组织病理学特征。
猫肠道腺癌是仅次于淋巴瘤的第二大常见肠道肿瘤[1]。通常在11岁左右发病,无性别倾向,暹罗猫发病率较高[3,4]。目前还不清楚猫科动物肠腺癌最常见的部位是小肠还是大肠。偶尔也有猫肠腺癌骨样化生的报道[3,5]。最近对50例猫科动物结直肠上皮肿瘤的研究表明,骨样化生现象约占20%-25%,且与生物学行为无关。
猫肠道腺癌骨样化生的发病机制尚不确定,但人类医学已提出了几种假说。粘蛋白、坏死、基质和来自肿瘤细胞的物质被认为是导致骨样化生的刺激因素[6,7,8]。病例1在肿瘤组织和成骨组织周围观察到结缔组织。病例2在腔内以及肿瘤组织和成骨组织周围观察到大量粘蛋白。考虑到这些发现,作者推测基质和/或粘蛋白因素会刺激猫肠道腺癌的骨样化生。
虽然最近的一篇论文认为骨样化生与肿瘤恶性程度无关[5],但考虑到粘蛋白类型与预后较差有关[9],以及恶性程度较高与出现较多坏死病灶有关的普遍趋势,两者之间似乎不可能没有关联。要弄清猫肠道腺癌骨样化生的起源和机制,还需要进一步的研究。在成像分析中,这两例患者的原发灶和转移灶都出现了钙化。只有一项研究报道了猫骨盆肢体肌肉组织中伴有骨样化生的转移性腺癌,但无法确定腺癌的原发部位[10]。
在本病例中,转移灶最初在肠系膜和局部淋巴结中发现,最后转移到其他器官。钙化不仅源于良性病变,如贝特体(钙化脂肪沉积)或慢性炎症,也可能是肿瘤诱发骨样化生的表现[11]。因此,如果通过成像分析发现猫体内有钙化,就必须进行全面筛查,以确定原发肿瘤的位置。
猫肠道腺癌转移非常快,大多数病例的平均存活时间不到一年[9,12,13,14]。然而,病例2存活时间相对较长,这可能是因为确诊时没有淋巴结转移,而且在转移的肠系膜与原发肿瘤一起被切除。在人类医学中,与肠腺癌预后相关的因素包括TNM分期、组织学亚型或分级、静脉或淋巴浸润、生长模式以及肿瘤的淋巴细胞浸润[1]。在猫肠腺癌的回顾性研究中,无淋巴结转移的猫存活时间明显延长[9,12]。
在本病例中,另一个可能与预后有关的因素是组织学亚型。一项对11只患有胃肠道腺癌的猫进行的回顾性研究显示,与粘液亚型相比,管状亚型的猫存活时间更长,这与本报告相矛盾[9]。另一个可能与预后有关的因素是原发部位,但目前还不确定猫的预后是否因部位不同而不同[1,3,9]。
本报告描述了两只猫的转移性肠腺癌伴骨样化生的临床和组织病理学特征。临床医生应注意肠腺癌中的骨样化生现象,尤其是在影像学分析中将其作为肠周围钙化灶的鉴别诊断时。此外,本报告还补充了有关淋巴结转移作为猫肠道腺癌不良预后指标的重要性的数据。
参考文献
[1] Munday JS, Löhr CV, Kiupel M. Tumors of the alimentary tract. In: Donald JM, editor. Tumors in Domestic Animals. 5th ed. Ames: John Wiley & Sons; 2016. pp. 499-569.
[2] Patnaik AK, Liu SK, Johnson GF. Feline intestinal adenocarcinoma. A clinicopathologic study of 22 cases. Vet Pathol 1976;13(1):1–10.
[3] Turk MA, Gallina AM, Russell TS. Nonhematopoietic gastrointestinal neoplasia in cats: a retrospective study of 44 cases. Vet Pathol 1981;18(5):614–620.
[4] Rissetto K, Villamil JA, Selting KA, Tyler J, Henry CJ. Recent trends in feline intestinal neoplasia: an epidemiologic study of 1,129 cases in the veterinary medical database from 1964 to 2004. J Am Anim Hosp Assoc 2011;47(1):28–36.
[5] Uneyama M, Chambers JK, Nakashima K, Uchida K, Nakayama H. Histological classification and immunohistochemical study of feline colorectal epithelial tumors. Vet Pathol 2021;58(2):305–314.
[6] Haque S, Eisen RN, West AB. Heterotopic bone formation in the gastrointestinal tract. Arch Pathol Lab Med 1996;120(7):666–670.
[7] Lauwers GY, Wahl SJ, Richard GK. Osseous metaplasia in colonic adenocarcinoma. Am J Gastroenterol 1991;86(3):382.
[8] Liu X, Xu J, Chen L. Colorectal carcinoma with osseous metaplasia. Oncotarget 2017;8(39):65407–65413.
[9] Cribb AE. Feline gastrointestinal adenocarcinoma: a review and retrospective study. Can Vet J 1988;29(9):709–712.
[10] Ives EJ, Vanhaesebrouck AE, Hughes K. Metastatic adenocarcinoma with osseous metaplasia in the pelvic limb musculature of a cat. J Small Anim Pract 2018;59(2):133.
[11] Thrall DE. The peritoneal space. In: Frank PM, editor. Textbook of Veterinary Diagnostic Radiology-E-Book. 6th ed. Saint Louis: Elsevier Health Sciences; 2017. pp. 659-678.
[12] Slawienski MJ, Mauldin GE, Mauldin GN, Patnaik AK. Malignant colonic neoplasia in cats: 46 cases (1990–1996). J Am Vet Med Assoc 1997;211(7):878–881.
[13] Kosovsky JE, Matthiesen DT, Patnaik AK. Small intestinal adenocarcinoma in cats: 32 cases (1978–1985). J Am Vet Med Assoc 1988;192(2):233–235.
[14] Hume DZ, Solomon JA, Weisse CW. Palliative use of a stent for colonic obstruction caused by adenocarcinoma in two cats. J Am Vet Med Assoc 2006;228(3):392–396.