
| 一般情况 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:10岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:化学感受器瘤 | |
01 主诉及病史
呼吸困难加重。今年秋季出现过气喘。主人以为是野炊时吸入过量烟雾导致。
02 检查
张口呼吸,双侧肺呼吸音减弱,听诊未发现杂音。超声检查显示双侧胸腔中度积液,右侧更明显。肌注丁吗啡醇(0.23 mg/kg)、静注呋塞米(3 mg/kg)后呼吸频率有所下降,但仍急促呼吸。
静注咪达唑仑(0.2 mg/kg)和阿法沙隆(0.75 mg/kg)以进行胸腔穿刺。但患者呼吸频率持续下降,不久后出现心肺骤停。进行心肺复苏后恢复自主呼吸。10分钟后该猫再次出现心跳骤停,再次进行心肺复苏,但没有成功。
03 尸检
营养状况良好,皮下和腹腔内脂肪充足,骨骼肌肉发达。胸腔内有大约700 mL粘稠的透明液体。心包与左右心房紧密粘连,心包腔内有大约5 mL暗红色、略带粘性的液体。
心外膜、心外膜脂肪组织、房间隔、冠状动脉血管外膜、肺动脉和主动脉有多个粘连、坚实、苍白、直径0.3-0.5 cm的结节性肿块,切面由红到白,呈大理石状(下图A)。福尔马林固定后,心脏的纵切面显示出多个坚硬肿块,中心呈红白色,侵蚀了主动脉瓣、肺动脉瓣、房室瓣和两个心房(下图BC)。
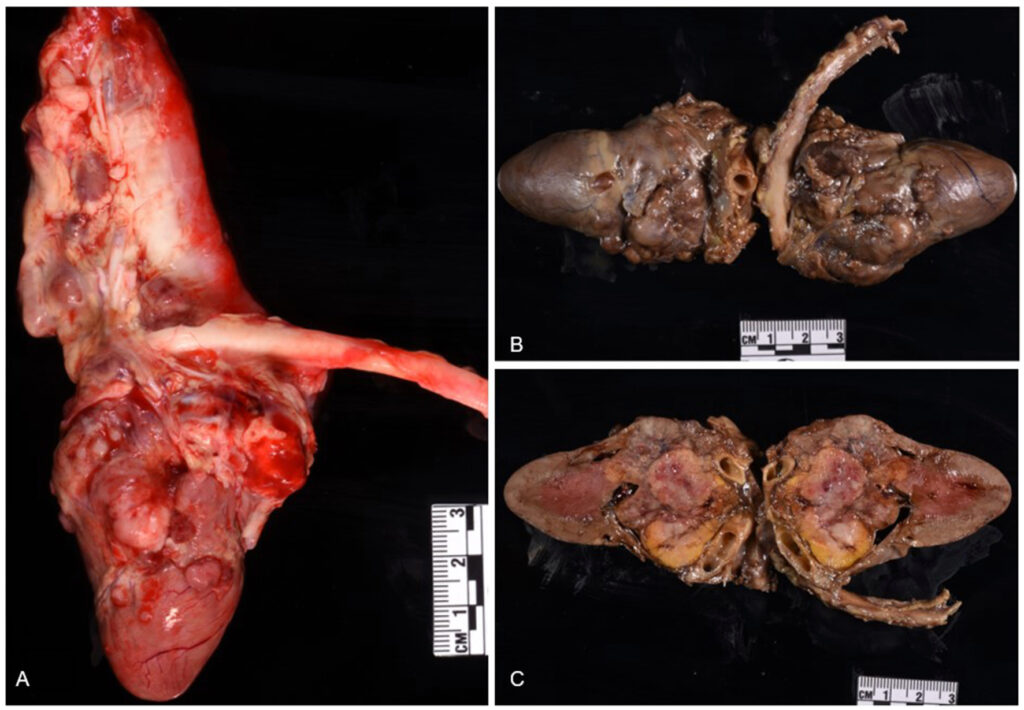
肝叶的有多个棕褐色、坚硬、大小不一的结节性肿块(最大为1.5 × 1 × 0.4 cm),肿块向实质内延伸。左肾弥漫性缩小(长3.5 cm),右肾长5 cm,左肾有1 cm宽的梗死,从皮质延伸到髓质。
对心脏肿块进行显微镜评估后发现,肿块为浸润性、无包膜、边缘不清、细胞密集的多叶肿瘤,由排列成巢状和包块的多角形细胞组成,并由细小的纤维血管基质支撑(下图)。
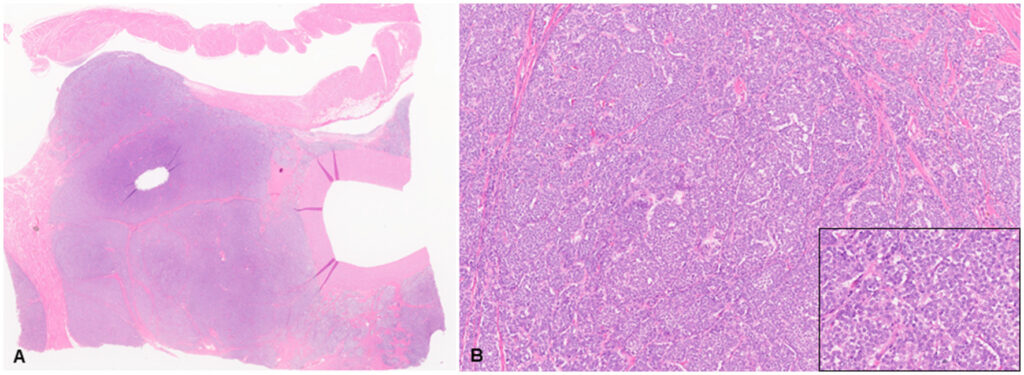
肿瘤细胞有不同程度的细胞边界和中等量的细颗粒状嗜酸性胞质,单个圆形至椭圆形核,染色质呈细条纹状,有明显核仁。细胞轻度异形,中度异形,罕见核分裂。瘤体有多灶性出血和坏死区域,细胞质嗜酸性增高,细胞核脓解和核分裂,很少有中等数量的淋巴细胞和巨噬细胞浸润。
根据类似的组织学和形态学特征,肝脏中的结节与心脏肿瘤的转移一致。对心脏和肝脏肿瘤切片进行了免疫组化分析,结果显示约100%和70%的肿瘤细胞分别对突触素和色粒蛋白A 呈强阳性(下图)。肿瘤细胞的细胞角蛋白AE1/AE3、波形蛋白、甲状腺球蛋白和平滑肌肌动蛋白呈阴性。在肝脏的转移性肿瘤细胞中也发现了类似的现象。

04 讨论
原发性心脏肿瘤在家猫中非常罕见,文献中也鲜有报道。心脏肿瘤包括淋巴瘤、血管肉瘤、横纹肌肉瘤、神经节瘤、转移性肿瘤,以及较少见的主动脉和颈动脉体肿瘤(副神经节瘤/化学感受器瘤)[1-14]。与猫不同,化学感受器瘤(chemodectoma)在狗中很常见,尤其是在短头犬种中,有大量文献详细介绍了这种肿瘤的临床和病理特征以及治疗方法[2,15-17]。
化学感受器瘤一般是由肿瘤性化学感受器细胞组成的良性肿瘤。化学感受器细胞存在于人体多个组织中,包括位于颌下和颅颈部的主动脉体和颈动脉体,以及位于心脏、胰腺、眼睛、耳朵和一些颅神经底部的大血管内膜[18]。
化学感受器细胞能感受体内的pH值、二氧化碳和氧张力的变化,有助于调节包括呼吸和血液循环在内的生理参数[19,20]。这些细胞与肾上腺髓质细胞相似,但它们的绒毛染色呈阴性,因此化学感受器瘤也被称为化学直肠瘤或非色素旁神经节瘤[17]。
在家养动物中,化学感受器瘤通常发生在主动脉体和颈动脉体,但主动脉体的发生率更高[2,12]。化学感受器瘤的发病机制尚未确定,但有几个因素与之有关,包括某些犬种(短头犬)的遗传易感性,特别是慢性缺氧[21]。此外,研究表明生活在高海拔环境中的人和动物(主要是短头犬和牛)的化学感受器瘤发病率会增加,而高海拔环境通常会引起慢性缺氧[17,22,23]。
化学感受器瘤的临床症状大多与肿瘤的占位效应或其他并发症有关,如胸腔积液导致的呼吸急促/呼吸困难或食管受压导致的吞咽困难[24]。因此,生长缓慢的肿瘤在达到临界大小或开始引起继发性病变之前很难进行诊断。尽管化学感受器瘤细胞易碎且脱落性好,但通常在尸体解剖时才能确诊。
在狗身上,尽管化学感受器瘤转移的风险很小,但转移的情况仍存在[1,16,25,26]。手术切除、化疗和/或放疗是人和狗的常规治疗方法[22]。据报道,猫的治疗方案包括胸腔穿刺、化疗和手术。存活时间从确诊后立即安乐死到19个月不等[27]。
迄今为止,有关猫化学感受器瘤的文献报道极少,关于肿瘤局部或远处转移的文献则更少[2,22,24,27]。因此,猫科动物化学感受器瘤的早期诊断和治疗仍有待进一步研究。本报告记录了一例转移性化学感受器瘤病例,重点介绍了有助于诊断家猫化学感受器瘤的常见免疫学诊断标志物。
本报告中的这只猫已经10岁,属于化学感受器瘤的常见年龄范围(10-15岁)。一般来说,老年动物更容易患肿瘤性疾病,这是因为它们长期的DNA损伤或DNA修复机制受损。在犬科动物中,肝、肺、肾、脾、骨髓和淋巴结的转移已有报道[15-17]。
一项研究表明,较高的肿瘤重量与体重比值与犬主动脉体肿瘤的恶性潜能相关。然而,恶性肿瘤的标志物(包括有丝分裂指数和核多形)以及肿瘤细胞的免疫组化标记强度并不是主动脉体肿瘤的恶性程度决定因素[26]。
在本病例中,肿瘤的确切组织来源不明。猫的呼吸困难归因于肿瘤继发的胸腔积液和双侧肺不张。肝脏中的肿瘤细胞突触素和嗜铬粒蛋白A呈强阳性,特异性免疫组化标记排除了甲状腺、上皮和间质肿瘤。综合来看,大体形态、组织学特征和免疫组化反应支持化学感受器瘤转移至肝脏的诊断。
该病例中出现的乳糜胸很可能是继发于肿瘤相关的胸导管破裂(尸检时未观察到)或淋巴静脉吻合处淋巴流出受阻所致[32,33]。在一只患有心底肿瘤的狗身上,通过胸腔内引流导管引流乳糜液可以提高其存活率[32]。
在家猫突然出现呼吸困难、胸腔积液、肺不张和胸腔占位性肿块时,应将化学感受器瘤作为鉴别诊断。免疫组化分析表明,突触素和嗜铬粒蛋白A是诊断猫化学感受器瘤更有用的辅助检查。本病例中的肿瘤由于没有肿瘤特异性临床症状而被认为是无功能性的。还需要进行进一步研究,以调查和预测猫化学感受器瘤的转移潜力以及该疾病的诊断标记物。
参考文献
[1] Aupperle H, März I, Ellenberger C, Buschatz S, Reischauer A, Schoon HA. Primary and secondary heart tumors in dogs and cats. J Comp Path. (2007) 136:18–26.
[2] Treggiari E, Pedro B, Dukes-McEwan J, Gelzer AR, Blackwood L, A. descriptive review of cardiac tumors in dogs and cats. Vet Comparative Oncol. (2017) 15:273–88.
[3] Magalhães HI, Mendonça KG, de Paula YH, Romão FB, Barcelos JB, Dobritz WR, et al. Feline cardiac lymphoma: a case report. Brazilian J Vet Med. (2019) 41:e100019.
[4] Campbell MD, Gelberg HB. Endocardial ossifying myxoma of the right atrium in a cat. Vet Path. (2000) 37:460–2.
[5] Kobayashi R, Ohsaki Y, Yasuno K, Ogihara K, Kasai T, Chambers JK, et al. malignant and metastasizing feline cardiac ganglioneuroma. J Vet Diagn Invest. (2012) 24:412–7.
[6] Venco L, Kramer L, Sola LB, Moccia A. Primary cardiac rhabdomyosarcoma in a cat. J Am Anim Hosp Assoc. (2001) 37:159–63.
[7] Schreeg ME, Evans BJ, Allen J, Lewis MC, Luckring E, Evola M, et al. Cardiac leiomyosarcoma in a cat presenting for bilateral renal neoplasia. J Comp Path. (2019) 168:19–24.
[8] Herrold EJ, Donovan TA, Hohenhaus AE, Fox PR. Giant pericardial-occupying compressive primary cardiac hemangiosarcoma in a cat. J Vet Cardiol. (2020) 29:54–9.
[9] Chalfon C, Romito G, Sabattini S, Rigillo A, Quinci M, Foglia A, et al. Periarticular histiocytic sarcoma with heart metastasis in a cat. Vet Clin Path. (2021) 50:579–83.
[10] Tanaka S, Suzuki R, Hirata M, Kagawa Y, Koyama H. Unusual diagnosis of feline cardiac lymphoma using cardiac needle biopsy. BMC Vet Res. (2022) 18:251.
[11] Santos IR, Raiter J, Lamego ÉC, Bandinelli MB, Dal Pont TP, Siqueira KF, et al. Feline pulmonary carcinoma: Gross, histological, metastatic, and immunohistochemical aspects. Vet Path. (2023) 60:8–20.
[12] Woldemeskel M. Primary cardiac lymphoma in a cat. J Comp Path. (2020) 174:34–8.
[13] Amati M, Venco L, Roccabianca P, Santagostino SF, Bertazzolo W. Pericardial lymphoma in seven cats. J Feline Med Surg. (2014) 16:507–12.
[14] Tillson DM, Fingland RB, Andrews GA. Chemodectoma in a cat. J Am Anim Hosp Assoc. (1994) 30:586–90.
[15] Callanan JJ, McNeil PE, Anderson TJ, Laird H. Metastatic aortic body tumor causing neck pain in a dog. J Small Anim Pract. (1991) 32:525–8.
[16] Szczech GM, Blevins WE, Carlton WW, Cutlan GR. Chemodectoma with metastasis to bone in a dog. Amer Vet Med Assoc J. (1973).
[17] Robinson WF, Robinson NA. “Neoplasms of the heart,” in Kennedy & Palmer’s pathology of domestic animals: Volume 3 p52 Sixth Edition, Jubb M. Amsterdam: Elsevier Health Sciences. (2016).
[18] Adams WE. The comparative morphology of the carotid body and carotid sinus. Thomas. (1958). 44:209–211.
[19] Acker H, Starlinger H. Adenosine triphosphate content in the cat carotid body under different arterial O2 and CO2 conditions. Neurosci Lett. (1984) 50:175–9.
[20] Lahiri S, DeLaney RG. Relationship between carotid chemoreceptor activity and ventilation in the cat. Respir Physiol. (1975) 24:267–86.
[21] Blain GM, Smith CA, Henderson KS, Dempsey JA. Peripheral chemoreceptors determine the respiratory sensitivity of central chemoreceptors to CO2. J Physiol. (2010) 588:2455–71.
[22] Willis R, Williams AE, Schwarz T, Paterson C, Wotton PR. Aortic body chemodectoma causing pulmonary oedema in a cat. J Small Anim Pract. (2001) 42:20–3.
[23] Caruso KJ, Cowell RL, Upton ML, Dorsey KE, Meinkoth JH, Campbell GA. Intrathoracic mass in a cat. Vet Clin Path. (2002) 31:193.
[24] Hansen SC, Smith AN, Kuo KW, Fish EJ, Koehler JW, Martinez-Romero G, et al. Metastatic neuroendocrine carcinoma of aortic body origin in a cat. V Vet Clin Path. (2016) 45:490–4.
[25] Lew FH, McQuown B, Borrego J, Cunningham S, Burgess KE. Retrospective evaluation of canine heart base tumors treated with toceranib phosphate (Palladia): 2011-2018. Vet Comp Oncol. (2019) 17:465–71.
[26] Yamamoto S, Fukushima R, Hirakawa A, Abe M, Kobayashi M, Machida N. Histopathological and immunohistochemical evaluation of malignant potential in canine aortic body tumors. J Comp Path. (2013) 149:182–91.
[27] Saunders R, Kraipowich N, Marshall HC. Intracardiac malignant nonchromaffin paraganglioma (chemodectoma) in a cat. J Vet Cardiol. (2021) 37:1–7.
[28] Yates WD, Lester SJ, Mills JH. Chemoreceptor tumors diagnosed at the Western College of Veterinary Medicine 1967-1979. Can Vet J. (1980) 21:124.
[29] Paola JP, Hammer AS, Smeak DD, Merryman JI. Aortic body tumor causing pleural effusion in a cat. J Am Anim Hosp Assoc. (1994) 41:2.
[30] del Busto I, Stiborova K, Villiers E, Ferreira AJ, Bode EF. Aortic chemodectoma causing a lymphocyte-rich effusion in a cat. Vet Rec Case Rep. (2018) 6:e000620.
[31] Lord S, Bavcar S, Lodzinska J, Gozalo-Marcilla M. Severe hypercapnia associated with a chemodectoma causing profound tracheal narrowing in a cat. Vet Rec Case Rep. (2020) 8:e001232.
[32] Gibson EA, Culp WT, Kent MS, Mayhew PD, Wisner ER, Wells A, et al. Treatment of a heart base tumor and chylothorax with endovascular stent, stereotactic body radiation therapy, and a tyrosine kinase inhibitor in a dog. J Vet Cardiol. (2021) 33:61–8.
[33] Singh A, Brisson B, Nykamp S. Idiopathic chylothorax: pathophysiology, diagnosis, and thoracic duct imaging. Compend Contin Educ Vet. (2012) 34:E2.