
| 一般情况 | |
|---|---|
 | 品种:金毛寻回犬 |
| 年龄:1.5岁 | |
| 性别:雌 | |
| 是否绝育:否 | |
| 诊断:生殖系统T细胞淋巴瘤 | |
01 主诉及病史
3周前出现腹泻和厌食。该犬无服药史,无毒素或异物摄入史,按时接种疫苗。
在发病前约5个月,主人观察到该犬发情,但无法确定是否是最近一次发情。该犬饮水良好,但无法确定是否存在多尿现象。
02 检查
该犬表现出发热(直肠温度40.5℃)、心动过速(180次/分)和呼吸急促(80次/分),血压正常(收缩压136 mmHg)。粘膜苍白粘腻,眼球下陷。乳腺肿胀、柔软,但无疼痛感。触诊可观察到全身腹痛。外阴轻度肿胀,伴有恶臭的脓性阴道分泌物。
全血细胞计数显示白细胞左移和再生性贫血:全血计数31.70×10^3/μL(5.05-16.76),中性粒细胞25.23×10^3/μL(2.95-11.64),单核细胞3.04×10^3/μL(0.16-1.12),淋巴细胞3.28×10^3/μL(1.05-5.10),嗜酸性粒细胞0.03×10^3/μL(0.06-1.23),嗜碱性粒细胞0.12×10^3/μL(0-0.10),网织红细胞445.4×10^3/μL(10.0-110.0)。
血清生化指标异常包括:血清总蛋白4.4 g/dL(5.4-7.1)、白蛋白2.2 g/dL(2.6-3.3)、球蛋白2.2 g/dL(2.7-4.4)和葡萄糖62 mg/dL(65-118)水平降低,血清尿素氮31.8 mg/dL(7-25)、AST 1003 IU/L(23-66)、ALT 2059 IU/L(21-102)、ALP 424 IU/L(29-97)、SDMA 31μg/dL(0-14)、乳酸>12.0 mmol/L(0.5-2.5)、CRP 108.16 mg/L(0-10)水平升高。
血清电解质异常包括钠和总钙浓度轻度降低,以及磷浓度升高。
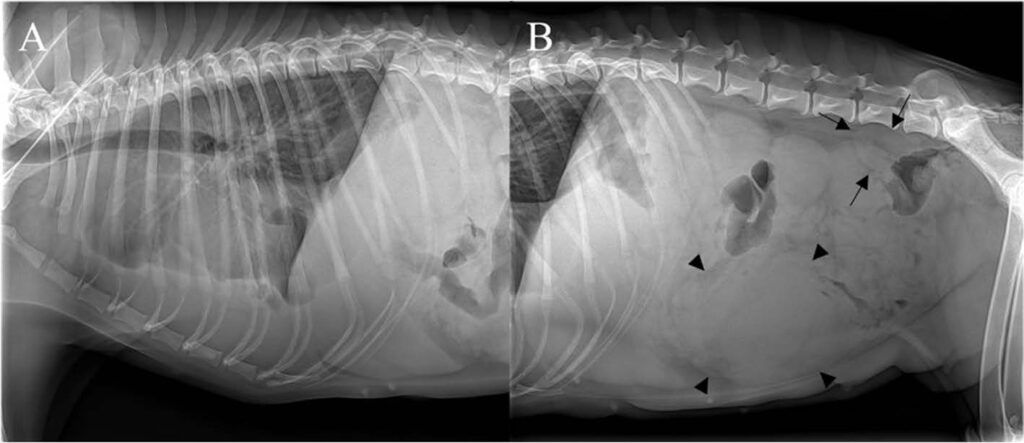
放射线检查显示,心脏轮廓模糊不清,表明存在胸腔积液;腹部疑似腹腔积液。腹部中央可见一椭圆形肿块(13×8.7 cm),压迫小肠中度偏离。膀胱背侧至腹部正中有一个增大的管状结构,呈软组织不透明状;L6-L7有一椭圆形肿块(5.28×3.26 cm),疑似髂内侧淋巴结(下图)。
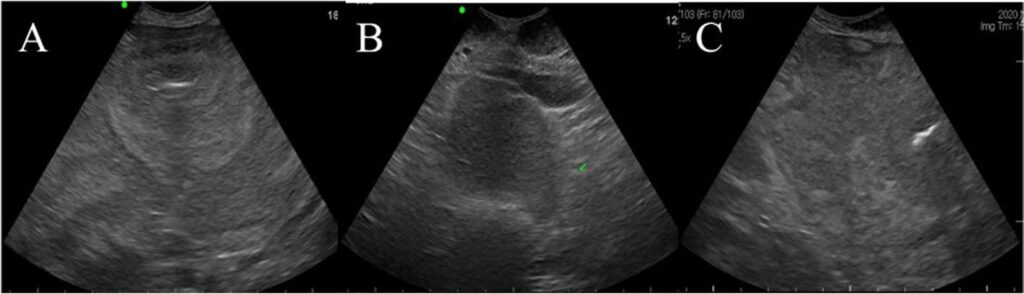
超声检查显示,小肠和大肠的部分肌层增厚(大于0.9 mm和0.7 mm)。腹腔内还观察到游离液体和回声较强的肠系膜脂肪,这些液体位于子宫角周围。子宫角腔内检测到气体和液体,子宫角壁严重增厚,泌尿生殖系统周围发现肿大淋巴结(下图)。
在右侧第7肋间隙进行胸腔穿刺术,以抽取胸腔积液;在右侧尾腹进行腹腔穿刺术,以明确腹水原因。胸腔积液为以淋巴细胞为主的渗出液(总蛋白1.5 g/dL;核细胞总数4670个/μL),腹水同样为以淋巴细胞为主的渗出液(总蛋白1.8 g/dL;核细胞总数10350个/μL)(下图)。
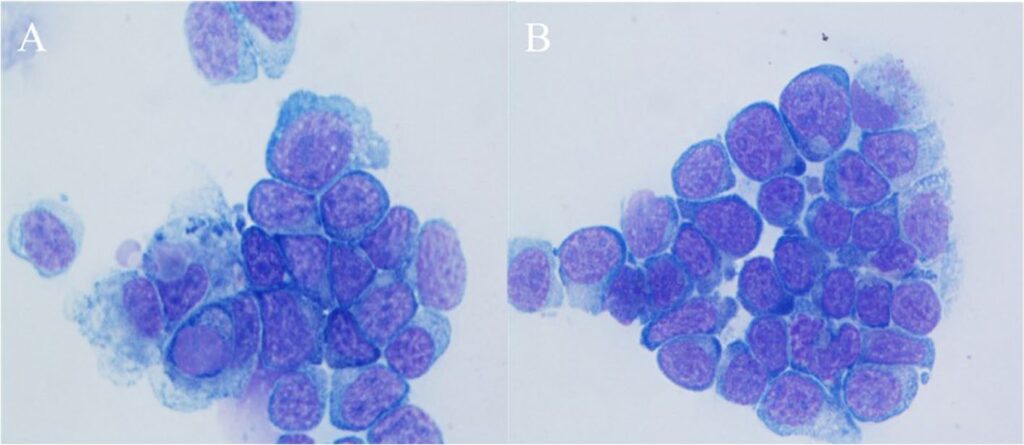
在这两种渗出液中,90%的有核细胞都是淋巴细胞,染色质呈细条纹状至团块状,且常常是偏心的。核小体的大小也各不相同。此外,淋巴细胞有嗜碱性细胞质。细胞学检查显示,两种渗出液中都有大量淋巴母细胞。
03 手术
根据发热、心动过速、呼吸过速和白细胞左移,怀疑为全身炎症反应综合征(SIRS)。此外,超声发现阴道有分泌物、腹部X光片有肿块、子宫腔内有气体和液体、子宫壁严重增厚。因此,医生怀疑是子宫脓肿,于是进行了探查性开腹卵巢切除术,切除了子宫和双侧卵巢。
术前8小时输入了约600 mL全血,以控制贫血。生命体征稳定后,进行了中线切口探查性开腹手术和子宫切除手术。术中发现整个腹部有粉色积液,子宫与卵巢粘连。肝脏、脾脏、胃、胰腺、肾脏和膀胱均未发现明显异常。小肠和大肠的某些部分出现肿胀和发红。卵巢和子宫周围的淋巴结肿大。
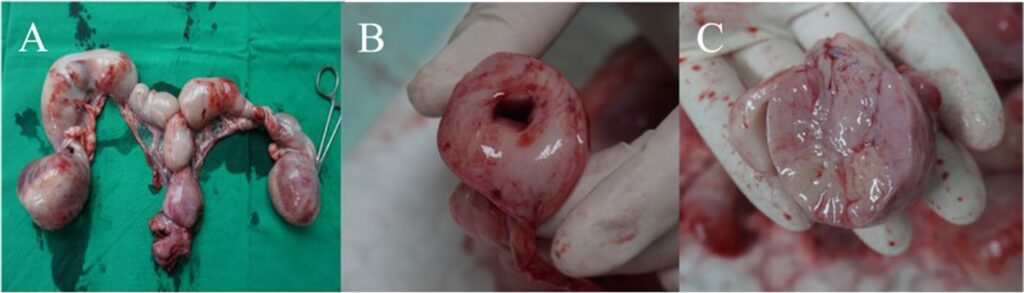
病理结果显示,从外观上看,卵巢和子宫内有多个肿块(下图)。卵巢和子宫都明显增大。子宫横切面上充满了坚硬肿块,并伴有脓性液体。
卵巢组织病理学检查显示,圆形细胞侵入并破坏了肌层,并侵入了附着的肠系膜脂肪。细胞大小约为红细胞的两倍。有丝分裂计数为每10个高倍视野35个,在两个卵巢中都观察到了类似的特征。双侧卵巢均确诊为大细胞淋巴瘤(下图A)。子宫中观察到大圆细胞的肿瘤性增生,并伴有少量炎性细胞,如中性粒细胞和巨噬细胞。与卵巢不同的是,有丝分裂计数为每10个高倍视野42个,未发现血管和淋巴管侵犯。诊断为与卵巢相同的大细胞淋巴瘤(下图B)。
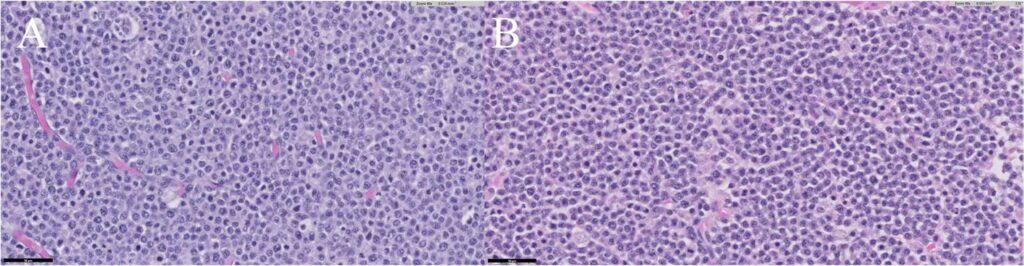
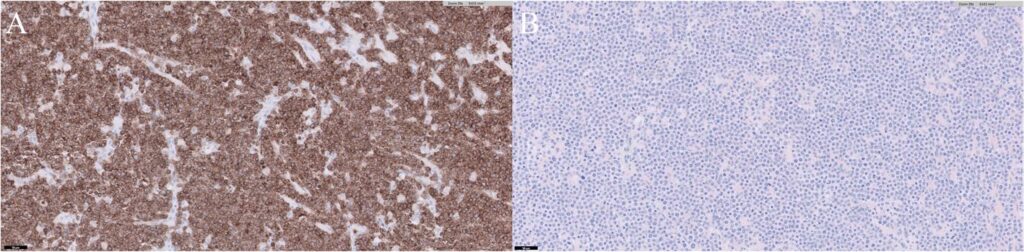
在卵巢和子宫中,弥漫的肿瘤细胞在免疫组化中对CD3呈强阳性,而对PAX5呈阴性(下图)。根据这些结果,患者被诊断为浸润生殖系统的外周T细胞淋巴瘤。
04 预后
卵巢切除术后,该犬在重症监护期间生命体征恶化,表现出持续的心动过速、呼吸急促和低血压。此外,该犬还表现出精神萎靡。基于对预后的担忧,在征得主人同意后对其实施了安乐死。
05 讨论
犬淋巴瘤根据解剖部位可分为:多中心型(占80%)、消化道型(占7%)、皮肤型(占6%)、纵隔型(占3%)和其他部位型(占1%)[1-3]。犬淋巴瘤主要发生于中位年龄为6-9岁的犬,在未绝育的雌性犬中发病率较低[4]。因此,雌性犬生殖道的淋巴瘤非常罕见,尤其是在幼犬中。
雌性犬生殖系统肿瘤可位于三个部位:卵巢、子宫和阴道/外阴。卵巢、子宫和阴道/外阴肿瘤的发病率分别为0.5-1.2%、0.3-0.4%和2.4-3%[5-10]。在雌性犬生殖系统肿瘤中,上皮性肿瘤(腺瘤、腺癌)和子宫肌瘤最为常见,而淋巴瘤则很少见[5,9-17]。
本病例报告描述了一只雌性幼犬生殖系统的外周T细胞淋巴瘤的临床症状、实验室检查结果、影像学特征和组织学特征,该病例极为罕见。
由于本病例的性腺组织病理学检查发现有血管和淋巴管侵犯,因此怀疑可能是从卵巢原发肿瘤转移而来。然而,由于没有进行全面的尸检,这一怀疑仍然是推测性的。
在本病例中,由于淋巴瘤的来源不明确,作者考虑了两种情况。第一种情况是淋巴结外部位的原发性T细胞淋巴瘤。在兽医领域,仅有一份报告描述了雌性生殖系统的原发性淋巴瘤。该报告介绍了一例子宫结外粘膜相关淋巴组织(MALT)型边缘区B细胞淋巴瘤病例[21]。子宫黏膜由MALT(一种特殊形式的外周淋巴组织)组成。边缘区B细胞淋巴瘤可起源于不同部位的MALT,包括眼眶、甲状腺、唾液腺、肺、肠和子宫[22]。
第二种情况是胃肠道(GI)淋巴瘤转移到生殖系统。一般来说,犬消化道淋巴瘤以非特异性消化道症状为特征,如吸收不良、体重减轻、腹泻和呕吐[23-25]。此外,犬消化道淋巴瘤可能是局部发生,但更常见的是累及多个节段,出现管腔狭窄、管壁增厚、粘膜溃疡等症状[23,26]。
根据最近的一项研究,T细胞来源的原发性消化道淋巴瘤比B细胞来源的原发性消化道淋巴瘤更常见[27]。本病例的黑便持续了三周,部分肠段肌肉层增厚,肠系膜脂肪呈高回声。然而,这些征象并非消化道淋巴瘤所特有,其他肠道疾病也可能出现这些征象。
尽管进行了重症监护,但在手术切除卵巢和子宫淋巴瘤后,该犬的病情还是逐渐恶化。由于主人拒绝进一步检查,病情恶化的具体原因尚不清楚。根据发病时的生命体征和血液检测结果,作者认为全身炎症反应综合征(SIRS)可能是导致术后病情进一步恶化的原因之一。
SIRS指的是继发于感染性或无菌性炎症疾病的广泛炎症临床症状[28]。在本病例中,子宫恶性肿瘤或恶性淋巴瘤本身都可能导致SIRS。SIRS在肿瘤的起始、促进和进展阶段均有作用[29]。此外,SIRS 还是人类各种女性生殖道恶性肿瘤存活率的重要指标[30-32]。
生殖道中的肿瘤细胞会分泌包括白细胞介素-6在内的多种细胞因子,从而招募炎症细胞[33,34]。多中心T细胞淋巴瘤患者血清中的白细胞介素-6水平明显高于B细胞淋巴瘤患者和健康犬[35]。白细胞介素-6是恶性T细胞淋巴细胞产生的一种多向性免疫调节细胞因子,可通过T细胞的扩增和活化、B细胞的分化以及肝细胞对急性期蛋白的诱导来促进炎症反应 [36]。因此,在这一过程中,许多促炎细胞因子与恶性淋巴细胞一起产生,当促炎细胞因子压倒抗炎细胞因子时,就会诱发全身炎症。
事实上,在卵巢癌和T细胞淋巴瘤患者中,治疗前中性粒细胞与淋巴细胞比率的升高具有预后意义[37,38]。因此,作者推测本病例病情恶化的原因可能是手术后SIRS的进一步发展,尽管在卵巢和子宫淋巴瘤手术切除前已经稳定了该犬的生命体征。然而,要明确生殖道淋巴瘤患犬治疗前SIRS的预后意义,还需要进一步的研究。
根据脓性阴道分泌物和子宫腔内的气体和液体积聚情况,也有可能是细菌性全身感染,表明可能同时存在子宫脓肿。子宫脓肿可能是由于子宫淋巴瘤导致局部先天性免疫系统受损所致。因此,尽管使用了广谱抗生素和静脉输液,但导致病情恶化的原因也可能是细菌性全身感染和毒血症。遗憾的是,作者没有对子宫腔内容物进行培养。因此无法说明本病例病情进一步恶化的原因是治疗前与淋巴瘤有关的SIRS,还是细菌性全身感染,抑或两者兼而有之。
胸腔和腹腔积液中的恶性淋巴细胞可能是本病例预后不良的另一个可能原因。细胞学检查显示,两处渗出液中都有大量淋巴母细胞,表明胸膜和腹膜中也有T细胞淋巴瘤浸润。浸润的淋巴瘤可能增加了胸膜和腹膜毛细血管的通透性,从而促进蛋白质进入胸腔和腹腔,导致两腔积液。因此,T细胞淋巴瘤的全身浸润可能导致该犬术后生命体征恶化。
由于肿瘤具有侵袭性,胸腔积液的存在可能会缩短患有高级别纵隔淋巴瘤的犬的存活时间[18]。然而,胸膜和腹膜活检是确认这种情况的必要条件,因为恶性淋巴细胞与渗出液中的反应性淋巴细胞很难区分[39],尽管在本病例中,两种渗出液中的淋巴细胞都具有恶性特征。
总之,该病例被诊断为累及卵巢和子宫的T细胞淋巴瘤,这在如此年轻的犬身上是非常罕见的。即使在符合SIRS并确定有阴道分泌物的情况下,如果不是典型的犬脓子宫,也应将淋巴瘤作为鉴别诊断。
参考文献
[1] Ponce F, Marchal T, Magnol JP, et al. A morphological study of 608 cases of canine malignant lymphoma in France with a focus on comparative similarities between canine and human lymphoma morphology. Vet Pathol. 2010;47:414–433.
[2] Vezzali E, Parodi AL, Marcato PS, Bettini G. Histopathologic classification of 171 cases of canine and feline non-Hodgkin lymphoma according to the WHO. Vet Comp Oncol. 2010;8:38–49.
[3] Vail DM. Hematopoietic tumors. In: Ettinger SJ, Feldman EC, Côté E, editors. Textbook of veterinary internal medicine: diseases of the dog and cat. St. Louis: Elsevier; 2017. pp. 2065–2068.
[4] Dorn CR, Taylor DO, Hibbard HH. Epizootiologic characteristics of canine and feline leukemia and lymphoma. Am J Vet Res. 1967;28:993–1001.
[5] Brodey RS, Roszel JF. Neoplasms of the canine uterus, vagina, and vulva: a clinicopathologic survey of 90 cases. J Am Vet Med Assoc. 1967;151:1294–1307.
[6] Brodey RS. Canine and feline neoplasia. Adv Vet Sci Comp Med. 1970;14:309–354.
[7] Cotchin E. Canine ovarian neoplasms. Res Vet Sci. 1961;2:133–142.
[8] Hayes A, Harvey HJ. Treatment of metastatic granulosa cell tumor in a dog. J Am Vet Med Assoc. 1979;174:1304–1306.
[9] Sforna M, Brachelente C, Lepri E, et al. Canine ovarian tumours: a retrospective study of 49 cases. Vet Res Commun. 2003;27(Suppl 1):359–361.
[10] Thacher C, Bradley RL. Vulvar and vaginal tumors in the dog: a retrospective study. J Am Vet Med Assoc. 1983;183:690–692.
[11] Cotchin E. Spontaneous uterine cancer in animals. Br J Cancer. 1964;18:209–227.
[12] Herron MA. Tumors of the canine genital system. J Am Anim Hosp Assoc. 1983;19:981–994.
[13] McEntee K, Nielsen SW. Tumours of the female genital tract. Bull World Health Organ. 1976;53:217–226.
[14] Nielsen SW, Misdorp W, McEntee K. Tumours of the ovary. Bull World Health Organ. 1976;53:203–215.
[15] Patnaik AK, Greenlee PG. Canine ovarian neoplasms: a clinicopathologic study of 71 cases, including histology of 12 granulosa cell tumors. Vet Pathol. 1987;24:509–514.
[16] Vail DM, Pinkerton ME, Young KM. Canine lymphoma and lymphoid leukemias. In: Withrow SJ, Vail DM, Page RL, editors. Withrow and MacEwen’s small animal clinical oncology. St. Louis: Elsevier; 2013. pp. 608–619.
[17] Wenzlow N, Tivers MS, Selmic LE, et al. Haemangiosarcoma in the uterine remnant of a spayed female dog. J Small Anim Pract. 2009;50:488–491.
[18] Fournel-Fleury C, Magnol JP, Bricaire P, et al. Cytohistological and immunological classification of canine malignant lymphomas: comparison with human non-Hodgkin’s lymphomas. J Comp Pathol. 1997;117:35–39.
[19] Hauptman JG, Walshaw R, Olivier NB. Evaluation of the sensitivity and specificity of diagnostic criteria for sepsis in dogs. Vet Surg. 1997;26:393–397.
[20] Niskanen M, Thrusfield MV. Associations between age, parity, hormonal therapy and breed, and pyometra in Finnish dogs. Vet Rec. 1998;143:493–498.
[21] Ko JS, et al. Primary lymphoma of the uterine horn in a Lhasa Apso dog. Ir Vet J. 2013;66:24.
[22] Cave TA, Hine R, Howie F, et al. Uterine carcinoma in a 10-month-old golden retriever. J Small Anim Pract. 2002;43:133–135.
[23] Couto CG, Rutgers HC, Sherding RG, et al. Gastrointestinal lymphoma in 20 dogs: a retrospective study. J Vet Intern Med. 1989;3:73–78.
[24] Gieger T. Alimentary lymphoma in cats and dogs. Vet Clin North Am Small Anim Pract. 2011;41:419–432.
[25] Leib MS, Bradley RL. Alimentary lymphosarcoma in a dog. Compend Pract Vet Contin Educ. 1987;9:809–815.
[26] Ozaki K, Yamagami T, Nomura K, et al. T-cell lymphoma with eosinophilic infiltration involving the intestinal tract in 11 dogs. Vet Pathol. 2006;43:339–344.
[27] Coyle KA, Steinberg H. Characterization of lymphocytes in canine gastrointestinal lymphoma. Vet Pathol. 2004;41:141–146.
[28] Bone RC, Balk RA, Cerra FB, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. Chest. 1992;101:1644–1655.
[29] Grivennikov SI, Greten FR, Karin M. Immunity, inflammation, and cancer. Cell. 2010;140:883–899.
[30] Hefler LA, Concin N, Hofstetter G, et al. Serum C-reactive protein as independent prognostic variable in patients with ovarian cancer. Clin Cancer Res. 2008;14:710–714.
[31] Cho H, Hur HW, Kim SW, et al. Pre-treatment neutrophil to lymphocyte ratio is elevated in epithelial ovarian cancer and predicts survival after treatment. Cancer Immunol Immunother. 2009;58:15–23.
[32] Holub K, Busato F, Gouy S, et al. Analysis of systemic inflammatory factors and survival outcomes in endometrial cancer patients staged I-III FIGO and treated with postoperative external radiotherapy. J Clin Med. 2020;9:1441.
[33] Coussens LM, Werb Z. Inflammation and cancer. Nature. 2002;420:860–867.
[34] Mleko M, Pitynski K, Pluta E, et al. Role of systemic inflammatory reaction in female genital organ malignancies – state of the art. Cancer Manag Res. 2021;13:5491–5508.
[35] Calvalido J, Wood GA, Mutsaers AJ, et al. Comparison of serum cytokine levels between dogs with multicentric lymphoma and healthy dogs. Vet Immunol Immunopathol. 2016;182:106–114.
[36] Fabre-Guillevin E, Tabrizi R, Coulon V, et al. Aggressive non-Hodgkin’s lymphoma: concomitant evaluation of interleukin-2, soluble interleukin-2 receptor, interleukin-4, interleukin-6, interleukin-10 and correlation with outcome. Leuk Lymphoma. 2006;47:603–611.
[37] Zhou Q, Hong L, Zuo MZ, He Z. Prognostic significance of neutrophil to lymphocyte ratio in ovarian cancer: evidence from 4,910 patients. Oncotarget. 2017;8:68938–68949.
[38] Liu J, Zhang S, Mi R, Chen L, Yin Q. Prognostic significance of the neutrophil-to-lymphocyte ratio in peripheral T-cell lymphoma: a meta-analysis. Cancer Cell Int. 2021;21:688.
[39] Martin SE, Zhang HZ, Magyarosy E, et al. Immunologic methods in cytology: definitive diagnosis of non-Hodgkin’s lymphomas using immunologic markers for T- and B-cells. Am J Clin Pathol. 1984;82:666–673.