
| 一般情况 | |
|---|---|
 | 品种:法国斗牛犬 |
| 年龄:9个月 | |
| 性别:雌 | |
| 是否绝育:未知 | |
| 诊断:播散性隐球菌病 | |
01 主诉及病史
腹泻48小时,发病当晚出现呼吸困难。
02 检查
胸片显示为弥漫性结节性肺间质病变,初步诊断为非心源性肺水肿或吸入性肺炎。患者出现呼吸困难,低氧血症,呼吸用力增加,听诊双侧呼吸音增高。鼻腔未见分泌物。
神经系统方面,颅神经无障碍,本体感觉和步态正常。眼部未发现异常。根据口腔黏膜黏液,患者脱水率为5%。判断可能存在呕吐物吸入。血液检查无明显异常。
03 治疗
将该犬置于富氧环境(20 L/min)中,使用乳酸林格氏液(65 mL/h)静脉注射、氨苄西林(22 mg/kg,q8)静脉注射、丁吗啡醇(0.2 mg/kg)皮下注射。
04 预后
第二天,呼吸状况无改善,并继续腹泻。
粪便涂片显示梭状芽孢杆菌过度生长,因此开始使用甲硝唑(10 mg/kg,静注,q12h)。胸部X光片显示,所有肺叶均有严重的弥漫性支气管和肺间质病变,肺实质内散布着小的结节性不透明灶(下图)。
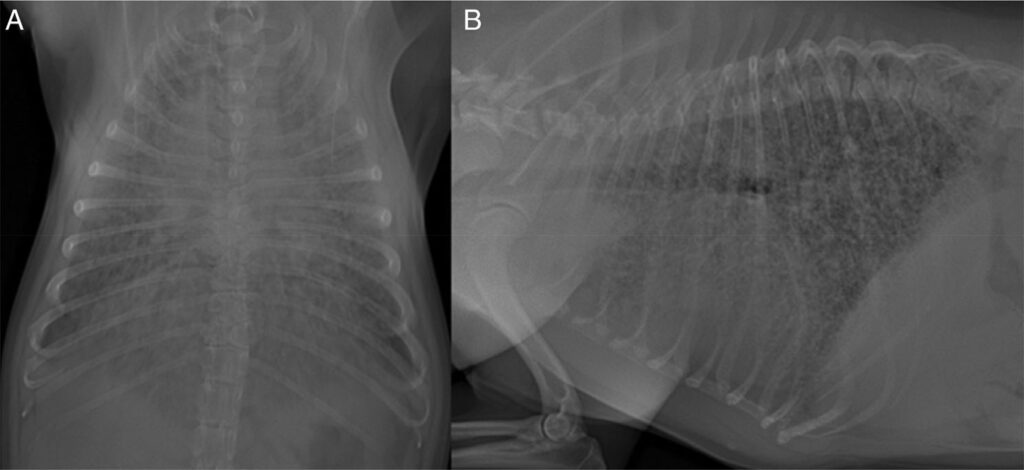
第二天深夜,患者出现呼吸困难,血氧持续过低,进行机械通气。通气时采用压力控制,PEEP为5 cmH2O,PIP为17 cmH2O,100%吸氧,呼吸频率为28。
随后进行了支气管肺泡灌洗。细胞学检查发现灌洗液中存在大的圆形嗜碱性染色生物体带有透明囊,周围有少量红细胞和偶见的中性粒细胞(下图)。进行真菌培养。
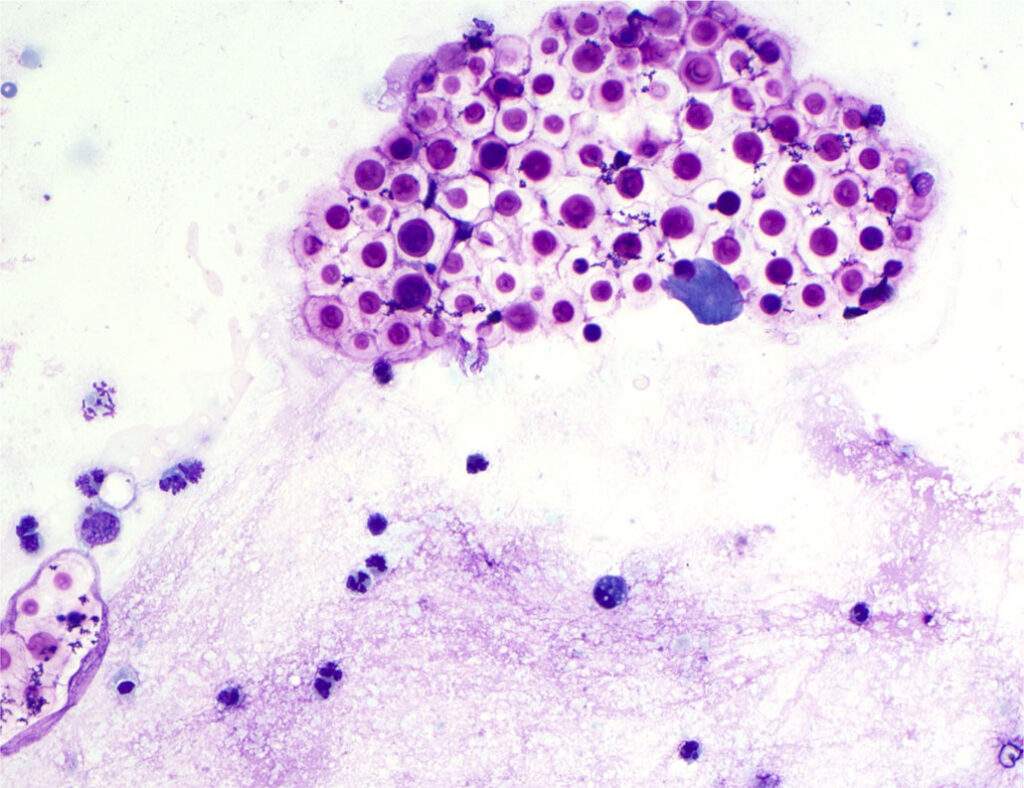
在真菌培养结果确认之前,由于抗真菌药物的风险和疗效方面的专业知识有限,因此没有进行抗真菌治疗。
机械通气18小时后,尽管PEEP增加到 6 cmH2O,PIP增加到18 cm H2O,但患者的临床症状仍在恶化。主人选择实施安乐死。
05 尸检
患者患有弥漫性、慢性、严重的肉芽肿性间质性肺炎,肠系膜淋巴结和右腰主动脉淋巴结伴有慢性、严重的肉芽肿性淋巴结炎(下图)。空肠中段也有局灶性慢性重度肉芽肿性肠炎。
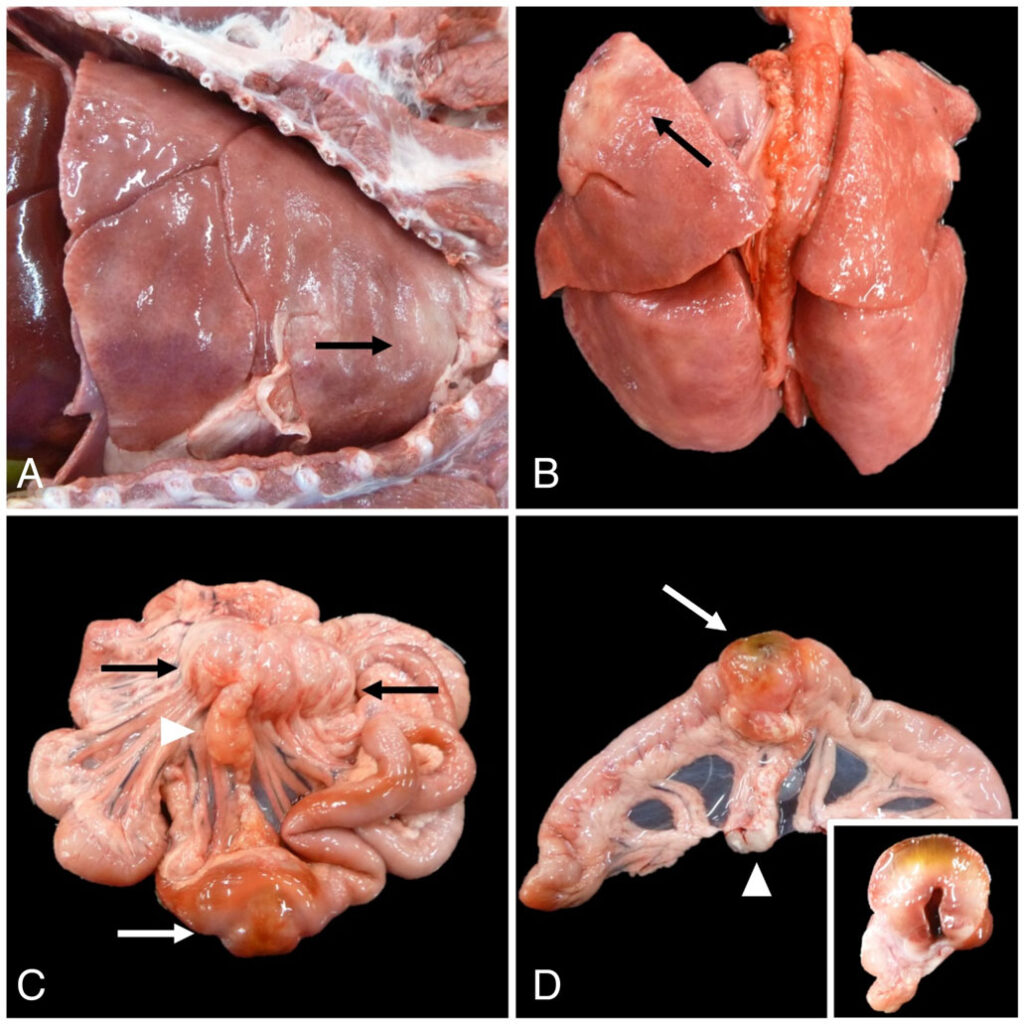
从组织学角度看,患者患有弥漫性、慢性、严重的组织细胞肺炎和胸膜炎,胸膜内有与隐球菌一致的真菌(下图)。
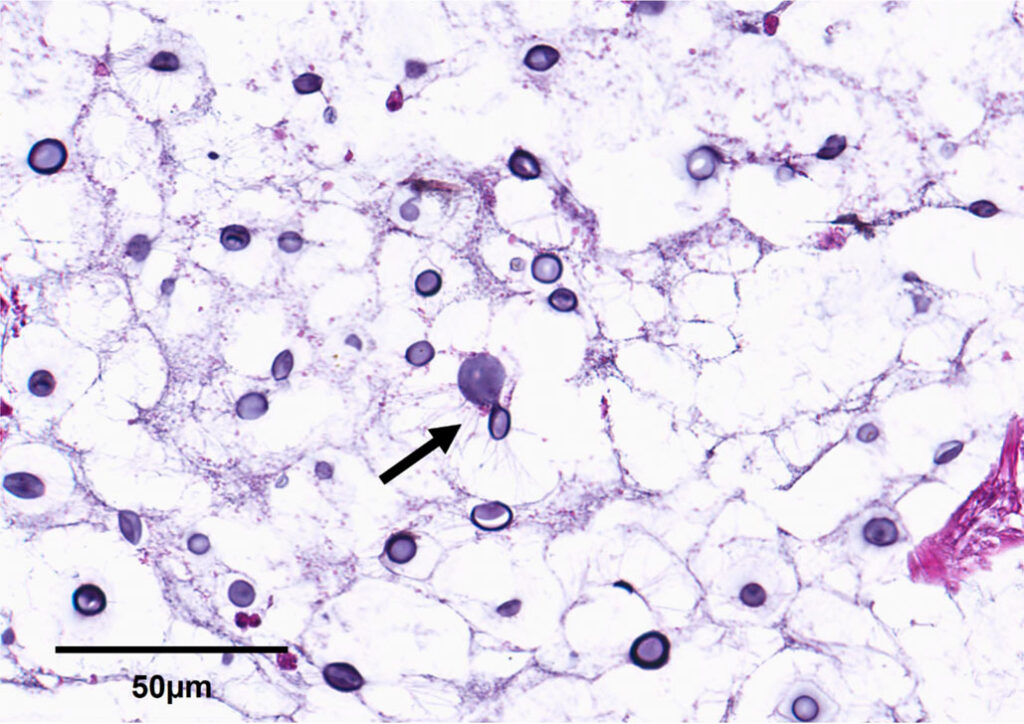
此外,患者还有区域性、广泛的慢性组织细胞性肠系膜淋巴结炎和跨膜、慢性、严重的组织细胞性肠炎,肠内真菌与隐球菌一致(下图)。
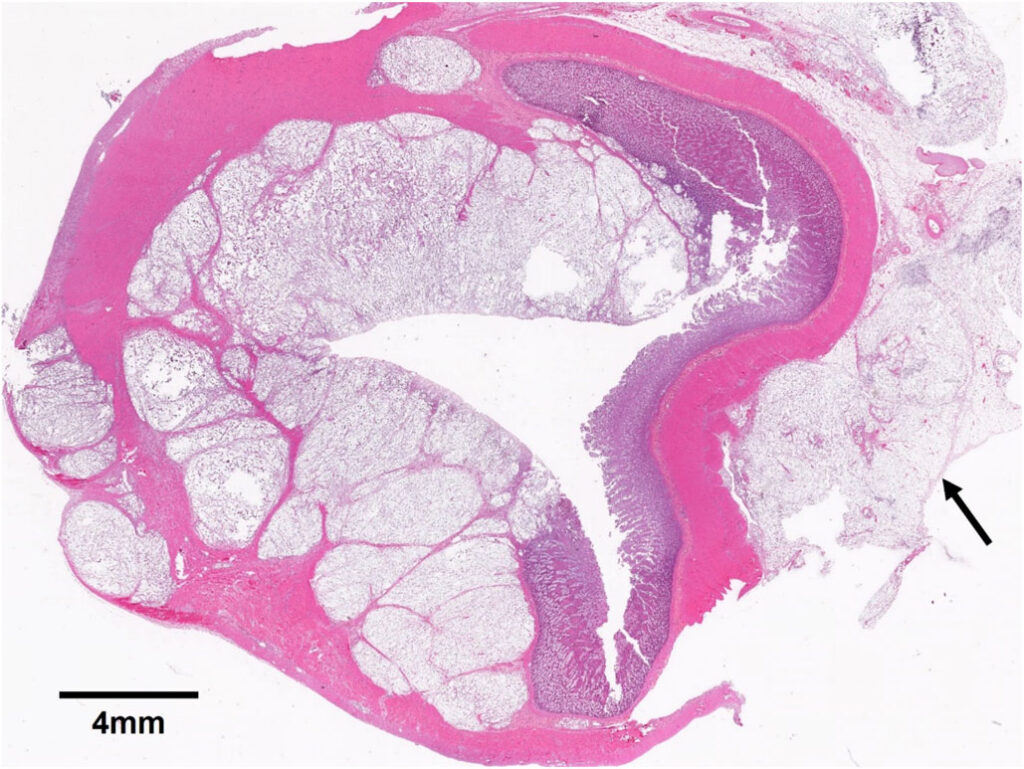
脑切片或眼部未发现组织病理学病变,也没有上呼吸道受累证据,因此没有进行组织病理学检查。最终临床诊断为播散性隐球菌病。
支气管肺泡灌洗液培养证实为加特隐球菌(C. gattii)是主要致病菌。对C. gattii进行了分子分型,确定为VGII。鉴于尸检结果和呼吸困难发生前的胃肠道症状,怀疑该病原体通过侵入肠道进行原发性感染,然后通过淋巴管扩散到肠系膜下淋巴结,最终通过淋巴/血行播散到肺部。
06 讨论
隐球菌病(Cryptococcosis)是澳大利亚最常见的全身性真菌疾病,影响的宿主多种多样,包括猫、人、狗、雪貂、马、海豚、兔子、牛、山羊、大鼠、豚鼠、猕猴、猿、猎豹、鲸类、袋鼠和考拉[1-11]。
犬隐球菌病多发生在德国牧羊犬、大丹犬、杜宾犬、拳师犬和边境牧羊犬等年轻的大型犬身上,这是因为大型犬通常生活在户外,更容易接触受污染的环境[12,13]。临床症状很可能是由吸入的孢子引起的,其致病性的主要毒力因素是它的大粘多糖囊、产生黑色素、尿素酶、磷脂酶以及在哺乳动物体温下存活和繁殖的能力[14-17]。
鼻窦腔和上呼吸道最常被认为是隐球菌病感染的入口。该病原体通常通过产生泰坦细胞、形成较厚的外囊以及利用多糖囊的成分将其病原体相关分子模式(葡萄糖醛酸氧甘露聚糖)从巨噬细胞的模式识别受体(Toll样受体4)中隐藏起来,从而躲避宿主的先天性和适应性免疫反应,避免蛋白溶解和补体介导的吞噬作用[18-20]。
有时,隐球菌会在鼻窦和鼻腔粘液中定植,并寄居在肺泡巨噬细胞内[21-23]。通常需要 CD4+T细胞介导的免疫反应才能杀灭部分真菌[24]。
吸入孢子后,隐球菌会从上呼吸道直接扩散到包括楔形骨板在内的邻近结构;另外,隐球菌还会通过血液传播,导致对其他器官如中枢神经系统、淋巴结、乳腺和皮肤的播散性影响[10,22]。犬的中枢神经系统和/或眼部经常受累(约60%的病例发现神经系统受累),但胃肠道、胰腺和肝脏也可能受累[2,10]。
隐球菌的感染途径也可能是肠道,胃肠道症状通常是临床医生接诊的原因。在一些已发表的伴侣动物报告中也观察到肺部病变[1,8,9,13,25]。在有胃肠道病变记录的情况下,疾病主要是由加特隐球菌(C. gattii)感染引起的,这种隐球菌被怀疑是通过消化道摄入而非吸入侵入人体的[8,9,13]。
在澳大利亚,致病生物型的分布存在差异。一项研究发现,在东海岸的郊区,只有13%的犬感染了C. gattii,其余87%的病例由新生隐球菌(C. neoformans)引起[13]。相反,在西澳大利亚州西南部,发现感染C. gattii和C. neoformans的病例数量相似[1]。
C.gattii的分子分型显示,VGII型通常局限于西澳大利亚州和北领地,而VGI型则被认为是东海岸的主要类型[26-28]。在发生3起与隐球菌相关的考拉死亡事件后,对昆士兰圈养考拉群体进行的亚临床疾病调查发现了VGII型,最终发现来自西澳大利亚野生动物园的考拉是传播源[4]。
C. gattii VGII型的胃肠道受累并继发肺部播散的诊断只在马身上出现过,在狗身上还没有报道[6]。既往研究表明,胃肠道是隐球菌感染的主要部位[9,25,30]。如果是肺部感染后血液传播导致肠系膜淋巴结和空肠感染,那么原发感染部位通常会受到更严重的影响,而不是几乎整个肺实质都受到弥漫性播散,这更符合从肠道到整个肺毛细血管床的感染性栓子的播散。本病例的病史和病程也表明,原发性肠道入口感染比原发性呼吸道感染更有可能。
在没有神经系统受累的情况下从肠道传播到肺部的病例以前在狗中还没有报道过。虽然以前也曾出现过怀疑原发性肠道感染的病例,但通常只有在并发中枢神经系统疾病时才会出现肺部病变[1,10-12]。该患者在发病前没有神经系统或呼吸道症状,仅存在腹泻,这表明该病源于原发性胃肠道感染。最近的证据表明,肠系膜淋巴管是肠-肺轴发生急性呼吸窘迫综合征的通道[31,32]。由于区域性肠系膜淋巴结炎,尸检结果高度提示原发性胃肠道受累,继发性淋巴/血行播散从肠系膜淋巴结扩散到肺部。
本病例表明,只要有适当的环境和生活方式因素,C. gattii就有可能感染任何品种的狗。一直以来,隐球菌病都与大型犬的呼吸系统和神经系统症状有关,但该患者在整个临床病程中神经系统都很正常,尸检时也未发现中枢神经系统受累。也许这就需要将隐球菌病作为呼吸道和胃肠道疾病患者的鉴别病症,尤其是在没有诱发因素(如呕吐导致吸入性肺炎)来解释临床症状时。但是,如果胸片上出现粟粒状结节,则应考虑转移性肿瘤或真菌感染。
本病例强调,无论患者有无神经系统体征,即使不符合典型的品种偏好,也应考虑真菌感染。更早地怀疑真菌感染可能会使治疗更及时、更恰当,从而改善患者的预后。
参考文献
[1] McGill S, Malik R, Saul N et al. Cryptococcosis in domestic animals in Western Australia: a retrospective study from 1995-2006. Med Mycol 2009;47:625–639.
[2] Vorathavorn VI, Sykes JE, Feldman DG. Cryptococcosis as an emerging systemic mycosis in dogs. J Vet Emerg Crit Care 2013;23:489–497.
[3] Schmertmann LJ, Wardman A, Setyo L et al. Identification of the environmental source of infection for a domestic ferret with cryptococcosis. J Vet Diagn Invest 2019;31:828–835.
[4] Schmertmann LJ, Danesi P, Monroy-Nieto J et al. Jet-setting koalas spread Cryptococcus gattii VGII in Australia. Clin Sci Epidemiol 2019;4:1–14.
[5] Miller WG, Padhye AA, Van Bonn W et al. Cryptococcosis in a bottlenose dolphin (Tursiops truncatus) caused by Cryptococcus neoformans var. gattii. J Clin Microbiol 2002;40:721–724.
[6] Riley CB, Bolton JR, Mills JN et al. Cryptococcosis in seven horses. Aust Vet J 1992;69:135–139.
[7] Malik R, Dill-Macky E, Martin P. Cryptococcosis in dogs: a retrospective study of 20 consecutive cases. Med Mycol 1995;33:291–297.
[8] Malik R, Hunt GB, Bellenger CR et al. Love DN intra-abdominal cryptococcosis in two dogs. J Small Anim Pract 1999;40:387–391.
[9] Johnston L, Mackay B, King T et al. Abdominal cryptococcosis in dogs and cats: 38 cases (2000-2018). J Small Anim Pract 2021;62:19–27.
[10] Trivedi SR, Sykes JE, Cannon MS et al. Clinical features and epidemiology of cryptococcosis in cats and dogs in California: 93 cases (1988-2010). J Am Vet Med Assoc 2011;239:357–369.
[11] Duncan C, Stephen C, Campbell J. Clinical characteristics and predictors of mortality for Cryptococcus gattii infection in dogs and cats of southwestern British Columbia. Can Vet J 2006;47:993–998.
[12] Malik R, Dill-Macky E, Martin P et al. Cryptococcosis in dogs: a retrospective study of 20 consecutive cases. J Med Vet Mycol 1995;33:291–297.
[13] O’Brien CR, Krockenberger MB, Wigney DI et al. Retrospective study of feline and canine cryptococcosis in Australia from 1981 to 2001: 195 cases. Med Mycol 2004;42:449–460.
[14] Fu MS, Coelho C, De Leon-Rodriguez CM et al. Cryptococcus neoformans urease affects the outcome of intracellular pathogenesis by modulating phagolysosomal pH. PLoS Pathog 2018;14:1–31.
[15] Hamed MF, de Araújo GRS, Munzen ME et al. Phospholipase B is critical for Cryptococcus neoformans survival in the central nervous system. Am Soc Microbiol 2023;14(2):1–22.
[16] Olszewski MA, Noverr MC, Chen G-H et al. Urease expression by Cryptococcus neoformans promotes microvascular sequestration, thereby enhancing central nervous system invasion. Am J Pathol 2004;164(5):1761–1771.
[17] Casadevall A, Coelho C, Alanio A. Mechanisms of Cryptococcus neoformans mediated host damage. Front Immunol 2018;9:1–8.
[18] Zaragoza O, Taborda CP, Casadevall A. The efficacy of complement mediated phagocytosis of Cryptococcus neoformans is dependent on the location of C3 in the polysaccharide capsule and involves both direct and indirect C3-mediated interactions. Eur J Immunol 2003;33:1957–1967.
[19] Johnston SA, May RC. Cryptococcus interactions with macrophages: evasion and manipulation of the phagosome by a fungal pathogen. Cell Microbio 2013;15:403–411.
[20] Yang C, Huang Y, Zhou Y et al. Cryptococcus escapes host immunity: what do we know? Front Cell Infect Microbiol 2022;12:1–13.
[21] Del Poeta M. Role of phagocytosis in the virulence of Cryptococcus neoformans. Eukaryot Cell 2004;3:1067–1075.
[22] Sykes JE, Malik R. Chapter 62: Cryptococcosis. In: Greene, infectious diseases of the dog and cat. Elsevier Inc., St. Louis, MO, 2013:599–612.
[23] Voelz K, May RC. Cryptococcal interactions with the host immune system. Eukaryot Cell 2010;9:835–846.
[24] Elsegeiny W, Marr KA, Williamson PR. Immunology of cryptococcal infections: developing a rational approach to patient therapy. Front Immunol 2018;9:1–9.
[25] Graves TK, Barger AM, Adams B et al. Diagnosis of systemic cryptococcosis by fecal cytology in a dog. Vet Clin Pathol 2005;34:409–412.
[26] Campbell LT, Fraser JA, Nichols CB et al. Clinical and environmental isolates of Cryptococcus gattii from Australia that retain sexual fecundity. Eukaryot Cell 2005;4:1410–1419.
[27] Chenl SCA, Currie BJ, Campbell HM et al. Cryptococcus neoformans var. gattii infection in northern Australia: existence of an environmental source other than known host eucalypts. Trans R Soc Trop Med Hyg 1997;91:547–550.
[28] Carriconde F, Gilgado F, Arthur I et al. Clonality and a-a recombination in the Australian Cryptococcus gattii VGII population-an emerging outbreak in Australia. PloS One 2011;6:1–12.
[29] Klein KR, Hall L, Deml SM et al. Identification of Cryptococcus gattii by use of L-canavanine glycine bromothymol blue medium and DNA sequencing. J Clin Microbiol 2009;47:3669–3672.
[30] Tangeman L, Davignon D, Patel R et al. Abdominal cryptococcosis in two dogs: diagnosis and medical management. J Am Anim Hosp Assoc 2015;51:107–113.
[31] Ma Y, Yang X, Chatterjee V et al. The gut–lung axis in systemic inflammation role of mesenteric lymph as a conduit. Am J Respir Cell Mol Biol 2021;64:19–28.
[32] Deitch EA. Causes and consequences of lymphatic disease. Ann N Y Acad Sci 2010;1207:103–111.