
| 一般情况 | |
|---|---|
 | 品种:德国短毛猎犬 |
| 年龄:1岁 | |
| 性别:雄 | |
| 是否绝育:未知 | |
| 诊断:原发性淋巴水肿 | |
01 主诉及病史
持续3个月口鼻部单侧无痛性肿胀(下图)。肿胀发生在几天到几周内,而且该部位之前没有受过伤。该犬的其他亲属没有出现类似的临床症状。患者在病变发生前或发生时未服用过任何药物或接种疫苗,但在就诊的两周前曾口服过氟拉菌素。

02 检查
体格检查发现,该犬的右口唇和脸颊大面积出现中度点状水肿。口腔和耳道检查未发现异常。血液检查除了轻度嗜酸性粒细胞增多外,其他结果无异常。对肿物进行细针穿刺后发现只有几滴透明液体,用改良赖特-吉氏染色法染色的细胞学切片上只有几个红细胞,没有其他细胞或微生物。
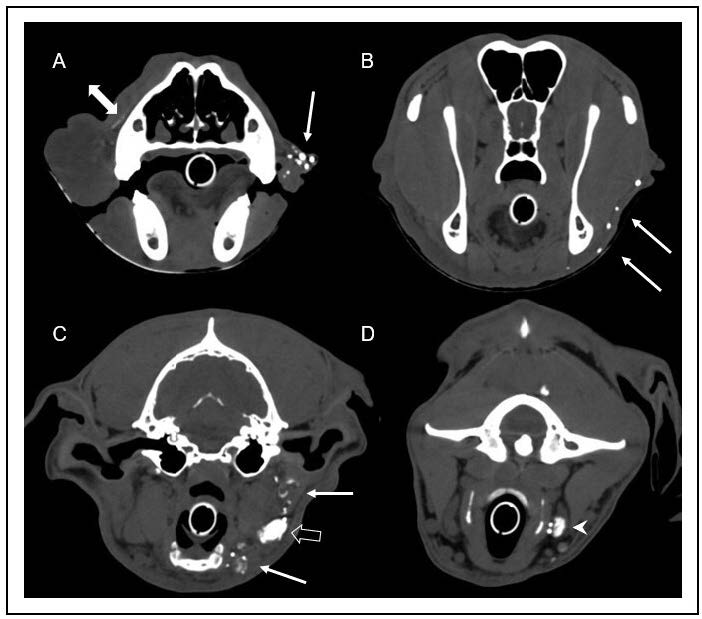
头颈部和胸部CT显示,右上唇和脸颊有明显的弥漫性皮下肿胀,延伸至喉部,在喉部发现了皮下脂肪束。右下颌淋巴结较小(长径3.5 mm),左下颌淋巴结也较小(长径10 mm)。其他所有淋巴结的大小均符合患者的年龄和对称性。
从病变的皮肤和粘膜上取了3个8 mm长的穿刺活检组织,并从肿胀组织的深部以无菌方式采集了组织进行细菌和真菌培养。组织病理学显示,真皮/粘膜和皮下/粘膜发生了弥漫性变化,部分延伸到横纹肌周围(下图)。
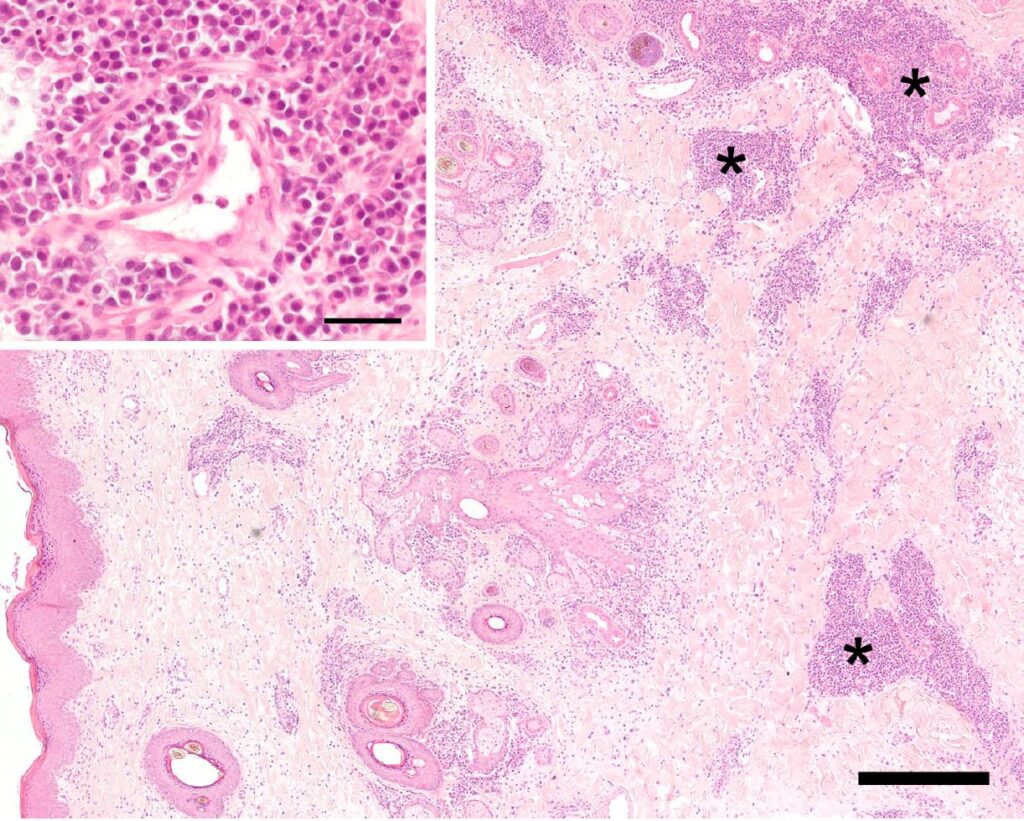
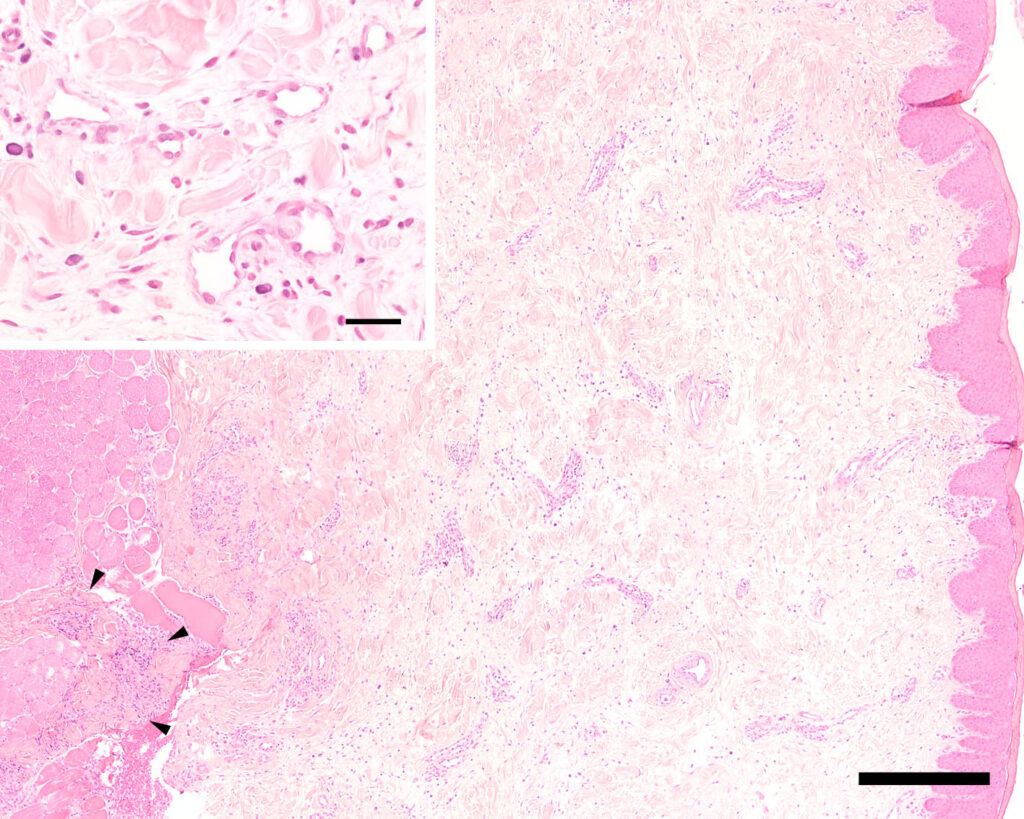
这些变化包括中度弥漫性水肿、轻度弥漫性纤维增生和不同程度的炎症浸润。这些炎症浸润主要出现在血管周围和附件周围。在一个皮肤样本中,这些炎症浸润多发于真皮深层和皮下。它们主要由浆细胞、中等数量的嗜酸性粒细胞和肥大细胞组成,但只有较少的中性粒细胞、淋巴细胞和罕见的组织细胞。
从组织学角度看,几乎无法辨别淋巴管和静脉血管。淋巴管的数量似乎正常,但由于没有对侧等对照组织,因此无法进行客观评估。血管和淋巴管的内皮丰满、活跃,血管适度扩张。深层组织的水肿非常轻微,而真皮层的水肿更为明显。有毛发的皮肤表皮局部中度增生,出现少量含有中性粒细胞和嗜酸性粒细胞的小脓疱。
细菌及真菌培养均为阴性。超声检查未发现任何血管内血栓。对全血样本进行的微丝蚴生物实时PCR检测呈阴性。
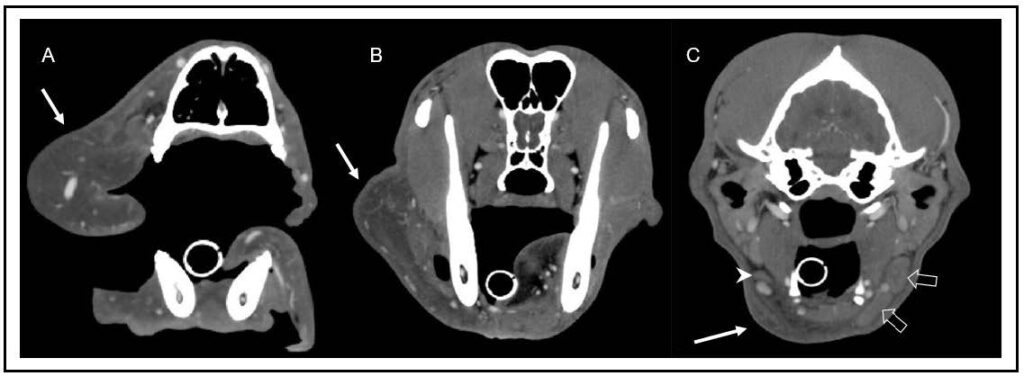
在全麻下使用碘化造影剂进行间接CT淋巴造影。将10 mL造影剂皮下注射到两侧嘴唇, 30分钟后进行扫描。注射后,左侧立即看到多条淋巴管,引流至同侧下颌骨和咽后内侧淋巴结。右侧可见少量造影剂,从注射部位沿面部平面向尾部延伸。右侧均未发现淋巴管或淋巴结强化(下图)。
03 治疗
在等待化验结果期间,患者开始口服多西环素(5 mg/kg,每天两次),但一周内病情未见好转。组织病理报告显示真皮深层和皮下有严重炎症,于是开始口服泼尼松龙(1 mg/kg,每天两次)。
04 预后
治疗一周后,肿胀部分消退了约60%。停用泼尼松龙后,进行淋巴引流按摩治疗。初次就诊一年多后,狗主人报告说该犬的生活质量很好,淋巴引流按摩仍在继续,但没有用药,嘴唇目前显示轻度到中度水肿(下图)。

05 讨论
淋巴水肿(Lymphedema)是指毛细血管的滤过功能超过静脉和淋巴系统对液体和蛋白质的重吸收功能,从而导致淋巴充血和水肿的一种病症[1,2,3]。原发性淋巴水肿发生在淋巴系统先天异常或功能障碍的患者身上[2]。
很少有文献描述狗、猫、牛和猪的原发性淋巴水肿,大多数文献使用临床、尸体解剖或影像学检查结果(无论是否使用造影剂)来明确诊断[1,4,5,6,7,8,9,10,11,12,13,14]。患原发性淋巴水肿的狗在出生后几天到几个月内开始发病,最常见的临床表现是后肢单侧或双侧的点状水肿[1,6]。
身体的其他部位也可能受到影响,但只有在肢体远端淋巴水肿时才会出现这种情况[1,5,6,8]。许多患有原发性淋巴水肿的狗都被怀疑患有再生性淋巴结炎,而最近的一项研究则使用CT来显示多个淋巴结构的再生[1,5]。其中一些研究描述了淋巴水肿性皮肤的组织病理学变化,但没有报告对组织学结果进行过深入讨论。
以前曾有过对患有原发性淋巴水肿的狗进行保守治疗和手术治疗的报道[4,5,15,16],但预后一般较差,部分原因是会并发继发性感染。本病例报告描述了第一例单侧面部淋巴水肿的病例,该病例通过间接CT淋巴造影和皮肤组织病理学检查初步诊断为原发性淋巴水肿。
淋巴水肿在人和犬中的分布与点状水肿基本相同,分别最常发生在腿远端和后肢[1,2,6]。犬的双后肢通常都会受累,但也有单侧受累的病例[1]。在严重的病例中,四肢、头部、腹腔和尾部均有受累的报道[1,5]。然而,四肢以外的其他部位只有在远端肢体淋巴水肿时才会受累,而且从未单独出现过。本病例表现为口唇和面部的局部淋巴水肿,而没有影响到身体的其他部位。由于这种不寻常的表现,作者最初怀疑是继发性淋巴水肿,并试图排除其潜在的原发病因,如肿瘤、血栓,丝虫病等。
继发性淋巴水肿是人类的一种常见病,在发达国家,大多数病例是由于恶性肿瘤或其治疗引起的[2]。该犬嘴唇的组织病理切片显示没有自主生长的迹象。此外,临床症状在初次发病一年多后部分缓解。这些发现提示肿瘤不是导致该犬淋巴水肿的主要原因。此外,患处也没有进行过外科手术。
在全球范围内,丝虫病是导致人类继发性淋巴水肿的最常见原因,2018年有超过5100万人受到丝虫病的影响[2,21]。人类淋巴丝虫病中最常见的线虫是班克罗非虫(Wuchereria bancrofti)、马来丝虫(Brugia malayi)和蒂莫里丝虫(Brugia timori)[22]。淋巴丝虫病是一种热带疾病,主要流行于美洲、东南亚和非洲[21]。
慢性静脉功能不全(CVI)是一种人类下肢疾病[26]。它可导致淋巴水肿,也可导致溃疡和血栓形成[25,26]。确切的病因尚不清楚,但怀疑与遗传易感性和生活方式(如长时间站立、肥胖、怀孕和饮食)等因素有关[26]。淋巴管在CVI患者皮肤的组织病理学切片中显示出结构性变化,包括管腔塌陷、开放的细胞间连接消失和锚定丝失调[27]。上述变化均不适用于该犬,因此,该犬的淋巴水肿也不是类似病因引起的。
在人类和兽医领域,原发性淋巴水肿都是一种慢性衰弱病症,与皮肤反复感染有关[1,2,5,34]。与这些经验不同的是,该犬病程较轻,在口服泼尼松龙短期疗程后病情有所好转,在初次发病后的一年多时间里病情一直处于缓解状态,主人只是偶尔用淋巴引流按摩作为唯一的治疗方法。
综上,本病例报告描述了一只年轻德国短毛猎犬的原发性单侧面部淋巴水肿的病例。本病例证明了在局部淋巴水肿病例中使用间接CT淋巴造影术的价值,它可以确定淋巴管有没有增强,以及区域淋巴结有没有引流,从而明确原发性淋巴水肿的诊断。
参考文献
[1] Fossum T.W., Miller M.W. Lymphedema: Etiopathogenesis. J. Vet. Intern. Med. 1992;6:283–293.
[2] Warren A.G., Brorson H., Borud L.J., Slavin S.A. Lymphedema: A Comprehensive Review. Ann. Plast. Surg. 2007;59:464–472.
[3] Junaid J. Textbook of Veterinary Internal Medicine, 8th Edition. Can. Vet. J. 2018;59:769.
[4] Fossum T.W., King L.A., Miller M.W., Butler L.M. Lymphedema: Clinical Signs, Diagnosis, and Treatment. J. Vet. Intern. Med. 1992;6:312–319.
[5] Bray C.W., Berryessa N.A., Frederick S.W., Savage M.Y. Diagnosis and Conservative Management of Primary Lymphedema Resulting from Multiple Aplastic Lymphocenters in a Dog. Top. Companion Anim. Med. 2022;49:100651.
[6] Patterson D.F., Medway W., Luginbühl H., Chacko S. Congenital Hereditary Lymphoedema in the Dog. Part I—Clinical and Genetic Studies. J. Med. Genet. 1967;4:145–152.
[7] Luginbühl H., Chacko S.K., Patterson D.F., Medway W. Congenital Hereditary Lymphoedema in the Dog Part II—Pathological Studies. J. Med. Genet. 1967;4:153–165.
[8] Schuller S., Le Garrérès A., Remy I., Peeters D. Idiopathic Chylothorax and Lymphedema in 2 Whippet Littermates. Can. Vet. J. 2011;52:1243–1245.
[9] Jacobsen J.O., Eggers C. Primary Lymphoedema in a Kitten. J. Small Anim. Pract. 1997;38:18–20.
[10] Mulei C.M., Atwell R.B. Congenital Lymphoedema in an Ayrshire-Friesian Crossbred Female Calf. Aust. Vet. J. 1989;66:227–228.
[11] Norton J., Sibson G., Sturgess S. Congenital Lymphoedema in a Brahman Calf. Aust. Vet. J. 1993;70:267.
[12] Schild A.L., Riet-Correa F., Méndez M.C. Hereditary Lymphedema in Hereford Cattle. J. Vet. Diagn. Investig. 1991;3:47–51.
[13] Yamaguchi R., Amos M.J., Hagio M., Tateyama S. Congenital Lymphedema in a Calf with Lymph Node Dysplasia or Aplasia. J. Vet. Med. Sci. 1995;57:797–799.
[14] Van der Putte S.C. Congenital Hereditary Lymphedema in the Pig. Lymphology. 1978;11:1–9.
[15] Hashikawa K., Kamei Y. The Dawn of a New Era in Surgery for Lymphedema. Nagoya J. Med. Sci. 2023;85:7–9.
[16] Yamada Y. The Studies on Lymphatic Venous Anastomosis in Lymphedema. Nagoya J. Med. Sci. 1969;32:1–21.
[17] Cederberg A., Grønning L.M., Ahrén B., Taskén K., Carlsson P., Enerbäck S. FOXC2 Is a Winged Helix Gene That Counteracts Obesity, Hypertriglyceridemia, and Diet-Induced Insulin Resistance. Cell. 2001;106:563–573.
[18] Karkkainen M.J., Ferrell R.E., Lawrence E.C., Kimak M.A., Levinson K.L., McTigue M.A., Alitalo K., Finegold D.N. Missense Mutations Interfere with VEGFR-3 Signalling in Primary Lymphoedema. Nat. Genet. 2000;25:153–159.
[19] Irrthum A., Karkkainen M.J., Devriendt K., Alitalo K., Vikkula M. Congenital Hereditary Lymphedema Caused by a Mutation That Inactivates VEGFR3 Tyrosine Kinase. Am. J. Hum. Genet. 2000;67:295–301.
[20] Ghalamkarpour A., Morlot S., Raas-Rothschild A., Utkus A., Mulliken J.B., Boon L.M., Vikkula M. Hereditary Lymphedema Type I Associated with VEGFR3 Mutation: The First de Novo Case and Atypical Presentations. Clin. Genet. 2006;70:330–335.
[21] Cromwell E.A., Schmidt C.A., Kwong K.T., Pigott D.M., Mupfasoni D., Biswas G., Shirude S., Hill E., Donkers K.M., Abdoli A., et al. The Global Distribution of Lymphatic Filariasis, 2000–2018: A Geospatial Analysis. Lancet Glob. Health. 2020;8:e1186–e1194.
[22] Ottesen E.A., Duke B.O., Karam M., Behbehani K. Strategies and Tools for the Control/Elimination of Lymphatic Filariasis. Bull. World Health Organ. 1997;75:491.
[23] Capelli G., Genchi C., Baneth G., Bourdeau P., Brianti E., Cardoso L., Danesi P., Fuehrer H.-P., Giannelli A., Ionică A.M., et al. Recent Advances on Dirofilaria Repens in Dogs and Humans in Europe. Parasites Vectors. 2018;11:663.
[24] Morchón R., Montoya-Alonso J.A., Rodríguez-Escolar I., Carretón E. What Has Happened to Heartworm Disease in Europe in the Last 10 Years? Pathogens. 2022;11:1042.
[25] Varghese S.A. Secondary Lymphedema: Pathogenesis. JSSTD. 2021;3:7–15.
[26] Fowkes F.G., Evans C.J., Lee A.J. Prevalence and Risk Factors of Chronic Venous Insufficiency. Angiology. 2001;52((Suppl. S1)):S5–S15.
[27] Scelsi R., Scelsi L., Cortinovis R., Poggi P. Morphological Changes of Dermal Blood and Lymphatic Vessels in Chronic Venous Insufficiency of the Leg. Int. Angiol. 1994;13:308–311.
[28] Minasian R.A., Samaha Y., Brazio P.S. Post-Traumatic Lymphedema: Review of the Literature and Surgical Treatment Options. Plast. Aesthetic Res. 2022;9:18.
[29] Hettrick H., Nof L., Ward S., Ecthernach J. Incidence and Prevalence of Lymphedema in Patients Following Burn Injury: A Five-Year Retrospective and Three-Month Prospective Study. Lymphat. Res. Biol. 2004;2:11–24.
[30] Li C.Y., Kataru R.P., Mehrara B.J. Histopathologic Features of Lymphedema: A Molecular Review. Int. J. Mol. Sci. 2020;21:2546.
[31] Domaszewska-Szostek A., Zaleska M., Olszewski W.L. Hyperkeratosis in Human Lower Limb Lymphedema: The Effect of Stagnant Tissue Fluid/Lymph. J. Eur. Acad. Derm. Venereol. 2016;30:1002–1008.
[32] Azhar S.H., Lim H.Y., Tan B.-K., Angeli V. The Unresolved Pathophysiology of Lymphedema. Front. Physiol. 2020;11:137.
[33] Darózy J. Pathology of Lymphedema. Clin. Dermatol. 1995;13:433–444.
[34] Barone V., Borghini A., Clemente E.T., Aglianò M., Gabriele G., Gennaro P., Weber E. New Insights into the Pathophysiology of Primary and Secondary Lymphedema: Histopathological Studies on Human Lymphatic Collecting Vessels. Lymphat. Res. Biol. 2020;18:502–509.