
| 一般情况 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:3岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:胞内分枝杆菌感染 | |
01 主诉及病史
因全身皮下肉芽肿病变、偶尔出现厌食、发热和腹泻就诊。该猫来自一个多猫家庭,过着室内室外两点一线的生活,与另一只猫和猫主人都有密切接触,但其他猫没有出现过类似的皮损。
该猫在8个月前开始出现皮损,最初出现在嘴唇和下巴,然后逐渐扩散到全身。8周前兽医检查了肿胀的左跗关节,并口服了强力霉素(5 mg/kg)。
02 检查
身体状况评分为4/9,脸部和爪子上有溃疡性结节(下图)。

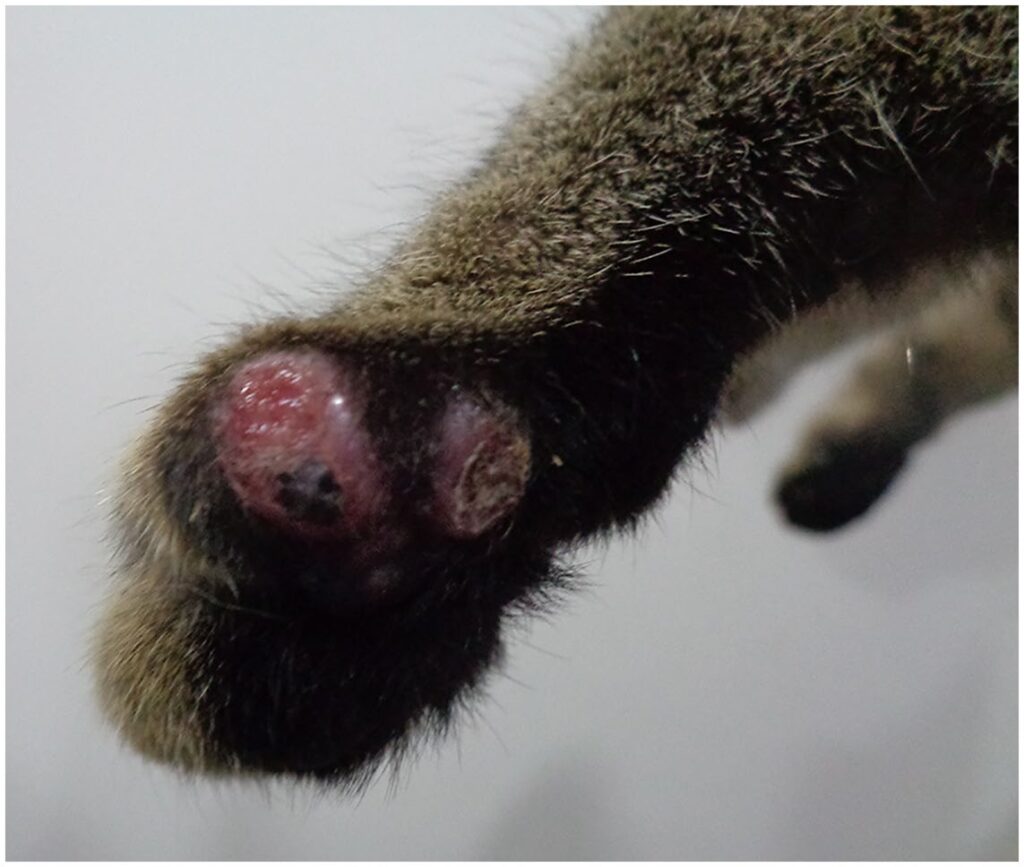
除了高球蛋白血症外,血清生化和全血细胞计数均无异常。猫白血病病毒抗原和猫免疫缺陷病毒抗体血清学检测呈阴性。对皮肤结节的细胞学检查发现细胞内和细胞外的多杆菌阴性染色棒状杆菌,高度提示为分枝杆菌。胸片未发现明显异常。
03 治疗
接受了三联抗生素口服治疗(阿奇霉素 5.5 mg/kg q24h、马波沙星 5.5 mg/kg q24h、利福平 10 mg/kg q24h)。
由于临床症状未见好转,4周后用普拉多沙星代替马波沙星,剂量为 8 mg/kg q24h口服。
第5周,细菌培养分离出胞内分枝杆菌。
第9周进行了药敏试验:阿米卡星、利奈唑胺、链霉素 [32 µg/ml];环丙沙星、米诺环素 [>8 µg/ml];福平、强力霉素、莫西沙星 [>4 µg/ml];克拉霉素 [2 µg/ml];利福布汀 [1 µg/ml];氯法齐明 [0. 06 µg/ml]和三甲双胍/磺胺甲噁唑 [4/76 µg/ml]。建议将氯法齐明作为首选药物。
在三联疗法期间,猫的病情恶化,体重下降到3.4 kg(下降了10%),推测是由于三联疗法的副作用引起的慢性腹泻(下图)。
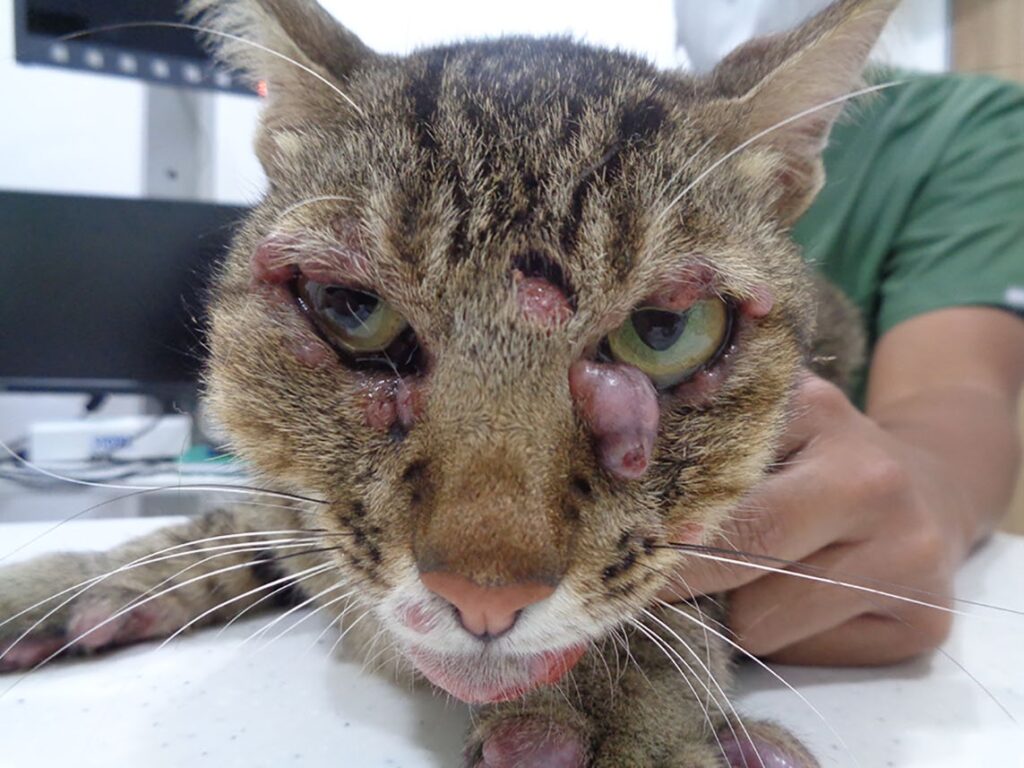
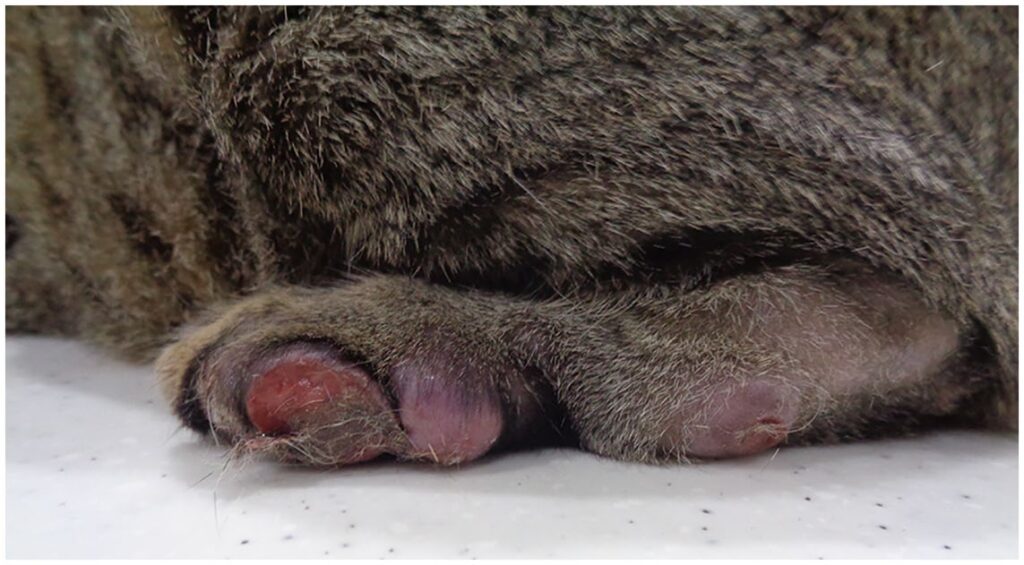
按照药敏结果,将治疗改为口服克拉霉素(20 mg/kg q12h)、氯法齐明(50 mg/cat q48h)、强力霉素(8 mg/kg q24h)。
04 预后
采用新三联疗法4周后,体重恢复到3.7 kg(增加了10%),没有出现新的病变,皮下软组织肿胀缓慢消退,但脸部、耳廓和爪子上仍有结节。
最近一次复查是在开始使用氯法齐明和克拉霉素8个月后,猫的体重稳定在4.8 kg,血清球蛋白和离子钙浓度在正常参考值范围内(下图)。在耳廓、脸部和爪子病变持续存在。
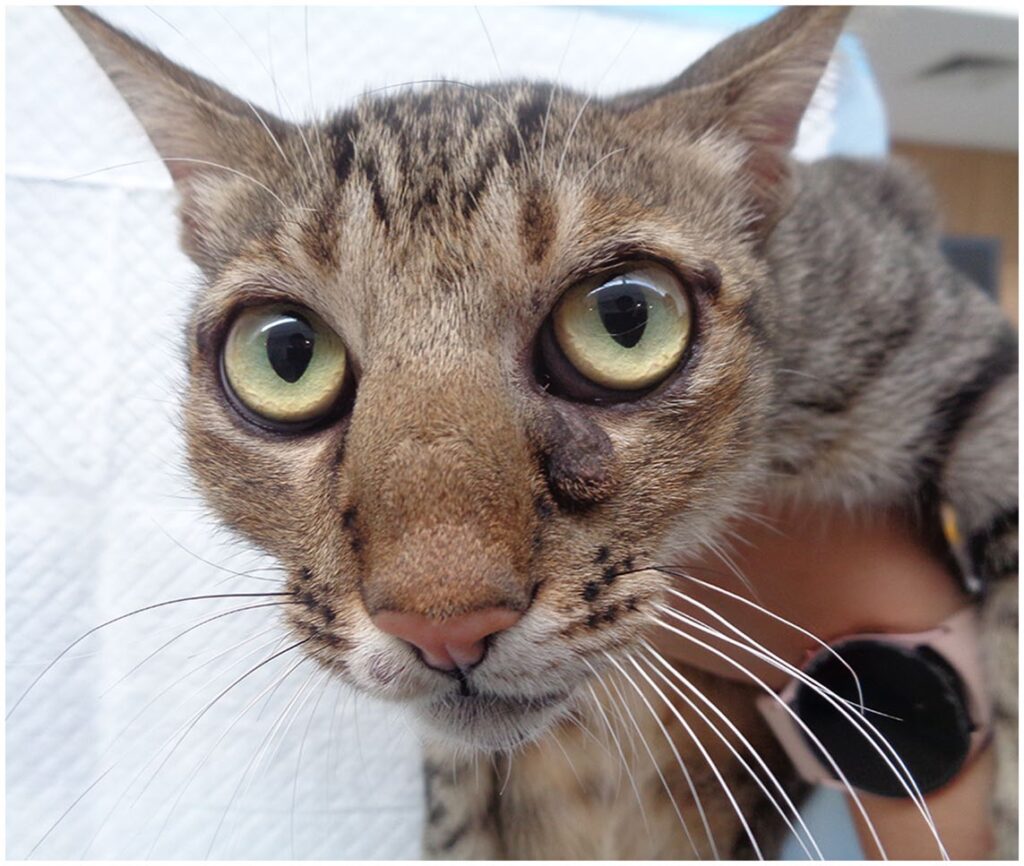

05 讨论
鸟分枝杆菌复合群(MAC)由多种非结核分枝杆菌(NTM)组成,无法通过专业培养进行区分,需要进行基因检测。作为机会性吸附菌,NTM由生长缓慢和生长迅速的菌种组成,可导致猫感染,通常累及皮肤和皮下组织(局灶性、多灶性或弥漫性病变),但除MAC感染外,很少发展为全身性疾病[1,2]。鸟分枝杆菌、胞内分枝杆菌、副胞内分枝杆菌通常与人类患者的呼吸系统感染有关,而奇美拉分枝杆菌则与开胸手术中的机会性感染有关[3,4]。
在猫身上,NTM感染会导致皮肤/皮下结节或肉芽肿性泛发性炎,并伴有不同程度的淋巴结受累。除鸟分枝杆菌外,由NTM引起的全身性分枝杆菌病非常罕见[5]。受感染的猫一般都有户外活动史,狩猎和打斗(接触受感染的猎物或土壤)是导致皮肤损伤和继发性霉菌感染的诱发因素。本病例报告描述了一例免疫功能正常猫的胞内分枝杆菌病病例,表现为全身皮肤和皮下结节,没有全身扩散。
这是东南亚地区报告的首例NTM——胞内分枝杆菌——在猫体内致病的病例。由于该细菌在环境中无处不在,因此很可能在胃肠道中建立了感染,从而在全身扩散之前引起慢性腹泻。
在人类免疫缺陷病毒(HIV)感染者中,免疫抑制晚期和/或CD4细胞计数小于50 cells/mm的HIV感染者中,MAC传播性疾病的发病率为20-40%[3,4]。
局部肉芽肿病变最常见于皮下直接接种感染,通常不会系统性扩散[5]。在本病例中,无法确定导致全身扩散的免疫抑制的主要原因。
胞内分枝杆菌很少有在猫体内致病的报道。在一份病例报告中,德国的一只4岁雌性波斯猫曾有厌食、长期消瘦和抑郁的病史,但没有皮肤病变[6]。经检查,该猫表现出虚弱、消瘦和明显脱水。放射线检查发现腹部有一个直径约3-5 cm肿块。由于预后不佳且无力治疗,该猫被实施了安乐术。尸体解剖显示猫全身淋巴结肿大,组织病理学显示淋巴结、脾脏、肺、肝脏、肠道和骨髓出现严重的多灶性至弥漫性肉芽肿性炎症[6]。
本病例表现与英国报告的一例病例更为一致,该病例也没有全身症状[7]。该病例指出,绝育后的短毛/长毛公猫容易感染MAC,其典型表现为肿块(可能溃烂,也可能无溃烂,伴有渗出性分泌物),不仅主要出现在头部,也可能出现在全身[7]。这可能是由于该病菌喜欢在31.5°C的温度下生长,临床表现为病变往往持续在身体较冷的部位,如面部、耳廓和爪垫,本病例就是如此[8]。
这与阿比西尼亚猫和索马里猫感染鸟分枝杆菌形成鲜明对比,鸟分枝杆菌感染在阿比西尼亚猫和索马里猫中具有品种易感性,其最一致的体征表现为疾病进展缓慢、长期体重减轻和消瘦。全身受累很常见,胸片显示出独特的严重弥漫性间质模式,尽管猫有肺部症状[9]。
在临床上,本报告中的猫可能与猫麻风病最为相似,该病由麻风分枝杆菌和其他几种分枝杆菌引起,特点是迅速进展、局部扩散、不痛、隆起、肉质、皮肤和皮下结节,较大的病变倾向于溃疡,但不会向内脏器官扩散[10]。
最近,对麻风杆菌进行的全基因组测序表明,麻风杆菌实际上可能与MAC更为相关,这可能部分解释了我们病例中的这一观察结果[11]。治疗MAC感染的常用药物有大环内酯类(如阿奇霉素、克拉霉素)、氯法齐明、利福平和氟喹诺酮类(如普拉泊沙星、莫西沙星)[12]。四环素类(如多西环素)对MAC感染有效的报道并不多见,但本病例是个例外[13]。
在本病例中,三联疗法的经验性治疗导致腹泻和体重减轻,这很可能是利福平和/或阿奇霉素所致[12]。由于马波沙星和普拉朵沙星属于二线抗生素,克拉霉素、阿奇霉素和利福平属于三线抗生素,因此这些药物的联合使用一直备受关注,有人建议利福平应仅用于人群[14]。虽然需要使用三联疗法来降低耐药性风险,但产生耐药性的风险依然存在,因为猫必须连续多周每天服用三种药物,很难保持依从性。
根据药敏结果,治疗改为氯法齐明、克拉霉素和强力霉素,为期3个月,然后继续使用氯法齐明和克拉霉素进行长期治疗。由于存在与药物相关的食道炎和狭窄形成的风险,停用了片剂形式的强力霉素,但停药后没有复发。
氯法齐明是一种吩嗪染料,会在巨噬细胞内大量蓄积,促进氧自由基的产生。口服时,它的吸收率不一,在全身分布不均,主要集中在肝、脾、肺、脂肪组织和皮肤,可引起肝中毒[15]。
由于耐药性结核病(TB)发病率的增加,世界卫生组织建议限制使用氯唑嗪等二线结核病药物[16]。在本病例中,只有凭处方才能获得这种药物。乙胺丁醇是另一种一线结核病药物,可添加到较长的耐多药结核病治疗方案中。在推荐剂量下,乙胺丁醇是安全的,猫对该药有明显的敏感性[17]。
克拉霉素是一种大环内酯类抗生素,单独使用或与其他药物联合使用可有效治疗MAC感染[18]。由于高钙血症通常与潜在的肉芽肿疾病过程有关,因此血清离子化钙浓度最好能成为霉菌感染常规评估和监测的一部分[19]。此外,由于缺乏管理这种疾病的经验,没有定期进行全腹部超声波评估。
为了指导治疗,必须了解哪些分枝杆菌最有可能导致猫患病。例如,在英国,微小分支杆菌是猫最常见的分枝杆菌感染,因此在本病例中最初选择的经验性三联疗法将是明智的首选。然而,在澳大利亚,最常见的是耻垢分枝杆菌和偶发分枝杆菌,因此首选药物是氟喹诺酮类药物和强力霉素,而在美国,偶发分枝杆菌和脓肿分枝杆菌最常见,因此首选药物是克拉霉素,而应避免使用较老的氟喹诺酮类药物[20,21]。
参考文献
[1] Malik R, Hughes MS, James G, et al. Feline leprosy: two different clinical syndromes. J Feline Med Surg 2002; 4: 43–59.
[2] Munro MJL, Byrne BA, Sykes JE. Feline mycobacterial disease in northern California: epidemiology, clinical features, and antimicrobial susceptibility. J Vet Intern Med 2021; 35: 273–283.
[3] Lee SY, Kim BJ, Kim H, et al. Mycobacterium paraintracellulare sp. nov., for the genotype INT-1 of Mycobacterium intracellulare. Int J Syst Evol Microbiol 2016; 66: 3132–3141.
[4] Nightingale SD, Byrd LT, Southern PM, et al. Incidence of Mycobacterium avium-intracellulare complex bacteremia in human immunodeficiency virus-positive patients. J Infect Dis 1992; 165: 1082–1085.
[5] Malik R, Gabor L, Martin P, et al. Subcutaneous granuloma caused by Mycobacterium avium complex infection in a cat. Aust Vet J 1998; 76: 604–607.
[6] Knippel A, Hetzel U, Baumgärtner W. Disseminated Mycobacterium avium–intracellulare infection in a Persian cat. J Vet Med 2004; 51: 464–466.
[7] Gunn-Moore DA, McFarland SE, Brewer JI, et al. Mycobacterial disease in cats in Great Britain: I. Culture results, geographical distribution and clinical presentation of 339 cases. J Feline Med Surg 2011; 13: 934–944.
[8] Covert TC, Reyes AL, Rodgers MR, et al. The effect of temperature on the growth of Mycobacterium Avium Complex (MAC) organisms. Presented at American Society of Microbiology 101st General Meeting, Orlando, FL, 2001 May 20–24.
[9] Baral RM, Metcalfe SS, Krockenberger MB, et al. Disseminated Mycobacterium avium infection in young cats: overrepresentation of Abyssinian cats. J Feline Med Surg 2006; 8: 23–44.
[10] O’Brien CR, Malik R, Globan M, et al. Feline leprosy due to Mycobacterium lepraemurium: further clinical and molecular characterisation of 23 previously reported cases and an additional 42 cases. J Feline Med Surg 2017; 19: 737–746.
[11] Benjak A, Honap TP, Avanzi C, et al. Insights from the genome sequence of Mycobacterium lepraemurium: massive gene decay and reductive evolution. mBio 2017; 8: e01283–e01217.
[12] Gunn-Moore DA, McFarland SE, Schock CA, et al. Mycobacterial disease in a population of 339 cats in Great Britain: II. Histopathology of 225 cases, and treatment and outcome of 184 cases. J Feline Med Surg 2011; 13: 945–952.
[13] Li A, Tan Z, He S, et al. In vitro susceptibility testing of tetracycline-class antibiotics against slowly growing non-tuberculous mycobacteria. Clin Exp Pharmacol Physiol 2023; 50: 604–609.
[14] Gunn-Moore DA. Feline mycobacterial infections. Vet J 2014; 201: 230–238.
[15] Gopal M, Padayatchi N, Metcalfe JZ, et al. Systematic review of clofazimine for the treatment of drug-resistant tuberculosis. Int J Tuberc Lung Dis 2013; 17: 1001–1007.
[16] World Health Organization. WHO consolidated guidelines on tuberculosis: Module 4: Treatment – drug-resistant tuberculosis treatment. Geneva, Switzerland: World Health Organization, 2020.
[17] Eroksuz Y, Baydar E, Otlu B, et al. Case report: systemic tuberculosis caused by Mycobacterium bovis in a cat. BMC Vet Res 2019; 15: 9.
[18] Dautzenberg B, Piperno D, Diot P, et al. Clarithromycin in the treatment of Mycobacterium avium lung infections in patients without AIDS. Chest 1995; 107: 1035–1040.
[19] Broughton SE, O’Neill DG, Syme HM, et al. Ionized hypercalcemia in 238 cats from a referral hospital population (2009–2019). J Vet Int Med 2023; 37: 80–91.
[20] Horne KS, Kunkle GA. Clinical outcome of cutaneous rapidly growing mycobacterial infections in cats in the south-eastern United States: a review of 10 cases (1996–2006). J Fel Med Surg 2009; 11: 627–632.
[21] O’Brien C. Mycobacterial diseases. In: Noli C, Colombo S. (eds). Feline dermatology. Cham, Switzerland: Springer Nature Switzerland AG, 2020, pp 251–264.