
| 一般情况 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:12岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:皮炎外瓶霉菌感染 | |
01 主诉及病史
发现左侧颈部有一个单发的皮下软肿块(下图)。
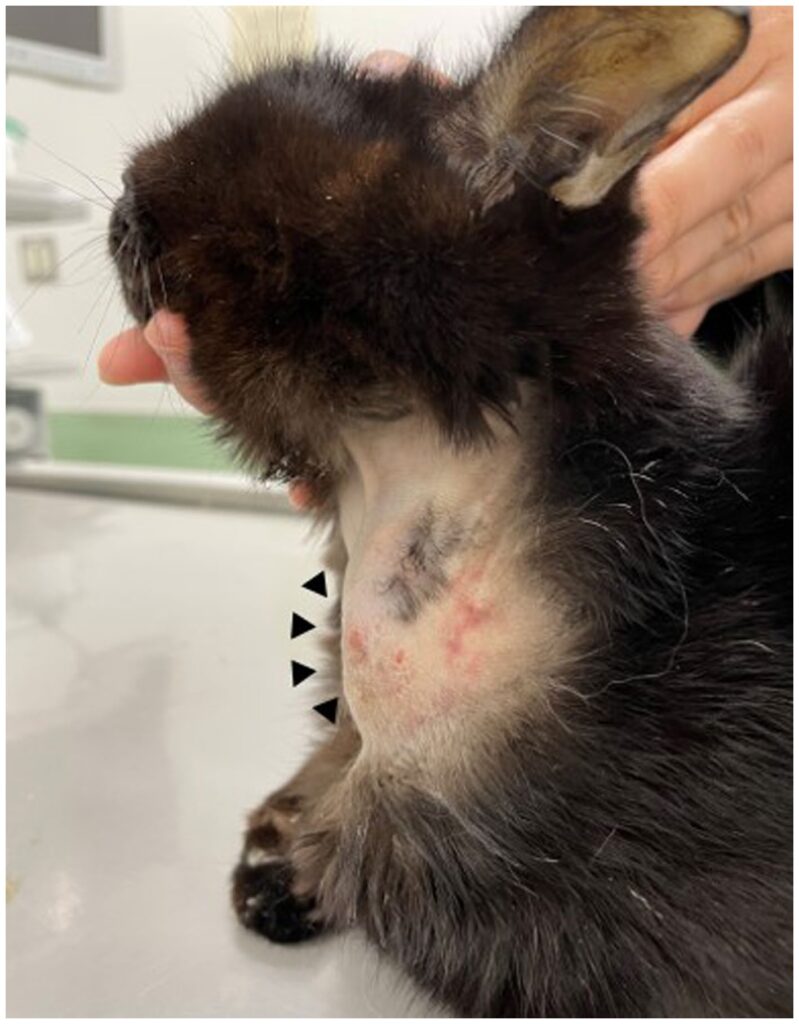
该猫与另外两只猫一起在室内饲养。主人在三天前发现了一个直径约1 cm肿块,直到就诊前肿块一直在增大。由于该猫有慢性肾病病史、严重厌食、肝酶升高和黄疸,76天前在发现肿块的左侧颈部曾放置过食管插管进行喂食。
此外,该猫在发病前49天通过腹腔镜肝活检被诊断为化脓性淋巴浆细胞性胆管炎。由于厌食情况有所改善,在腹腔镜肝脏活检过程中移除了食管插管。腹腔镜肝活检时收集的胆汁细菌培养呈阴性。给猫口服了泼尼松龙(1-2 mg/kg,q24h)至今。泼尼松龙治疗后,厌食、肝酶升高和黄疸得到了很好的控制。
02 治疗
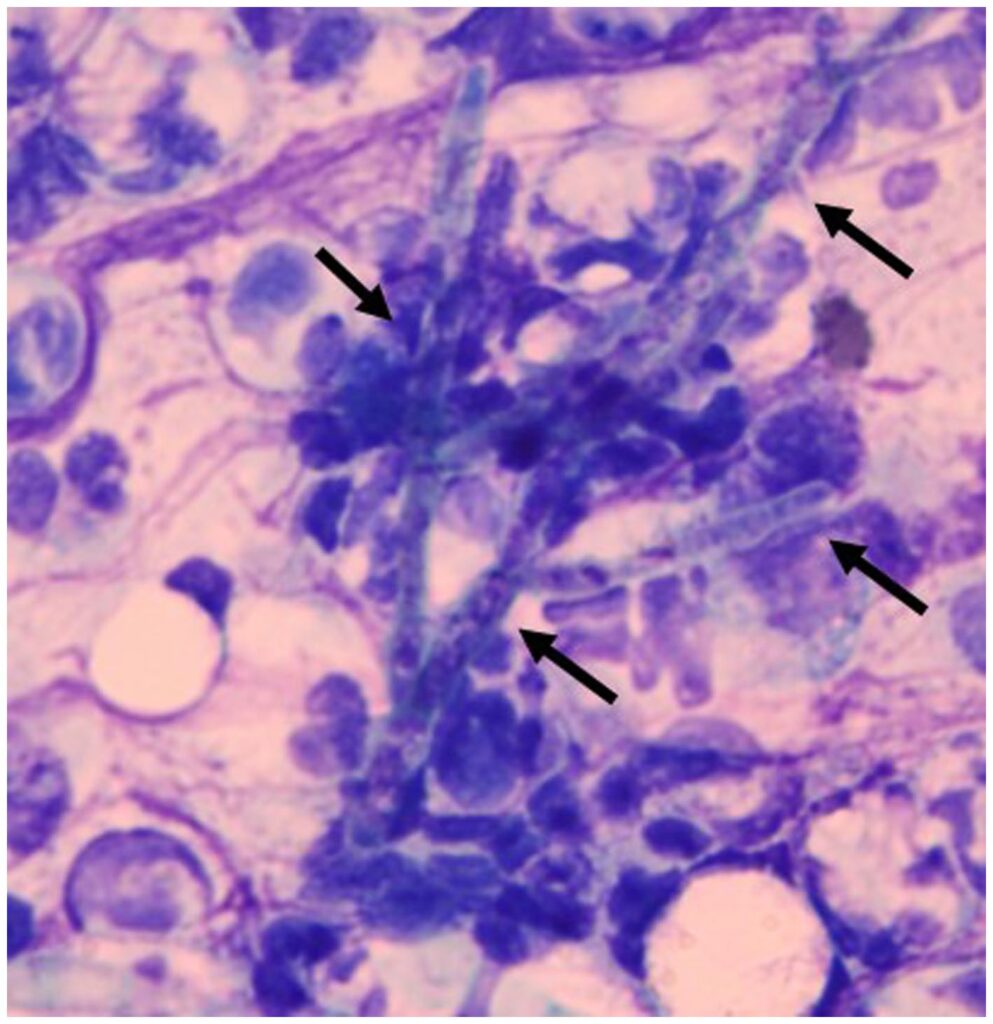
第1天,用手术刀切开皮下肿块,排出脓液。脓液的细胞学检查显示菌丝与中性粒细胞和巨噬细胞浸润(下图)。因此肿块被诊断为脓肿。脓液的细菌培养呈阴性。
第3天,开始局部治疗,切开皮下脓肿,用生理盐水清洗,并口服伊曲康唑(10 mg/kg,q24h)。然而在开始治疗后不久,猫就出现了厌食和嗜睡症状。虽然治疗前23天的血浆总胆红素水平为0.7 mg/dL(区间:0.1-0.5),但开始治疗3天后血浆总胆红素水平升高(1.8 mg/dL)。这些异常被认为是伊曲康唑的不良反应,因此在第5天停药。随后每隔2-3天对皮下脓肿进行一次局部治疗,包括切开、清洗和局部注射酮康唑乳膏(2%)。此外继续使用泼尼松龙口服(1 mg/kg,q24h)治疗原发性肝炎。
猫接受了数周的治疗。然而,病灶再次扩大,全身状况逐渐恶化。第30天,厌食和嗜睡症状加重,出现氮质血症(血BUN 80.7 mg/dL;区间:17.6-32.8)、低钾血症(2.4 mEq/L;区间:3.4-4.6)和黄疸(5.2 mg/dL)。尽管进行了重症监护,这只猫还是在第31天死亡。
03 真菌鉴定
将从皮下脓肿收集的脓液接种到钾葡萄糖琼脂平板上,在35°C、27°C和42°C下培养7天。从形态上看,深绿色、蜡状、光滑、酵母样的菌落在35°C下生长(下图A)。显微镜下可观察到萌发的椭圆形酵母菌(下图B)。深绿色菌落带有气生菌丝,在27°C生长(下图C)。显微镜检查发现棕色的隔膜菌丝和椭圆形的分生孢子梗(下图D)。
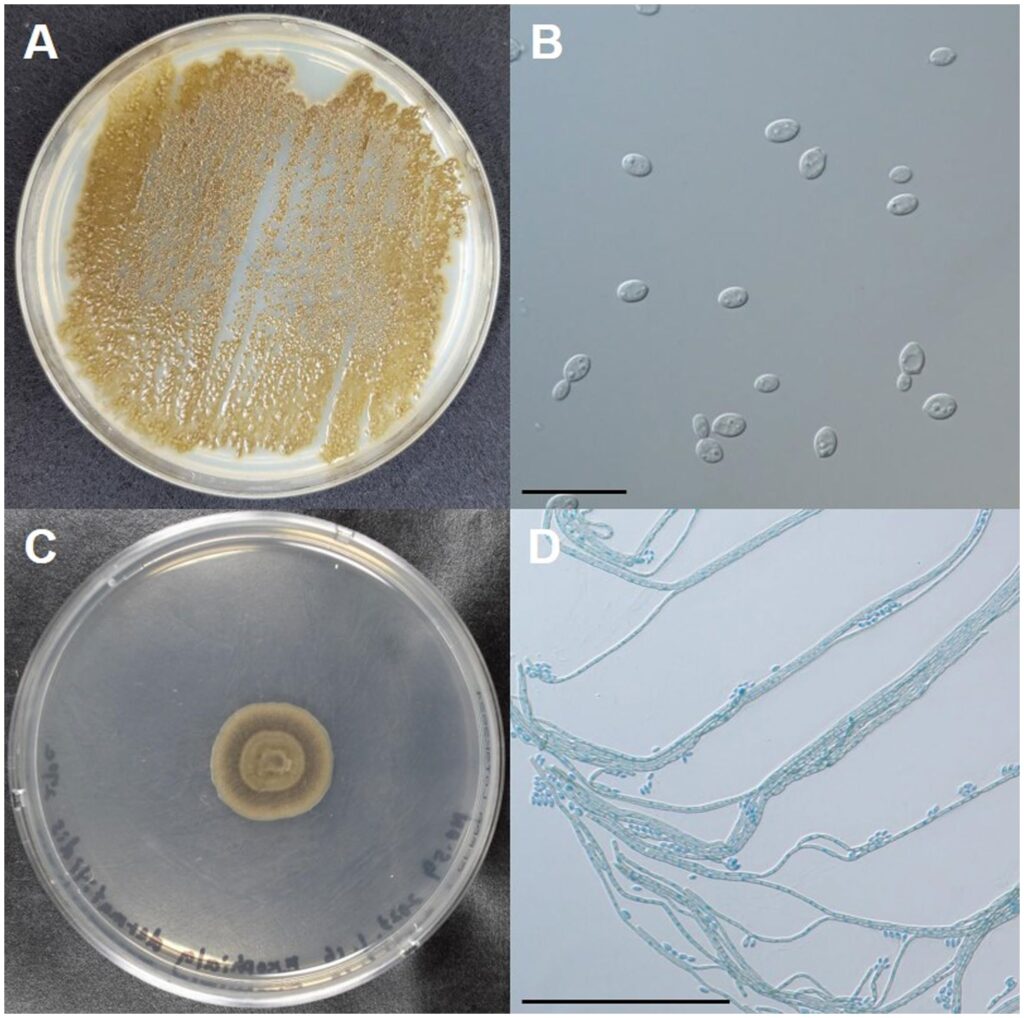
即使在42°C时,菌落也显示出类似酵母菌的发育。为了对真菌进行分子鉴定,从分离物中提取了DNA进行了测序。测序结果符合与皮炎外瓶霉菌。根据这些结果,该猫被诊断为由皮炎外瓶霉菌引起的皮下暗色丝孢霉病。
04 药敏检测
抗真菌药敏试验结果显示,两性霉素B(MIC,0.12 μg/mL)对皮炎外瓶霉菌具有较高的体外活性。考虑到每种抗真菌药物的测试浓度,伊曲康唑(MIC,0.25 μg/mL)和酮康唑(MIC,0.5 μg/mL)对皮炎外瓶霉菌具有中等体外抗真菌活性。皮炎外瓶霉菌对其他抗真菌药物的敏感性较低。
05 讨论
皮炎外瓶霉菌(Exophiala dermatitidis)是一种机会致病性黑色酵母样真菌,可引起暗色丝孢霉病(phaeohyphomycosis)[1]。皮炎外瓶霉菌的黑色素是细胞壁的一种成分[1]。它是一种全球分布、无处不在的真菌,但很少从环境中分离出来[2]。
皮炎外瓶霉菌经常出现在高温潮湿的人造室内环境中,如洗碗机、浴室和桑拿设施[1]。虽然皮炎外瓶霉菌感染很少见,但皮炎外瓶霉菌会导致免疫抑制和免疫功能正常的人患上暗色丝孢霉病[1]。
暗色丝孢霉病最常见的表现是皮肤和皮下感染,但真菌较少导致全身播散或累及皮外器官,如中枢神经系统、心脏、胃肠道、肺和骨骼[3]。一旦确定感染了皮炎外瓶霉菌,就需要采取积极的综合疗法,包括手术切除和抗真菌药物治疗[3]。
在小动物临床中,有两只犬感染了皮炎外瓶霉菌[4,5]。一只犬曾患有淋巴瘤,接受过四个月的化疗,在其颈部形成了多个黑色或紫色的皮下结节[4]。另一只犬被诊断为过敏症,并接受了六个月的口服环孢素治疗,皮炎外瓶霉菌诱发了腹内肿块和淋巴结病[5]。
虽然大会摘要曾报道过猫感染皮炎外瓶霉菌的病例[6],但尚未发表过描述猫感染皮炎外瓶霉菌的同行评议研究报告。本病例报道了一只患有肝炎的猫在接受强的松龙治疗期间因感染皮炎外瓶霉菌而引起的皮下暗色丝孢霉病。
有报道称,通过手术和口服伏立康唑和特比萘芬,成功治疗了一只腹腔内感染皮炎外瓶霉菌的犬[5]。本报告中的猫接受了为期三天的伊曲康唑治疗,但由于肝脏出现了推测的不良反应,无法继续使用这种药物。
根据两性霉素B对临床分离的皮炎外瓶霉菌的体外抗真菌活性,可选择两性霉素B。由于两性霉素B会诱发肾毒性这一不良反应,因此这种药物不适合本病例,因为该猫有慢性肾功能衰竭病史,而且出现了氮质血症。
此外,伏立康唑和特比萘芬在体外对猫的皮炎外瓶霉菌临床分离株的抗真菌活性较低(MIC 分别为1和2 μg/mL)。本病例对皮下病灶进行了综合局部治疗,包括通过小切口排脓、生理盐水冲洗和酮康唑乳膏输注。然而,局部治疗并未取得缓解,猫最终死亡。
有人建议,对于不局限于皮炎外瓶霉菌的猫拟真菌病的局部病变,可采用手术切除和全身使用抗真菌药物的方法,包括伊曲康唑、泊沙康唑和两性霉素B[19]。在本病例中,作者没有研究泊沙康唑的抗真菌效果,但它对来自人类的皮炎外瓶霉菌临床分离株具有活性(MIC,< 0.002-0.25 μg/mL)[1]。
因此,值得测试泊沙康唑对猫科动物皮炎外瓶霉菌分离株的抗真菌活性。由于皮炎外瓶霉菌感染的治疗通常具有挑战性,即使在人类中也是如此,因此兽医学领域有必要开展进一步的研究。
该病例死因不明,但根据临床病程,可能与播散性皮炎外瓶霉菌感染有关。虽然播散性皮炎外瓶霉菌感染在人类中很少见,但在免疫力低下的患者中更为常见[3]。本报告中的猫因长期接受强的松龙治疗而免疫力低下。因此,在局部皮下感染皮炎外瓶霉菌后,可能会发生播散性感染并侵入猫的内脏器官,包括肝脏。
另外,猫可能已经通过食道全身感染了皮炎外瓶霉菌,泼尼松龙治疗可能引发了局部和全身的临床症状。在这种情况下,积极的检查(包括血液培养皮炎外瓶霉菌)将有助于确定是否为播散性感染。
参考文献
[1] Kirchhoff L, Olsowski M, Rath PM, Steinmann J. Exophiala dermatitidis: key issues of an opportunistic fungal pathogen. Virulence. (2019) 10:984–98.
[2] Sudhadham M, Prakitsin S, Sivichai S, Chaiyarat R, Dorrestein GM, Menken SB, et al.. The neurotropic black yeast Exophiala dermatitidis has a possible origin in the tropical rain forest. Stud Mycol. (2008) 61:145–55.
[3] Usuda D, Higashikawa T, Hotchi Y, Usami K, Shimozawa S, Tokunaga S, et al.. Exophiala dermatitidis. World J Clin Cases. (2021) 9:7963–72.
[4] Kano R, Kusuda M, Nakamura Y, Watanabe S, Tsujimoto H, Hasegawa A. First isolation of Exophiala dermatitidis from a dog: identification by molecular analysis. Vet Microbiol. (2000) 76:201–5.
[5] Murphy KF, Malik R, Barnes A, Hotston-Moore A, Pearson GR, Barr FJ. Successful treatment of intra-abdominal Exophiala dermatitidis infection in a dog. Vet Rec. (2011) 168:217.
[6] Makri N, Paterson G, Gregge F, Urquhart C, McCluskey H, Nuttall T. Two case reports of novel cutaneous mycoses in cats in the UK using molecular identification for rapid and accurate diagnosis. In: British Small Animal Veterinary Association Congress Proceedings 2019. Birmingham, UK. Gloucestershire: BSAVA (2019) p. 443.
[7] White TJ, Bruns T, Lee S, Taylor J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: Innis MA, Gelfand DH, Sninsky JJ, White TJ, editors. PCR protocols: a guide to methods and applications. San Diego, CA: Academic Press; (1990). p. 315–22.
[8] Suh MK, Lee HC, Kim DM, Ha GY, Choi JS. Molecular phylogenetics of exophiala species isolated from Korea. Ann Dermatol. (2012) 24:287–94.
[9] Alexander BD, Procop GW, Dufresne P, Espinel-Ingroff A, Fuller J, Ghannoum MA, et al.. Clinical and laboratory standards institute. Reference method for broth dilution antifungal susceptibility testing of filamentous Fungi. M38. 3rd ed. Wayne, PA: Clinical and Laboratory Standards Institute; (2017).
[10] Daly JA, Hubka V, Kubátová A, Gimeno M, Barrs VR. Feline disseminated cutaneous phaeohyphomycosis due to Exophiala spinifera. Med Mycol Case Rep. (2019) 27:32–5.
[11] Overy DP, Martin C, Muckle A, Lund L, Wood J, Hanna P. Cutaneous phaeohyphomycosis caused by Exophiala attenuata in a domestic cat. Mycopathologia. (2015) 180:281–7.
[12] Bernhardt A, von Bomhard W, Antweiler E, Tintelnot K. Molecular identification of fungal pathogens in nodular skin lesions of cats. Med Mycol. (2015) 53:132–44.
[13] Maeda H, Shibuya H, Yamaguchi Y, Miyoshi T, Irie M, Sato T. Feline digital phaeohyphomycosis due to Exophiala jeanselmei. J Vet Med Sci. (2008) 70:1395–7.
[14] Helms SR, McLeod CG. Systemic Exophiala jeanselmei infection in a cat. J Am Vet Med Assoc. (2000) 217:1858–61.
[15] Nuttal W, Woodgyer A, Butler S. Phaeohyphomycosis caused by Exophiala jeanselmei in a domestic cat. N Z Vet J. (1990) 38:123.
[16] Kettlewell P, McGinnis MR, Wilkinson GT. Phaeohyphomycosis caused by Exophiala spinifera in two cats. J Med Vet Mycol. (1989) 27:257–64.
[17] Pukay BP, Dion WM. Feline phaeohyphomycosis: treatment with ketaconazole and 5-fluorocytosine. Can Vet J. (1984) 25:130–4.
[18] Bostock DE, Coloe PJ, Castellani A. Phaeohyphomycosis caused by Exophiala jeanselmei in a domestic cat. J Comp Pathol. (1982) 92:479–82.
[19] Lloret A, Hartmann K, Pennisi MG, Ferrer L, Addie D, Belák S, et al.. Rare opportunistic mycoses in cats: phaeohyphomycosis and hyalohyphomycosis: ABCD guidelines on prevention and management. J Feline Med Surg. (2013) 15:628–30.