
| 一般情况 | |
|---|---|
 | 品种:贵宾犬 |
| 年龄:6岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:牙源性鬼影细胞癌 | |
01 主诉及病史
右下颌区域肿块,进食时剧烈疼痛,嘴巴无法完全闭合。
1年前发现该肿块,1个月前迅速增大。1个月前进行了组织病理学和CT检查。肿块被初步诊断为口腔癌,疑为鳞状细胞癌和恶性牙源性肿瘤。CT显示右下颌第一和第三前臼齿之间有骨侵犯,并伴有软组织侵犯。未发现肺部转移病灶。该犬接受了抗生素和消炎治疗,但未见任何反应。
02 检查
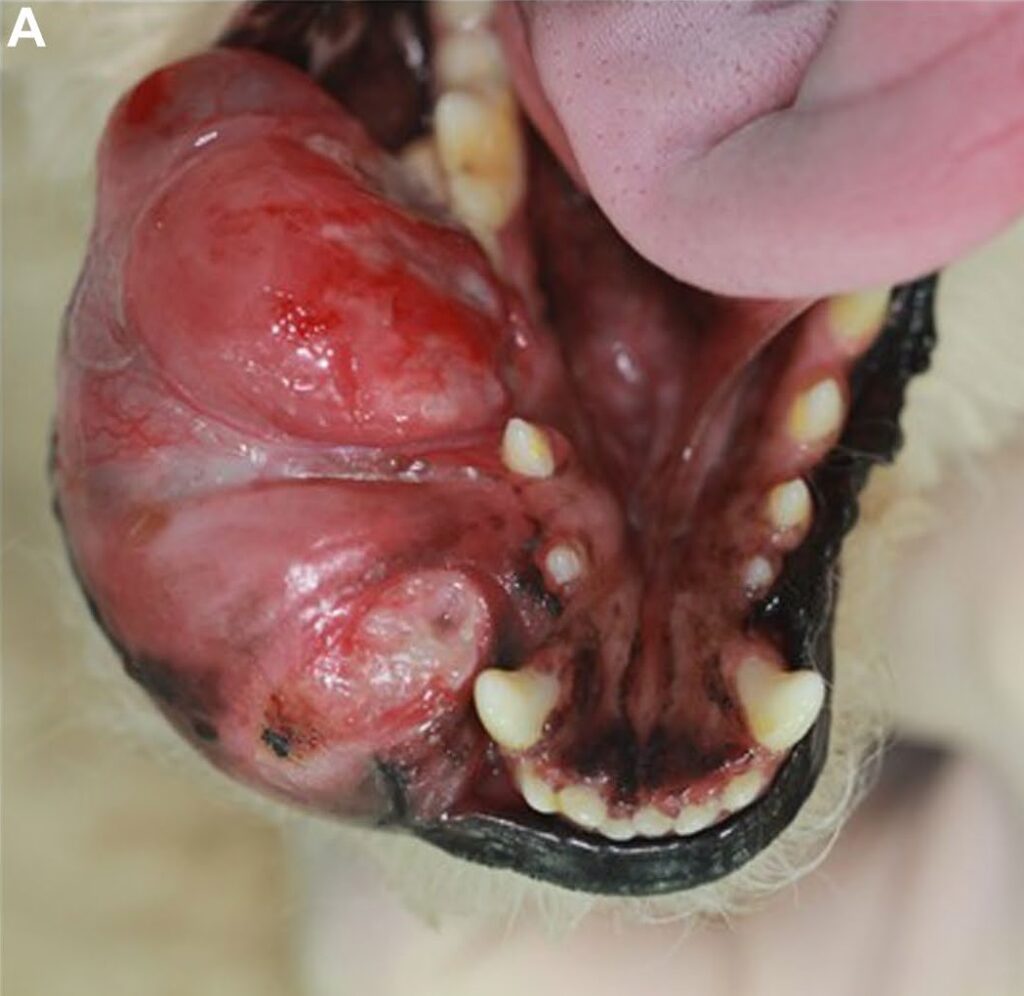
触诊时下颌疼痛。从右侧下颌犬齿到第一臼齿之间发现了一个54×42×35 mm3的巨大无波动肿块,肿瘤影响到颊面龈和邻近的下颌皮肤,使口腔无法完全闭合。肿块背面有明显的咬合创伤性溃疡,源自同侧的上颌犬齿和前臼齿(下图)。
血液学和血生化显示出以下异常:高蛋白血症(7.7 g/dL;参考:5.0-7.2)、高甘油三酯血症(499 mg/dL;参考:30-133)、高胆红素血症(0.7 mg/dL;参考:0.1-0.5)和γ谷氨酰转肽酶升高(68 U/L;参考:5.0-14)。
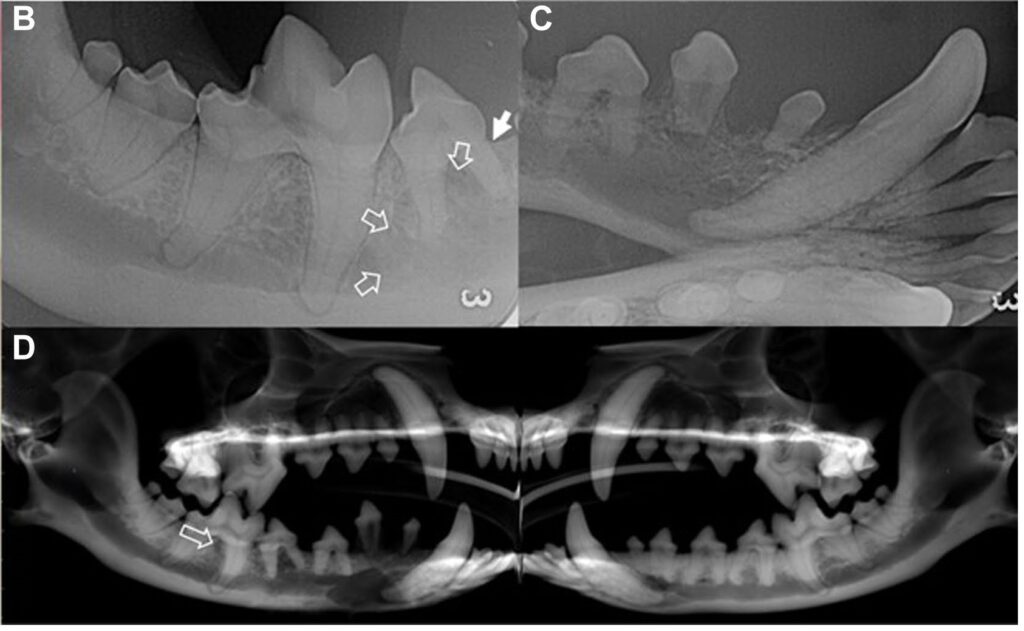
口腔内CT检查显示,从右下颌犬齿延伸至第四前臼齿的骨溶解、水平骨缺失(下图B)以及右下颌第一和第二前臼齿背侧移位(下图C)。头CT 显示右下颌第一磨牙的关节间骨质有放射状突起(下图D)。
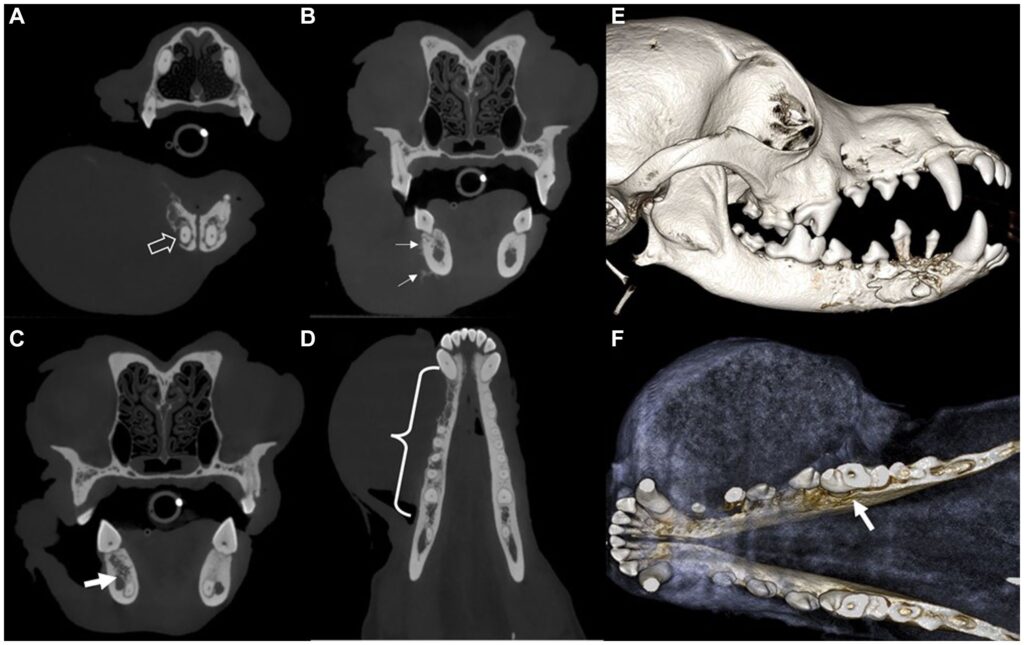
右下颌犬齿根尖部位出现破坏性骨病变,并伴有巨大肿瘤(下图A)。在右下颌第四前磨牙和第一磨牙的颊侧周围观察到钙化病变(下图B)。肿块已侵入右下颌第一磨牙下颌管附近的齿间骨(下图C),破坏性骨病变从右下颌犬齿延伸至第一磨牙的齿间骨(下图D)。右下颌犬齿和第四前磨牙区域之间存在骨溶解(下图E),骨质流失延伸至右下颌第一磨牙中牙根的舌侧(下图F)。
经口腔检查,右下颌第一和第二前臼齿的活动度为二期,而被肿瘤覆盖的第三前臼齿的活动度为三期,龈沟暴露。X光片和口腔检查显示,肿瘤从右下颌犬齿延伸至第一磨牙的中侧,主要累及颊面龈、下颌骨口腔粘膜和与肿瘤相对应的邻近下颌骨皮肤。
一个月前才通过组织病理学和放射学检查确诊为恶性肿瘤,由于肿瘤迅速增大且疼痛剧烈,为了改善患者的生活质量,建议主人进行手术治疗。
03 手术
考虑到肿块具有侵袭性,已经穿透了下颌骨管,并有可能向右下颌骨全长扩散,因此需要进行单侧下颌骨全切除术和肿瘤侵犯的皮肤切除术,然后再进行皮瓣手术。
手术前,皮下注射了卡泊芬钠(4.0 mg/kg)。使用布比卡因(1mg/kg)进行右下齿槽区域神经阻滞,并使用芬太尼透皮贴片(12 μg/h)用于术后止痛。
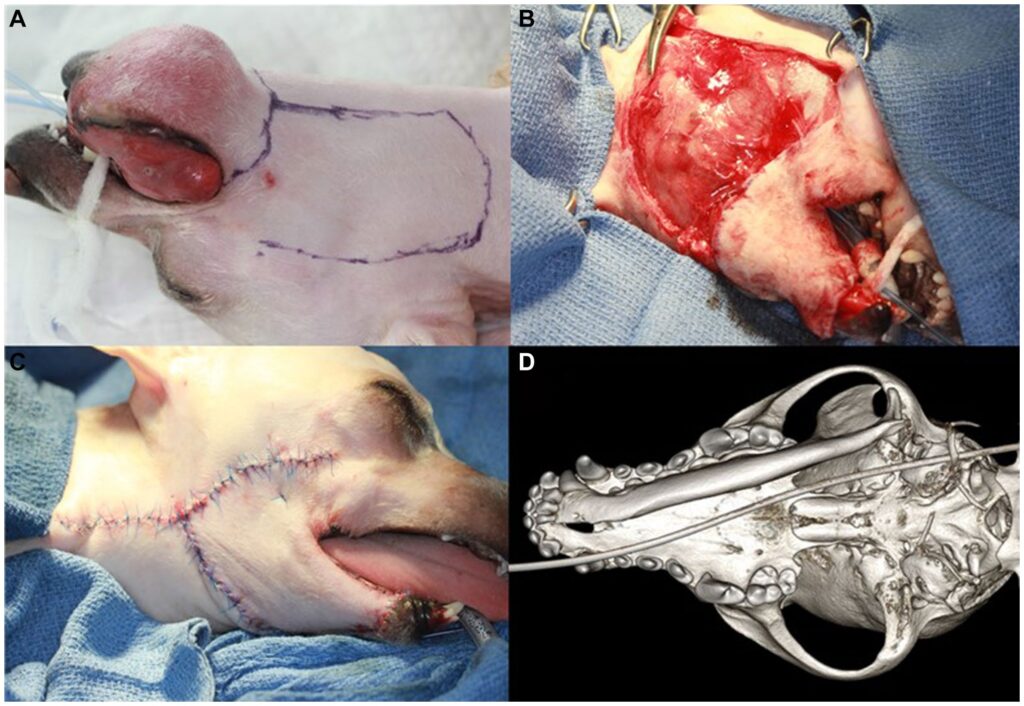
犬背卧位,用0.12%洗必泰溶液冲洗口腔后,进行牙齿清洁和抛光。确定手术边缘为10.0 mm,并在肿瘤周缘做标记。使用无菌手术记号笔为面部(口角)肌皮转位瓣做额外标记(下图A)。然后将犬调整至胸骨后位。用一条长胶带通过上颌犬齿穿孔悬吊上颌骨。然后将胶带的末端缠绕在患者头部两侧的静脉注射杆上。
在下颌骨骨骺水平沿喙舌粘膜做一个初始切口。沿手术边缘从右下颌犬齿至喙突边缘做全厚粘膜切口。用10号手术刀片劈开下颌骨干骺端,然后用PAP手术刀分离。使用10号手术刀片劈开下颌骨干骺端,并使用P24G骨膜提升器进行分离。
使用骨膜提升器提升切开的粘膜瓣,暴露下牙槽神经血管束,并使用4-0缝线进行结扎。神经血管束在靠近下颌孔处横断。将下颌骨和颌骨体从所有附着组织中剥离出来,并使用骨膜提升器进行钝性剥离,将颞下颌关节分开。沿着标记的切除线进行皮肤切除,完全切除右下颌骨。用0.9%无菌生理盐水冲洗手术部位。
进行面部皮瓣手术时,将犬置于左侧卧位。切开面部皮肤和浅层肌肉,沿着皮瓣设计从尾到喙的方向进行钝性剥离,同时注意保留口角血管。使用4-0缝线以间断模式从喙侧到尾侧对移位的面部皮瓣进行初步缝合(下图B)。使用5-0缝线以简单间断的缝合方式缝合口内和新形成的粘膜接合处(下图C)。术后CT检查未发现任何损伤(下图D)。
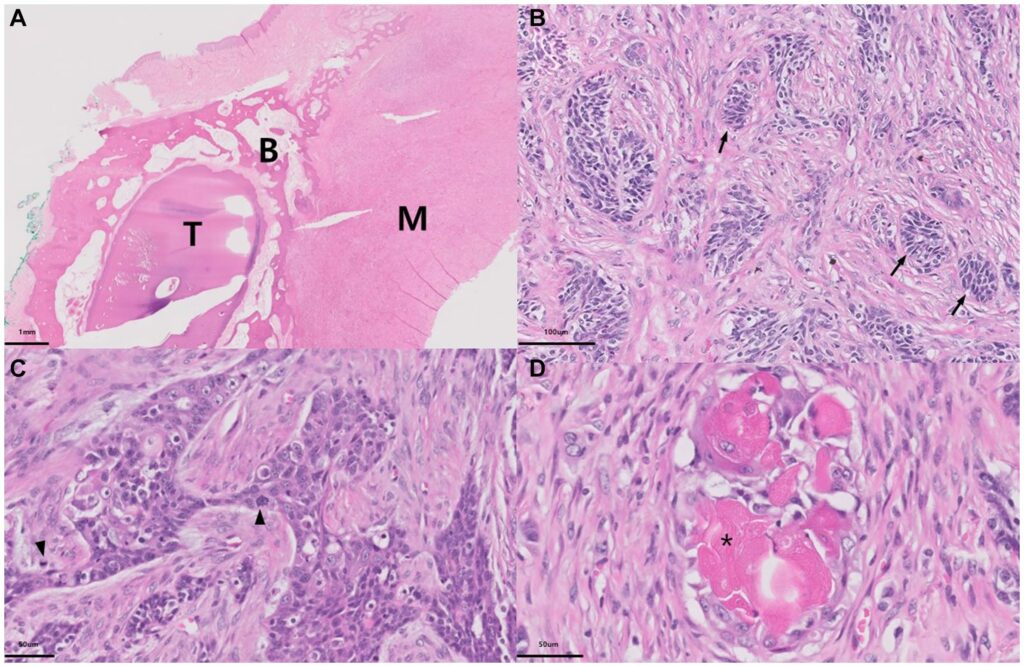
组织病理学检查发现,肿瘤上皮细胞分界不清,呈浸润性,形成小的岛屿和小梁(下图A-C)。这些肿瘤细胞表现出恶性组织学特征,如多形性和高有丝分裂活性(下图BC)。一些瘤细胞巢呈栅栏状柱状上皮细胞,因此提示其来源于牙源性细胞(下图B),还有一些瘤细胞呈鳞状分化,具有更多明亮的嗜酸性细胞质和不同程度的角化(下图C)。肿块中含有大小不一的多灶性囊性结构,内衬为简单、不同程度衰减的立方形上皮。囊性结构空虚或含有少量至中等量的轻度嗜酸性物质。肿瘤细胞大多表现为鬼影细胞,细胞边界不清,有少量嗜酸性细胞质,细胞膜和核膜轮廓模糊,无细胞核(下图D)。根据上述组织病理学结果,该病变被诊断为牙源性鬼影细胞癌(GCOC)。
04 预后
该犬未出现并发症,出院时口服阿莫西林/克拉维酸(15 mg/kg,BID)、卡泊芬(4.0 mg/kg,BID)和法莫替丁(0.6 mg/kg,BID),疗程分别为14天、7天和7天。要求犬饭后使用0.12%洗必泰冲洗口腔。
手术三周后,该犬被送回医院进行皮肤缝线拆除。该犬食欲良好,但饮水困难,表现出舌头前伸和流口水,下颌轻微偏移。
术后五个月,该犬饮食习惯正常,皮瓣部位愈合良好,毛发已长出(下图AB)。
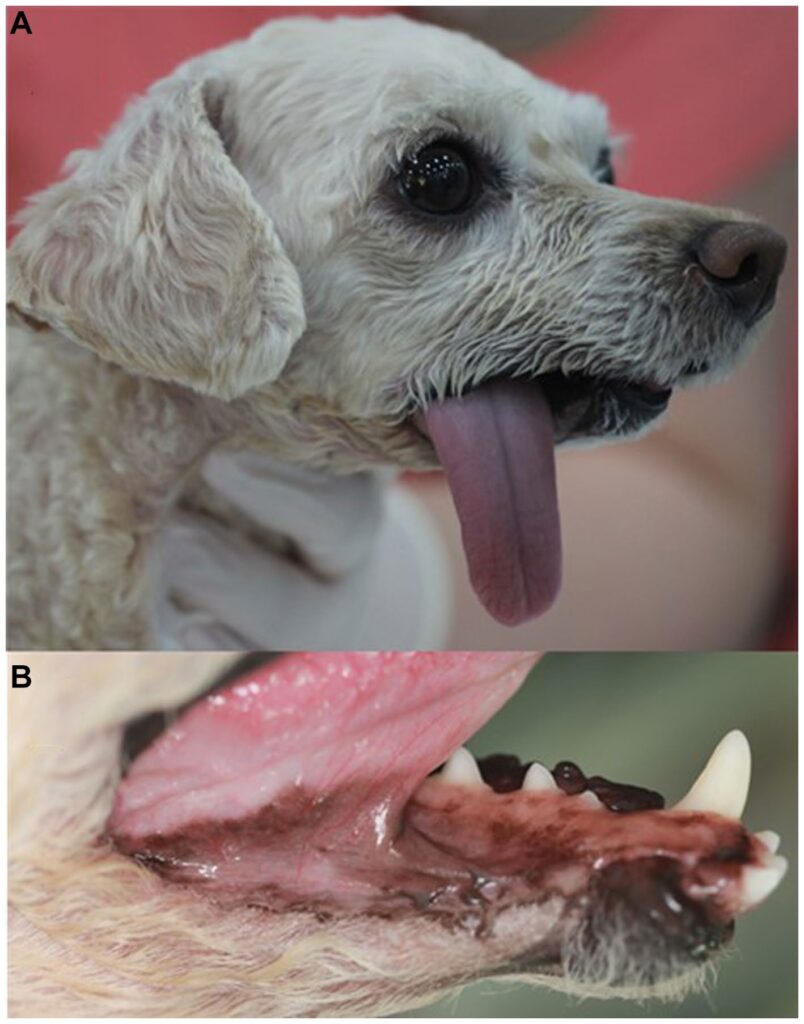
术后一年的随访中,除了舌头突出和流口水并伴有轻微的下颌漂移外,没有观察到其他症状。
主人希望尽量减少舌头前伸和流口水。然而,该犬的血液和血清生化指标均在参考范围内,胸片也未发现任何提示转移的异常情况。两周后,在主人同意的情况下,该犬在全麻下进行了联合部缝合术。主人报告说,术后舌头突出和流口水的情况明显减少,表明患者的生活质量有所提高。
05 讨论
口腔肿瘤在犬猫中比较常见,会引起疼痛、不适和不愿进食等临床症状[1-3]。这些肿瘤可以自发形成,而慢性刺激或持续的抗原刺激可能与转为恶性有关[1]。在口腔肿瘤中,牙源性肿瘤在犬中可能罕见也可能常见,具体取决于组织学类型[4]。一份报告指出,犬牙源性口腔肿瘤的发病率为18%(250/1390),其中牙源性纤维瘤最为常见[5]。
牙源性鬼影细胞癌(Ghost cell odontogenic carcinoma,GCOC)是一种恶性牙源性上皮肿瘤,以鬼影细胞的异常角化和不同数量的牙本质沉积为特征[6,7]。GCOC可由新生的钙化性牙源性囊肿(COC)或牙本质源性鬼影细胞瘤(DGCT)演变而来[8-10]。COC是由釉母细胞瘤样上皮内衬的单纯囊肿,内含灶性聚集的鬼影细胞,而DGCT则是良性的牙源性上皮肿瘤[6]。
颌骨中伴有明显鬼影细胞的牙源性病变范围广泛,包括囊性病变、良性和恶性肿瘤等。根据第五版WHO头颈部肿瘤分类,GCOC属于恶性牙源性肿瘤,DGCT属于良性牙源性肿瘤,COC属于牙源性发育囊肿[11]。
GCOC在人类中是极其罕见的上皮性牙源性肿瘤[8,12,13],以前从未在伴侣动物中报道过。只有一项研究报道了在一只狗和三只猫身上发生的COC[14]。与COC和DGCT相比,GCOC 表现出高级别恶性细胞特征,伴有坏死和组织学侵袭[9]。GCOC具有侵袭性和破坏性,复发率高,可发生远处转移,临床表现为缓慢至快速生长、下颌肿胀、疼痛、牙齿松动或移位[9,15]。
在人类医学中,GCOC被认为是由CTNNB1基因突变引起的,该基因编码beta-catenin,与鬼影细胞的形成有关[15]。由于GCOC具有破坏性,其标准治疗方法是进行安全边缘的广泛手术切除[15]。
GCOC 的其他治疗方案包括保守手术、放疗或化疗[9,10]。放疗或化疗对GCOC的影响仍不确定,因为这种肿瘤非常罕见,在口腔所有牙源性肿瘤中的发病率仅为0.37%[16]。
由于GCOC的侵袭性和恶性程度较高,建议对其采取积极的手术治疗,以减少局部复发或远处转移的可能性[15]。下颌骨切除术有多种手术方法[20]。本病例采用的是下颌骨全切除术,而非下颌骨次全切除术。
当口腔恶性肿瘤侵犯下颌骨管时,通常需要进行全下颌骨切除术[20,21]。在本病例中,该犬出现了广泛的破坏性骨病变,包括钙化和骨溶解,并侵犯了下颌管,CT显示从右下颌犬齿到第一磨牙的关节间骨都有侵犯。因此进行了单侧全下颌骨切除术和皮瓣手术,手术范围很广。
此外,在单侧下颌骨全切除术和皮肤切除术后,还进行了皮瓣重建术,以解决暴露口腔的大面积缺损问题。根据兽医文献,局部轴向模式皮瓣,如尾耳皮瓣、颞浅皮瓣或面部(口角)肌皮轴向模式皮瓣可用于重建面部大面积缺损[22]。
在该病例中,使用面部(口角)肌皮瓣转位重建缺损,取得了令人满意的效果,且无任何相关副作用。如前所述[22],在进行面部皮瓣手术时,必须全面了解整个头颈部的解剖结构,同时保留面部动脉(口角动脉和唇上动脉)的分支。在该病例中,为保留功能进行了皮瓣手术,并取得了良好的效果。
犬下颌骨全切除术可导致各种并发症,包括唾液分泌过多、进食和饮水困难、伤口裂开和下颌骨漂移[23]。在人类中,4%的GCOC患者会出现皮瓣完全脱落,并伴有严重的皮瓣并发症以及静脉和动脉血栓形成[24]。在本病例中,狗在单侧全下颌骨切除和皮瓣手术后出现了并发症,包括舌前突、流口水和轻微的下颌漂移。该犬在联合部缝合术后,舌前伸和流口水现象明显减少。
根据之前的一份报告[8],GCOC的特征是不明确的放射性透明病变或包含放射性透明和不透明成分的混合病变,其中不透明是由牙本质形成或鬼影细胞矿化造成的。在GCOC成像中通常会观察到骨质破坏、邻近组织浸润和牙根移位[10]。
本病例中的狗也有类似的发现,放射学检查显示有放射性病变、破坏性骨病变和牙根移位,组织病理学检查显示有少量牙本质形成。然而,仅靠放射学检查并不能明确排除其他良性和恶性骨肿瘤[25]。
在该病例中,口腔内放射线检查和CT显示了不明确的骨溶解和钙化,并伴有牙齿移位。与口内X光片相比,CT能更清晰地显示肿瘤是否已侵入下颌管。与COC和DGCT相比,GCOC 的复发率更高(约为63%),而且会转移到远处的部位,如人类的肺、颅骨和大脑[9,26]。然而本病例在手术切除后的1年随访期内健康状况良好,没有任何转移迹象。
总之,这是第一份描述了犬GCOC的临床特征和诊断的报告,手术治疗获得了良好的效果。本报告强调了通过放射学和组织学评估进行准确诊断以区分GCOC和其他口腔肿瘤的重要性。然而,由于单个病例的局限性,有必要进一步开展大规模的长期研究,以便评估犬GCOC的临床、放射学和组织学特征、确定最佳治疗方法、预测长期预后。
参考文献
[1] Mikiewicz M, Paździor-Czapula K, Gesek M, Lemishevskyi V, Otrocka-Domagała I. Canine and feline oral cavity tumours and tumour-like lesions: a retrospective study of 486 cases (2015–2017). J Comp Pathol. (2019) 172:80–7.
[2] Niemiec BA. Oral pathology. Top Companion Anim Med. (2008) 23:59–71.
[3] Nel S, Heerden MV, Steenkamp G, Heerden WV, Boy SC. Immunohistochemical profile of odontogenic epithelium in developing dog teeth (Canis familiaris). Vet Pathol. (2011) 48:276–82.
[4] Amory JT, Reetz JA, Sánchez MD, Bradley CW, Lewis JR, Reiter AM, et al.. Computed tomographic characteristics of odontogenic neoplasms in dogs. Vet Radiol Ultrasound. (2014) 55:147–58.
[5] Boehm B, Breuer W, Hermanns W. Odontogenic tumours in the dog and cat. Tierarztliche Praxis Ausgabe K, Kleintiere/heimtiere. (2011) 39:305–12.
[6] El-Naggar AK, Chan JKC, Grandis JR, Takata T, Slootweg PJ. WHO classification of head and neck tumours. Lyon, France: IARC; (2017).
[7] Martos-Fernández M, Alberola-Ferranti M, Hueto-Madrid JA, Bescós-Atín C. Ghost cell odontogenic carcinoma: a rare case report and review of literature. J Clin Exp Dent. (2014) 6:e602:–e606.
[8] Ledesma-Montes C, Gorlin RJ, Shear M, Prae Torius F, Mosqueda-Taylor A, Altini M. International collaborative study on ghost cell odontogenic tumours: calcifying cystic odontogenic tumour, dentinogenic ghost cell tumour and ghost cell odontogenic carcinoma. J Oral Pathol Med. (2008) 37:302–8.
[9] Ghita I, Nagai MY, Lubek JE, Stashek KM, Basile JR, Price JB, et al.. Ghost cell odontogenic carcinoma arising in a previous calcifying odontogenic cyst: a case report and review of literature. Head Neck Pathol. (2022) 16:828–35.
[10] Jia M-Q, Jia J, Wang L, Zou H-X. Ghost cell odontogenic carcinoma of the jaws: report of two cases and a literature review. World J Clin Cases. (2019) 7:357–65.
[11] Vered M, Wright JM. Update from the 5th edition of the World Health Organization classification of head and neck tumors: odontogenic and maxillofacial bone tumours. Head Neck Pathol. (2022) 16:63–75.
[12] Ali EAM, Karrar MA, El-Siddig AA, Gafer N, Satir AA. Ghost cell odontogenic carcinoma of the maxilla: a case report with a literature review. Pan Afr Med J. (2015) 21:260.
[13] Lee SK, Kim YS. Current concepts and occurrence of epithelial odontogenic tumors: II. Calcifying epithelial odontogenic tumor versus ghost cell odontogenic tumors derived from calcifying odontogenic cyst. Korean J Pathol. (2014) 48:175–87.
[14] Babbitt SG, Bell CM, Raleigh M, Haggerty K, Feigin K. Cystic odontogenic tumor with features of calcifying odontogenic cyst in 3 cats and a dog. J Vet Dent. (2022) 39:194–202.
[15] de Souza VG, de Pinho MP, Rozza-de-Menezes RE, Cunha KSG, Conde DC. Comparative analysis between dentinogenic ghost cell tumor and ghost cell odontogenic carcinoma: a systematic review. Head Neck Pathol. (2021) 15:1265–83.
[16] Panprasit W, Lappanakokiat N, Kunmongkolwut S, Phattarataratip E, Rochchanavibhata S, Sinpitaksakul P, et al.. Ghost cell odontogenic carcinoma: A case report. Imaging Sci Dent. (2021) 51:203–8.
[17] Park SY, Park J, Ho Jeon J, Kim SM, Myoung H, Lee JH. Ghost cell odontogenic carcinoma on right mandible and its respective surgical reconstruction: a case report. J Korean Assoc Oral Maxillofac Surg. (2017) 43:415.
[18] Qin Y, Lu Y, Zheng L, Liu H. Ghost cell odontogenic carcinoma with suspected cholesterol granuloma of the maxillary sinus in a patient treated with combined modality therapy: a case report and the review of literature. Medicine. (2018) 97:e9816.
[19] Bose P, Pleasance ED, Jones M, Shen Y, Ch’ng C, Reisle C. Integrative genomic analysis of ghost cell odontogenic carcinoma. Oral Oncol. (2015) 51:e71–5.
[20] Verstraete F, Arzi B, Lantz G. Mandibulectomy techniques In: Oral and maxillofacial surgery in dogs and cats. 2nd ed. Louis, MO: Elsevier; (2020). 515–28.
[21] Zacher AM, Marretta SM. Oral and maxillofacial surgery in dogs and cats. Vet Clin North Am Small Anim Pract. (2013) 43:609–49.
[22] Guzu M, Rossetti D, Hennet PR. Locoregional flap reconstruction following oromaxillofacial oncologic surgery in dogs and cats: a review and decisional algorithm. Front Vet Sci. (2021) 8:685036.
[23] Furman R. Total Mandibulectomy in the dog. J Vet Dent. (2014) 31:289–93.
[24] Bianchi B, Copelli C, Ferrari S, Ferri A, Sesenna E. Free flaps: outcomes and complications in head and neck reconstructions. J Cranio-Maxillofac Surg. (2009) 37:438–42.
[25] Vijayakumar G, Kamboj M, Narwal A, Devi A. Ghost cell odontogenic carcinoma of anterior mandible: a rare case report with review of literature. J Oral Maxillofac Pathol. (2021) 25:S99–S108.
[26] Sukumaran R, Somanathan T, Kattoor J. Odontogenic ghost cell carcinoma with pulmonary metastasis. J Oral Maxillofac Pathol. (2015) 19:371–4.