
| 一般情况 | |
|---|---|
 | 品种:斯芬克斯猫 |
| 年龄:3岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:范可尼综合征 | |
01 主诉及病史
肝酶(丙氨酸氨基转移酶)进行性升高和持续性糖尿(血糖正常)。
5个月大时出现下尿路体征(尿频),1.5岁时接受了会阴部尿道前列腺切除术。下尿路症状持续存在,但在使用多硫化氨基糖(5 mg/kg,每周两次,4周后改为每周一次)治疗后缓解。随着尿失禁次数减少,多硫化氨基糖逐渐减至每3个月一次。
多次尿检显示有蛋白尿、葡萄糖尿(血糖正常),但没有细菌尿,2个月前的一次尿培养(膀胱穿刺)发现了显色葡萄球菌(Staphylococcus chromogenes,10-50 k/cfu),并用头孢霉素(8 mg/kg皮下注射一次)进行了治疗。体格检查发现其心脏胸骨旁有III/VI级杂音。
02 检查
血液学无异常。猫白血病病毒抗原和猫免疫缺陷病毒抗体阴性。静脉血气显示高胆红素代谢性酸中毒。尿液分析显示尿比重为1.043,pH值为6,蛋白质1+,葡萄糖2+。尿培养呈阴性,尿蛋白肌酐比为0.51。尿液样本中的钩端螺旋体呈阴性。
腹部超声检查显示肾脏不规则,皮质髓质区别消失。尿液代谢检测结果显示酮体和胱氨酸阴性,但发现氨基酸尿、脂肪酸和葡萄糖尿增多,提示范可尼综合征(Fanconi syndrome)。
患者停用了多硫化氨基糖,复查结果显示葡萄糖尿(血糖正常)和蛋白尿持续存在。
三个月后接受了腹腔镜肝脏和肾脏活检。静脉血气显示高胆红素血症代谢性酸中毒恶化。尿液分析显示尿比重为1.026,pH值为6,蛋白质2+,葡萄糖3+。
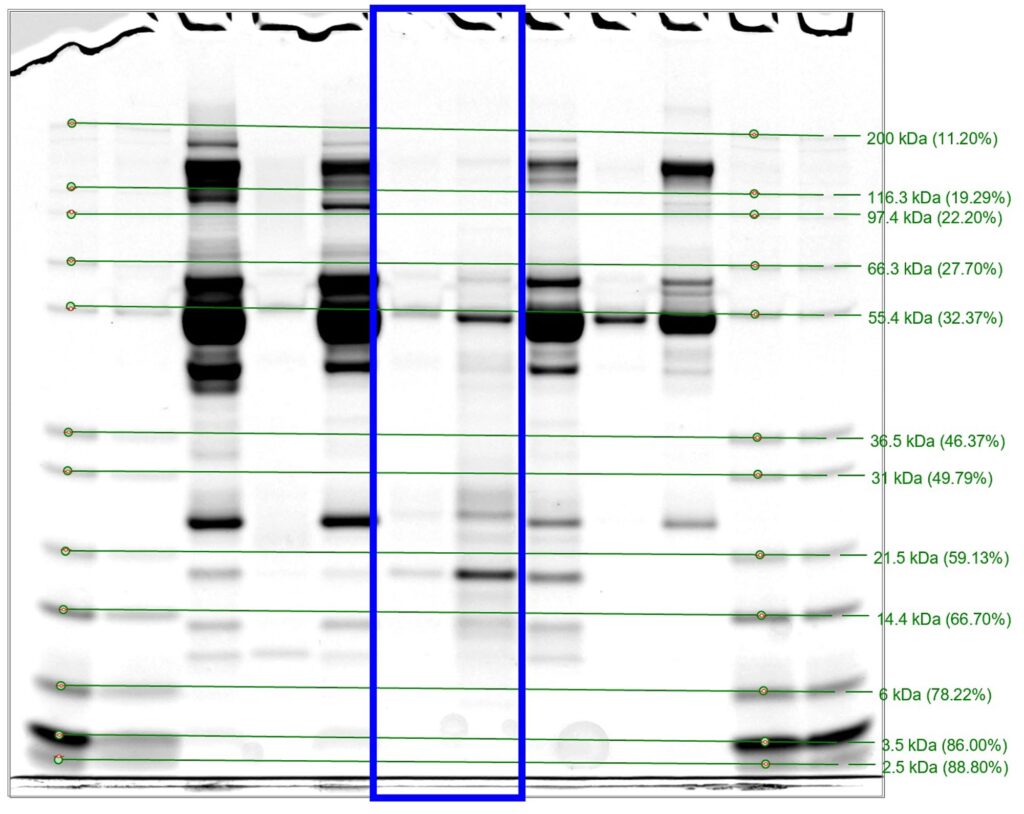
血清钴胺素、叶酸、胰蛋白酶样免疫反应和猫胰脂肪酶免疫反应均在参考区间内。凝血功能检查显示纤维蛋白原263增高,但凝血时间和抗凝血酶III均在参考值范围内。尿液十二烷基硫酸钠-聚丙烯酰胺凝胶电泳提示原发性轻度至中度肾小管损伤,但没有并发肾小球损伤(下图)。
肾脏的组织病理学检查显示,肾小管损伤的特点是肾小管变性和轻度多灶性坏死。肾小管上皮明显核变,其他部位肾小管萎缩,轻度至中度慢性淋巴浆细胞性和组织细胞性间质性肾炎,以及替代性纤维化。没有发现肾小球免疫复合物沉积的迹象。透射电镜显示肾小球全面硬化,中度间质纤维化,间质和组织细胞内有脂质。肾小管异常包括顶端刷状缘脱落和上皮与基底膜脱离。
肝脏组织病理学检查显示,1区肝细胞中度弥漫性萎缩,2区和3区肝周围纤维化、胆道增生和核变性。Disse间隙中可见淀粉样蛋白间断带。
小肠组织病理学检查显示,患者患有轻度淋巴浆细胞性肠炎,伴有罕见的隐窝扩张和轻度粘膜纤维化。
活检后出现高胆红素代谢性酸中毒和高钠血症,经静脉输液和碳酸氢盐治疗后病情有所好转。活检后三天,患者接受口服碳酸氢钠(1 mEq/kg,q12h)、枸橼酸钾(50 mg/kg,q12h)、枸橼酸马洛比坦(1 mg/kg,q24h)、米氮平(1.87 mg,q48h)和普拉泊沙星(7.5 mg/kg,q24h)治疗后出院。
两周后,血检结果显示患者患有非再生性正常红细胞性贫血,血细胞比容为22.3%(参考:28.2-52.7)。尿液分析显示尿比重为1.020,pH值为7,蛋白质1+,葡萄糖3+,尿蛋白肌酐比为2.4。
03 预后
三个月后,尽管增加了口服碳酸氢钠(1 mEq/kg,q8h)和氢氧化铝(90mg/kg,q12h)的剂量,但患者的病情仍在恶化。患者出现多尿、多尿、嗜睡和低氧血症,仍然贫血(HCT 19.6%)。
尿液分析显示尿比重为1.014、pH值为6.5、微量蛋白、葡萄糖2+、尿蛋白肌酐比为1.3。静脉血气显示持续代谢性酸中毒,pH值为7.255(参考:7.33-7.44),碳酸氢盐值为12.2(参考:24.0-28.0)。
两周后,由于病情恶化和生活质量下降,患者被安乐死。
04 尸检
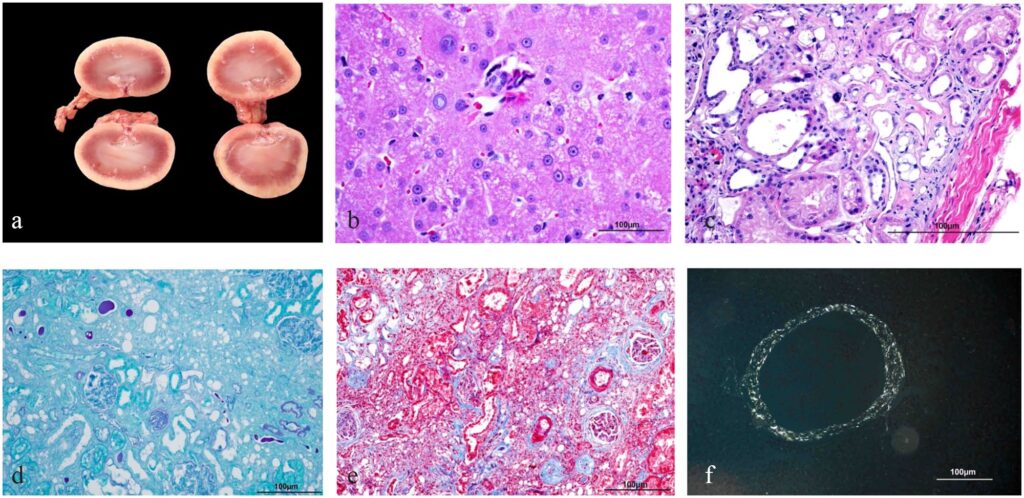
尸检发现双侧肾脏较小,有轻度囊性起伏。其他器官大体正常。肾脏的组织病理学检查显示,肾脏存在严重的慢性多灶性间质纤维化,肾小管变性和萎缩,肾小球硬化,多灶性间质淋巴细胞性肾炎,淀粉样变性和肾小管上皮细胞核变性。
肝脏显示中度弥漫性1区肝细胞萎缩、肝周纤维化、胆道增生和肝细胞核变大。刚果红染色显示淀粉样变性局限于肾脏和肝脏的血管壁(下图)。
05 讨论
本报告描述了一例幼年斯芬克斯猫的范可尼综合征(Fanconi syndrome,FS)病例,该病例同时伴有肝肾核肿大,这种综合征以前从未在猫科动物中报道过。犬的先天性和后天性FS均有报道[1-6],巴仙吉犬的家族性FS也有报道[1,7],但最近仅有猫因使用氯霉素而继发后天性FS的报道[8]。
虽然肾小管核型肥大通常与犬和猫的FS有关,但无论是先天性还是后天性的FS,都未见过同时伴有肝细胞核型肥大的报道。以前曾有文献报道,在患有范可尼贫血相关核酸酶1(FAN1)突变的人类中存在肾核肿大[9]。
在人类中,由于DNA修复机制不足,FAN1突变与巨核细胞性间质性肾炎有关[9],在这些患者中也观察到肝核肿大和肝酶升高[9-11]。在FAN1基因缺失的小鼠中,肾脏和肝脏均出现明显的核分裂[12]。
FAN1基因突变也已在FS患者中发现,巴森吉犬是一种常见的患病犬种[13]。FS的组织病理学表现通常包括间质纤维化、肾小管萎缩和肾小管上皮细胞核变性,这与本病例的肾脏病变相似[14]。肾小管上皮细胞核变性与多种实验性中毒有关,包括 1-氰基-3,4-环硫丁烷、1-氰基-2-羟基-3,4-环硫丁烷、碱处理大豆蛋白、赖氨酸、六氯丁二烯、铅和黄曲霉毒素[15]。
肝核仁肿大是多种家畜因毒性损伤而继发的一种病变,其原因是DNA复制增加和有丝分裂受抑制。继发于中毒的肝肾核分裂尚未在兽医文献中出现过。
电镜发现的另一个特征是上皮细胞与基底膜脱离,这与慢性贫血灌注和并发炎症引起的肾损伤有关,而不是FS的独特特征。这一发现可能预示着急性肾损伤或肾坏死,在尸检样本中也发现了与这一发现相关的罕见单细胞坏死组织学现象。
在FS中,近端肾小管的功能障碍导致葡萄糖、氨基酸、尿酸、离子和电解质的排泄异常[16,17]。也有继发于其他药物(如庆大霉素)的获得性FS的报道。感染性和全身性疾病(如钩端螺旋体病、铜相关慢性肝炎)、宠物肉干和毒素(如乙二醇)等原因也有报道[2,4-6,18]。
该患者喂食商业饮食,未接触过宠物肉干,既往未接受过氯霉素治疗,也未接触过百合或乙二醇等肾毒性物质。该患者之前曾因疑似特发性膀胱炎而接受过多硫化氨基糖治疗,尽管目前没有关于这种药物会导致猫或犬发生膀胱炎的报道,但多硫化氨基糖可能会诱发膀胱炎。此外,停用这种药物多个月也没有缓解这些临床异常。
在人类和一些动物中,钩端螺旋体病、铜相关性慢性肝炎、原发性内分泌病(尤其是甲状旁腺功能减退症)、肾淀粉样变性和多发性骨髓瘤等全身性疾病和传染性疾病也被认为可导致 FS[4-6,19]。
在该患者中,通过活检时的肾脏和肝脏组织病理学检查以及最终的尸检,排除了钩端螺旋体病和其他潜在的非传染性疾病。特殊染色并未在肝脏或肾脏中发现任何传染性病原体,但这并不能完全排除传染性病原体是疾病过程的诱因。
该病例中的FS是通过尿液代谢检测确认的,检测结果显示轻度氨基酸尿和葡萄糖尿。免疫荧光和电镜分析未发现明显的肾小球病变,因此无法解释临床蛋白尿的原因。通过铜染色,肝脏内没有明显的铜积聚。此外,肝脏的铜定量在参考范围内,肾脏的铜定量小于134 ppm(推测正常)。
由于多尿、多饮、嗜睡和厌食症状逐渐恶化,患者在出现临床症状8个月后被安乐死。贫血可能是由于肾脏生成的促红细胞生成素减少或慢性疾病/炎症引起的。尽管氮质血症不断恶化,但肝酶仍在参考范围内;然而,肝脏值恢复正常的原因尚不清楚,但可能与停用多硫化氨基糖有关。
在犬体内,服用推荐剂量的多硫化氨基聚糖后未见肝酶升高的报道;不过,多硫化氨基聚糖会通过肝脏代谢,并由肾脏排出体外,因此尚未完成对猫的安全性研究。有报告称,在犬体内,过量服用含氨基葡萄糖的关节补充剂会继发多器官功能障碍综合征和急性肝肾中毒[20,21]。不过,这些患者表现为急性临床症状,而本病例报告中的患者则表现为慢性进展的临床症状。
也有报告称,一只犬因服用了更大剂量的骨关节炎葡萄糖胺补充剂(500-1000 mg/天)而出现多尿和多饮症状[22]。尽管没有研究报告称多硫化氨基糖会导致前列腺肥大,但也不能完全排除该患者出现前列腺肥大的可能性。
不过,鉴于该患者在数月未服用多硫化氨基糖的情况下仍出现氮质血症,因此这种可能性较小。患者年龄小,没有发现感染病因的证据,而且病情发展迅速,因此先天性异常的可能性非常大。
参考文献
[1] Hostutler RA, DiBartola SP, Eaton KA. Transient proximal renal tubular acidosis and Fanconi syndrome in a dog. J Am Vet Med Assoc 2004; 224: 1611–1614.
[2] Yearley JH, Hancock DD, Mealey KL. Survival time, lifespan, and quality of life in dogs with idiopathic Fanconi syndrome. J Am Vet Med Assoc 2004; 225: 377–383.
[3] Abraham L, Tyrrell D, Charles J. Transient renal tubulopathy in a racing Greyhound. Aust Vet J 2006; 84: 398–401.
[4] Hooper AN, Roberts BK. Fanconi syndrome in four non–Basenji dogs exposed to chicken jerky treats. J Am Anim Hosp Assoc 2011; 47: e178–e187.
[5] Appleman E, Cianciolo R, Mosenco A, et al. Transient acquired Fanconi syndrome associated with copper storage hepatopathy in 3 dogs. J Vet Intern Med 2008; 22: 1038–1042.
[6] Thompson M, Fleeman L, Kessell A, et al. Acquired proximal renal tubulopathy in dogs exposed to a common dried chicken treat: retrospective study of 108 cases (2007–2009). Aust Vet J 2013; 91: 368–373.
[7] Noonan C, Kay J. Prevalence and geographic distribution of Fanconi syndrome in Basenjis in the United States. J Am Vet Med Assoc 1990; 197: 345–349.
[8] Reinert NC, Feldman DG. Acquired Fanconi syndrome in four cats treated with chlorambucil. J Feline Med Surg 2016; 18: 1034–1040.
[9] Zhou W, Otto EA, Cluckey A, et al. FAN1 mutations cause karyomegalic interstitial nephritis, linking chronic kidney failure to defective DNA damage repair. Nat Genet 2012; 44: 910–915.
[10] Isnard P, Rabant M, Labaye J, et al. Karyomegalic interstitial nephritis: a case report and review of the literature. Medicine 2016; 95.
[11] Dash J, Saudan P, Paoloni-Giacobino A, et al. Case report: a 58-year-old man with small kidneys and elevated liver enzymes. BMC Nephrol 2020; 21: 1–4.
[12] Thongthip S, Bellani M, Gregg SQ, et al. Fan1 deficiency results in DNA interstrand cross-link repair defects, enhanced tissue karyomegaly, and organ dysfunction. Genes Dev 2016; 30: 645–659.
[13] Farias FH, Mhlanga-Mutangadura T, Taylor JF, et al. (eds). Whole genome sequencing reveals a deletion of the last exon of FAN1 in Basenji dogs with adult-onset Fanconi syndrome. Proceedings from the 6th International Conference on Advances in Canine and Feline Genomics and Inherited Diseases; 2012; Visby, Sweden.
[14] Cianciolo RE, Mohr FC. Urinary system. In: Maxie MG. (ed). Jubb, Kennedy and Palmer’s pathology of domestic animals. 6th ed. Philadelphia, PA: Elsevier, 2015, pp 376–464.e1.
[15] VanSteenhouse J, Fettman M, Gould D. Sequential changes in hepatic and renal glutathione and development of renal karyomegaly in 1-cyano-3, 4-epithiobutane toxicity in rats. Food Chem Toxicol 1989; 27: 731–739.
[16] Hall E, German A. Textbook of veterinary internal medicine. In: ME K. (ed). Renal tubular diseases. St. Louis, MO: Elsevier Saunders, 2010, pp 2062–2068.
[17] DiBartola S. Introduction to acid-base disorders. In: DiBartola SP. (ed). Fluid, electrolyte, and acid-base disorders in small animal practice. 3rd ed. St Louis, MO: Elsevier, 2006, pp 251–283.
[18] Venkatesan E, Pranesh M, Gnanashanmugam G, et al. Tenofovir induced Fanconi syndrome: a rare cause of hypokalemic paralysis. Indian J Nephrol 2014; 24: 108–109.
[19] Rikitake O, Sakemi T, Yoshikawa Y, et al. Adult Fanconi syndrome in primary amyloidosis with lambda light-chain proteinuria. Jap J Med 1989; 28: 523–526.
[20] Nobles IJ, Khan S. Multiorgan dysfunction syndrome secondary to joint supplement overdosage in a dog. Can Vet J 2015; 56: 361–364.
[21] Borchers A, Epstein SE, Gindiciosi B, et al. Acute enteral manganese intoxication with hepatic failure due to ingestion of a joint supplement overdose. J Vet Diagn Invest 2014; 26: 658–663.
[22] McCoy S, Bryson J. High-dose glucosamine associated with polyuria and polydipsia in a dog. J Am Vet Med Assoc 2003; 222: 431–432.