
| 一般情况 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:18个月 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:肾上腺皮质功能减退症 | |
01 主诉及病史
持续呕吐和食欲下降48小时。
02 检查
除了腹部膨胀外,体格检查没有其他异常。腹部X光片显示胃部有明显的线状至管状凝聚性不透明软组织。小肠和结肠内未发现异物。全血细胞计数和血清生化指标均无异常。钠钾比值为41。
03 治疗
乳酸林格氏液(80 ml/kg/天)和马洛比坦(1 mg/kg,q24h)静脉注射。
第二天接受内窥镜胃异物切除术。从胃中取出了几条布条。手术过程中收缩压正常。当晚出院了,没有服用任何药物。
04 复查
两周后因食欲不振、吞咽困难和反胃再次就诊。主人说猫在内窥镜检查后的头几天表现良好,但食欲持续下降,现在已经厌食。
检查发现心动过速(220次/分),间歇性地表现出夸张的吞咽动作。估计脱水率为5%,粘膜呈淡粉色,粘稠度较高。腹部触诊正常。腹部放射线检查无异常。
血液检测发现低钠血症(137.1 mmol/L,范围:146.2-156.2)、高钾血症(5.32 mmol/L,范围:3.41-4.71)、高钙血症(1.76 mmol/L,范围:1.16-1.35)和轻度氮质血症(血肌酐2.22 mg/dL,范围:0.70-1.90,BUN为51 mg/dL,范围:22-33)。钠钾比值为26。血液浓缩,充盈细胞体积为55%,总蛋白9.0 g/dL。尿比重1.038,蛋白尿1+。补液观察。
第二天心动过速症状有所缓解(160次/分)。出现间歇性肌肉痉挛和双侧眼球震颤。收缩压120 mmHg。重新检测发现高钙血症(1.97 mmol/L)。血清钠仍然很低(141 mmol/L),血清钾正常偏高(4.71 mmol/L)。氮质血症已缓解。全血细胞计数正常。
血生化显示高钙血症(总钙14.6 mg/dL)、低胆固醇血症(49 mg/dL,范围:91-305)和血清白蛋白偏低(2.8 g/dL,范围:2.6-3.9)。由于进行性高钙血症,乳酸林格氏液改为0.9%氯化钠。
腹部超声发现肾上腺呈低回声,双侧肾上腺中度至明显肿大,每个厚度达1 cm(下图)。超声引导下对肾上腺进行细针穿刺。术后进行了促肾上腺皮质激素(ACTH)刺激试验。静脉注射地塞米松(0.2 mg/kg,q24h)。泮托拉唑和马洛比坦继续使用。
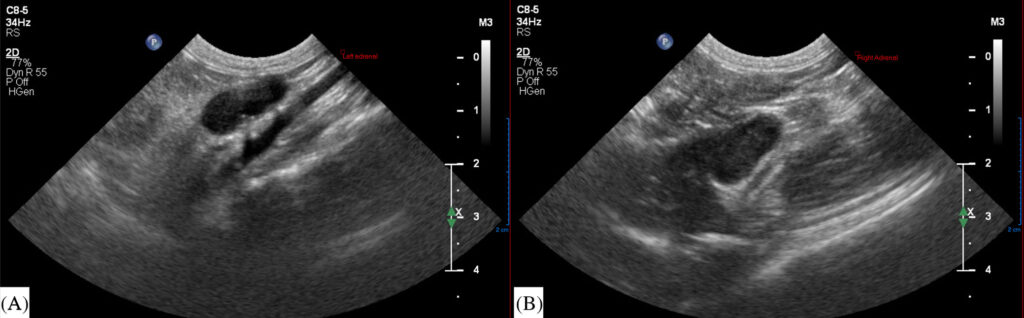
穿刺术后第二天恢复精神,并开始进食。肌肉痉挛和双侧瞳孔散大的症状已缓解。高钙血症明显改善,为1.39 mmol/L。钠钾比值为36,血清钠154.3 mmol/L,血清钾4.20 mmol/L。
ACTH刺激试验证实了肾上腺皮质功能减退(前皮质醇浓度<0.2 mg/dL,后皮质醇浓度<0.2 mg/dL)。肾上腺细胞学检查显示肾上腺坏死,并伴有中性粒细胞和巨噬细胞炎症(下图)。未发现肿瘤迹象。
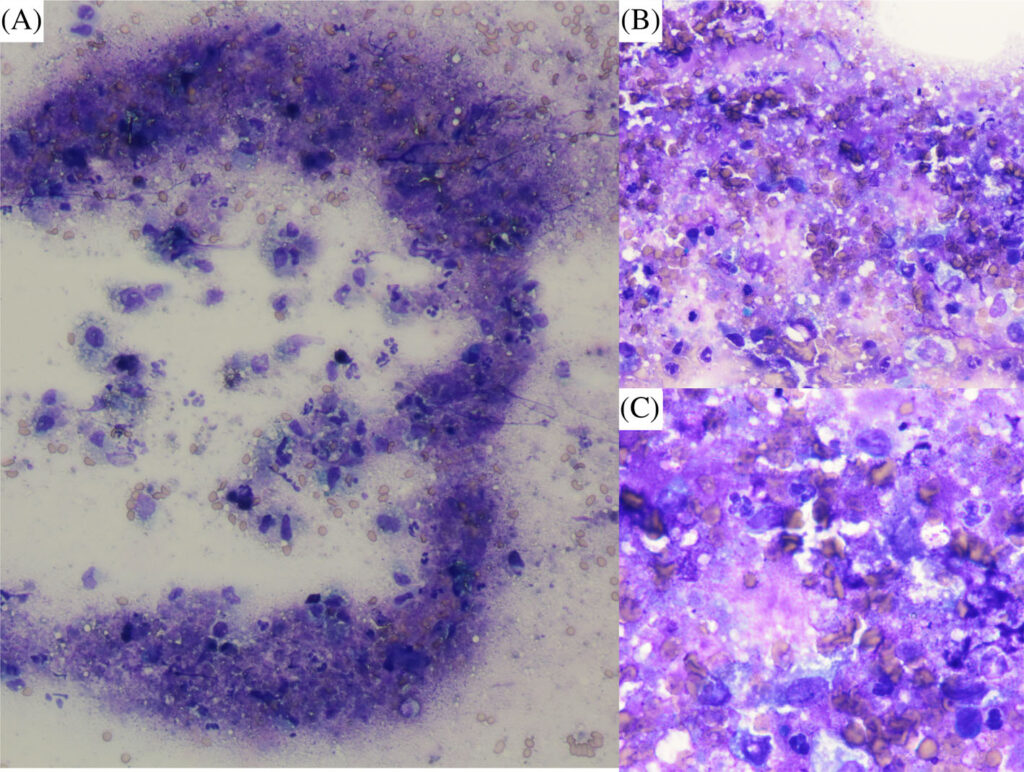
05 预后
出院前开始服用泼尼松龙(0.5 mg/kg,q24h)和特戊酸去氧皮质酮肌注(DOCP,2.2 mg/kg)。
回家5天后,泼尼松龙降至0.25 mg/kg,并在紧张时剂量加倍。
在接受第一剂DOCP 14天后复诊。猫几乎完全恢复正常。血清电解质浓度稳定(离子钙1.37 mmol/L,血清钾4.97 mmol/L,血清钠151.3 mmol/L,钠钾比值为30)。
接下来的6个月中,由于注射当天钠钾比值持续偏低,且主人报告前几天一直昏昏欲睡,因此DOCP的注射间隔从30天缩短到22天。
指导主人每21-24天在家注射一次DOCP。泼尼松龙用量为0.25 mg/kg,每天一次。确诊14个月后,猫在这种治疗方案下表现良好。
06 讨论
肾上腺皮质功能减退症是指肾上腺分泌的激素不足。没有这些激素,尤其是皮质类固醇和矿物质皮质激素,机体就无法对增加的生理压力做出适当反应或调节血清电解质浓度。猫肾上腺皮质功能减退症并不常见,文献中描述的病例约有40例[1-17]。
犬肾上腺皮质功能减退症的病因被认为是免疫介导的淋巴浆细胞炎症和肾上腺皮质萎缩。在2只患有原发性肾上腺皮质功能减退症的狗体内检测到了肾上腺细胞抗原抗体[18,19]。
猫肾上腺皮质功能减退症的病因仍不清楚。有报道称,在猫中有两例由外伤引起的肾上腺皮质功能减退症和三例由原发性肾上腺淋巴瘤引起的肾上腺皮质功能减退症[2,5,6,16]。
有关原发性肾上腺皮质功能减退症猫肾上腺超声的数据有限。在少数有超声记录的病例中,肾上腺大小正常,只有一例报告中无法识别右侧肾上腺[8,14,15,17]。以前只有在原发性肾上腺淋巴瘤的情况下,猫才会出现肾上腺功能不全和肾上腺肿大[2,16]。
在一项针对33只肾上腺炎犬的研究中发现,17只犬的炎症为淋巴浆细胞性,1只犬为淋巴组织细胞性,4只犬为淋巴细胞性,3只犬为肉芽肿性,8只犬为中性粒细胞性。肾上腺皮质萎缩主要与淋巴浆细胞性炎症有关,而非淋巴细胞性炎症[19]。炎症性肾上腺疾病以前从未在猫身上报道过。
有一则病例报告称,一只狗患有双侧肾上腺肿大和肾上腺皮质坏死,肾上腺细胞学检查显示中性粒细胞炎症。该犬在通过促肾上腺皮质激素(ACTH)刺激试验被诊断为肾上腺皮质功能亢进症12天后进行了ACTH刺激试验,证实其肾上腺皮质功能减退。治疗还没有开始,该犬在确诊10个月后突然死亡,尸体解剖时发现了垂体嗜铬细胞瘤,肾上腺很小且已纤维化[20]。
曾有报道称,人在生理压力增加时(以ACTH释放增加和皮质醇分泌过多为特征),如近期手术、低血压和败血症时,会因急性肾上腺出血和随后的坏死而导致肾上腺功能不全。这种现象尚未在小动物中进行过评估。
除了麻醉和短暂住院治疗外,本病例未发现其他危险因素[20-23]。该猫之前身体健康,在被诊断出肾上腺皮质功能减退症前两周接受了麻醉。临床或麻醉前实验室检查均未发现败血症迹象。没有使用抗凝血剂。在短暂的麻醉过程中,血压始终保持正常。
另一例报告的急性嗜中性粒细胞肾上腺炎和坏死病例发生在一只患有功能性垂体瘤的狗身上,当时正在进行ACTH刺激试验以诊断肾上腺皮质功能亢进[24]。对大鼠进行的一项研究得出结论,给予大剂量的ACTH(60 μg)会导致肾上腺出血、凋亡和空泡化[25]。
在本病例中,麻醉事件与肾上腺皮质功能减退症诊断之间的时间很接近,这就提出了一个问题:麻醉是否会导致肾上腺坏死?这种情况表明该猫的内源性ACTH浓度在某一时刻非常高,而在麻醉时没有测量内源性ACTH浓度的情况下,无法对其进行评估。
虽然使用依托咪酯诱导麻醉与猫体内皮质醇合成的短暂减少有关,但本麻醉方案中并未使用依托咪酯[26]。这只猫在麻醉过程中使用的氯胺酮已被证实可短暂抑制胎儿绵羊体内促肾上腺皮质激素的释放,但这种作用在猫体内尚未被证实[27,28]。
这只猫肾上腺疾病的根本原因尚不清楚。可能是摄入了一种未知的毒素,或者是胃内的布条释放出毒素,导致了肾上腺出血和坏死。对干扰内分泌的化学物质的最新研究表明,这些物质可能与肾上腺疾病有关[29]。
参考文献
[1] Hess RS. Hypoadenrocorticism. In: SJ Ettinger, EC Feldman, E Cote, eds. Textbook of Veterinary Internal Medicine: Diseases of the Dog and the Cat. 8th ed. Elsevier, St. Louis, Missouri; 2017: 435.
[2] Parnell NK, Powell LL, Hohenhaus AE, Patnaik AK, Peterson ME. Hypoadrenocorticism as the primary manifestation of lymphoma in two cats. J Am Vet Med Assoc. 1999; 214: 1208-1211.
[3] Feldman EC, Nelson RW. Hypoadrenocorticism (Addison’s disease). In: EC Feldman, W Nelson, eds. Canine and Feline Endocrinology and Reproduction. 3rd ed. Philadelphia: Saunders; 2004: 394-439.
[4] Peterson ME, Greco DS, Orth DN. Primary hypoadrenocorticism in ten cats. J Vet Intern Med. 1989; 3: 55-58.
[5] Brain PH. Trauma-induced hypoadrenocorticism in a cat. Aust Vet Pract. 1997; 27: 178-181.
[6] Berger SL, Reed JR. Traumatically induced hypoadrenocorticism in a cat. J Am Anim Hosp Assoc. 1993; 29(337–339): 7.
[7] Tasker S, MacKay AD, Sparkes AH. A case of feline primary hypoadrenocorticism. J Feline Med Surg. 1999; 1: 257-260.
[8] Kasabalis D, Bodina E, Saridomichelakis MN. Severe hypoglycemia in a cat with primary hypoadrenocorticism. J Feline Med Surg. 2012; 14: 755-758.
[9] Hock CE. Atypical hypoadrenocorticism in a Birman cat. Can Vet J. 2011; 52: 893-896.
[10] Behrend EN, Kemppainen RJ. Adrenocortical disease. In: JR August, ed. Consultations in Feline Internal Medicine. 4th ed. Philadelphia: Saunders; 2001: 159-168.
[11] Mooney C. Unusual endocrine disorders in the cat. In Pract. 1998; 20: 345-349.
[12] Stonehewer J, Tasker S. Hypoadrenocorticism in a cat. J Small Anim Pract. 2001; 42: 186-189.
[13] Giudice E, Macrì F, Crinò C, Viganò F, Di Pietro S. Hypoadrenocorticism in a young dwarf cat-case report. Veterinarski Arhiv. 2016; 86: 591-600.
[14] Sicken J, Reto N. Addisonian crisis and severe acidosis in a cat: a case of feline hypoadrenocorticism. J Feline Med Surg. 2013; 15: 941-944.
[15] Woolcock AD, Ward C. Successful treatment of a cat with primary hypoadrenocorticism and severe hyponatremia with desoxycorticosterone pivalate (DOCP). Can Vet J. 2015; 56(11): 1158-1160.
[16] Romine JF, Kozicki AR, Elie MS. Primary adrenal lymphoma causing hypoaldosteronism in a cat. JFMS Open Rep. 2016; 2(2):2055116916684409.
[17] Fowlie SJ, McKenzie J, Ramsey I. Hypoadrenocorticism in an aged cat. Vet Rec Case Rep. 2018; 6: 1-4.
[18] Schaer M, Riley WJ, Buergelt CD, et al. Autoimmunity and Addison’s disease in the dog. J Am Anim Hosp Assoc. 1986; 22: 789-794.
[19] Frank CB, Valentin SY, Scott-Moncrieff JCR, Miller MA. Correlation of inflammation with adrenocortical atrophy in canine adrenalitis. J Comp Pathol. 2013; 149: 268-279.
[20] Egan AM, Larkin JO, Ryan RS, Waldron R. Bilateral adrenal haemorrhage secondary to intra-abdominal sepsis: a case report. Cases J. 2009; 2: 6894.
[21] Gowda D, Shenoy V, Malabu U, Cameron D, Sangla K. Bilateral adrenal gland haemorrhage: an unusual cause. Endocrinol Diabetes Metabol Case Rep. 2014; 2014: 14-58.
[22] Bashari WA, Myint YMM, Win ML, Oyibo SO. Adrenal insufficiency secondary to bilateral adrenal hemorrhage: a case report. Cureus. 2020; 12(6):e8596.
[23] Shekhda KM, Chua KLA, Rathore A, Ojewuyi T. Bilateral adrenal haemorrhages presenting as adrenal insufficiency. Chonnam Med J. 2021; 57(2): 152-153.
[24] Rockwell JL, Monroe WE, Tromblee TC. Spontaneous hypoadrenocorticism in a dog after a diagnosis of hyperadrenocorticism. J Vet Intern Med. 2005; 19(2): 255-258.
[25] Burkhardt WA, Guscetti F, Boretti FS, et al. Adrenocorticotropic hormone, but not trilostane, causes severe adrenal hemorrhage, vacuolization, and apoptosis in rats. Domest Anim Endocrinol. 2011; 40(3): 155-164.
[26] Moon PF. Cortisol suppression in cats after induction of anesthesia with etomidate, compared with ketamine-diazepam combination. Am J Vet Res. 1997; 58(8): 868-871.
[27] Powers MJ, Wood CE. Ketamine inhibits fetal ACTH responses to cerebral hypoperfusion. Am J Physiol Regul Integr Comp Physiol. 2007; 292(4): R1542-R1549.
[28] Kamohara H, Kamohara T, Hikasa Y. Effects of pretreatment with medetomidine, midazolam, ketamine, and their combinations on stress-related hormonal and metabolic responses in isoflurane-anesthetized cats undergoing surgery. J Adv Vet Anim Res. 2021; 8(4): 563-575.
[29] Egalini F, Marinelli L, Rossi M, et al. Endocrine disrupting chemicals: effects on pituitary, thyroid and adrenal glands. Endocrine. 2022; 78(3): 395-405.