
| 病例1 | |
|---|---|
 | 品种:混种犬 |
| 年龄:8岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:前体靶向免疫介导性贫血 | |
01 主诉及病史
18天前因呕吐就诊,当时发现有心脏杂音和粘膜苍白,但没有进行详细检查。18天后进行了血液检查,发现严重贫血。
02 检查
直肠温度38.6°C,心率160次/分,呼吸频率40次/分。粘膜苍白,心脏杂音为收缩期杂音,Levine分级为3/6。
血液检查显示有严重贫血:血细胞比容(Ht)6.8%(37.3-61.7),血红蛋白2.2 g/dL(13.1-20.5),平均血球容积(MCV)81.0 fl(60-77),MCHC 32.4 g/dL(32-36),显示为大细胞正色素性贫血。网织红细胞36,000 个/μL(10,000-110,000)。
自身凝集试验结果为阴性。生化分析显示:碱性磷酸酶活性331 U/l(47-254),葡萄糖浓度147 mg/dl(75-128),C反应蛋白6.9 mg/dL(0-1.0)。尿检结果无异常。胸部和腹部的放射线检查未发现异常。超声心动图结果无异常,但腹部超声检查发现轻微胆汁淤积。
直接抗球蛋白试验在4°C和37°C时均为阴性。两种病媒传播病原体检测结果均为阴性。根据血型和交叉配血结果确定了一名供血者,为其进行了全血输注。全血输注后的Ht为25.9%。
第二天,全麻下进行了骨髓活检。骨髓检查结果显示,红细胞生成无效,并伴有红细胞吞噬和骨髓纤维化。5天后,网织红细胞数仍为49600/μL。因此,考虑为非再生性贫血。
这些临床病理结果符合前体靶向免疫介导性贫血(PIMA)诊断标准,具体如下:
(a) 原因不明的持续性非再生性贫血(骨髓采集当天Ht≤30%,网织红细胞<76,000个/μl,贫血或贫血相关症状至少持续5天);
(b) 红细胞生成无效,表现为持续贫血伴红细胞增生或早期红细胞前体增多伴成熟停滞;
(c) 临床诊断为PIMA。
03 治疗及预后
使用泼尼松龙(PSL)1 mg/kg一天两次口服、霉酚酸酯(MMF)18 mg/kg一天两次口服和兰索拉唑0.5 mg/kg口服。
21天后临床症状有所改善,网织红细胞增至113,100个/μL,Ht上升至19%(下图)。

3个月后Ht恢复到正常范围,病情完全缓解。PSL的剂量降至0.15 mg/kg每天一次,MMF的剂量保持不变。
经过约4个月的缓解后,贫血再次恶化,PSL增加到1 mg/kg每天两次,但没有效果。Ht降至11.7%,进行了第二次输血。并将MMF改为环孢素A(CsA)8 mg/kg一天两次口服。
改用CsA两个月后,Ht恢复到了正常范围,并获得了第二次缓解。因此,PSL减至0.15 mg/kg一天两次,CsA则维持相同剂量。
第二次缓解维持了5个月,贫血再次恶化。将PSL增加到1 mg/kg一天两次口服,但贫血仍未缓解。Ht水平仍保持在20%左右。
在确定不可能完全缓解后,主人同意在PSL和CsA的基础上使用奥卡替尼0.5 mg/kg一天两次口服进行联合治疗。
奥卡替尼联合疗法开始两周后,网织红细胞从61,700升至81,500/μL,Ht从18.3%升至19.2%。6个月后,Ht恢复到正常范围,实现了完全缓解。 在使用PSL 0.14 mg/kg一天两次口服、CsA 7 mg/kg一天两次口服和奥卡替尼0.5 mg/kg一天两次口服疗法11个月后依然缓解。此后CsA开始逐渐减少。
| 病例2 | |
|---|---|
 | 品种:马耳他犬 |
| 年龄:10岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:前体靶向免疫介导性贫血 | |
04 主诉及病史
食欲不振。
05 检查
直肠温度38.7°C,心率150次/分,呼吸频率30次/分。粘膜苍白,心脏杂音为收缩期杂音,Levine分级为2/6。
血液检查显示存在贫血:Ht 24.3%,血红蛋白7.9 g/dL,MCH 67.3 fl,MCHC 32.5 g/dL,显示为正细胞正色素性贫血。网织红细胞21,300个/μL。自身凝集试验结果为阴性。
生化分析显示CRP(1.1 mg/dL)轻度升高。腹部X线显示有小肝病。超声心动图显示二尖瓣轻微反流,腹部超声显示轻微胆汁淤积。总胆汁酸前值16.2 μmol/L,后值41.4 μmol/L,都很高(参考:7.9 μmol/L)。
血清总T4 0.7 μg/dL(0.9-2.9),促甲状腺激素0.46 ng/mL(0.01-0.33),血清铁和总铁结合力正常。怀疑该犬出现了肝功能衰竭和甲状腺功能减退,开始服用左甲状腺素14 μg/kg一天两次口服。10天后Ht为13%,MCV为66.3 fl,MCHC为30.8 g/dl,网织红细胞26,900 个/μl,表明该犬进展为非再生性贫血。
直接抗球蛋白试验在4°C和37°C时均为阴性。两种病媒传播病原体检测结果均为阴性。进行了全血输注,输血后Ht为27%。
骨髓检查显示红细胞生成功能低下,并伴有红细胞增生。这些结果符合PIMA的诊断。
06 治疗及预后
使用PSL 1 mg/kg一天两次口服、MMF 10 mg/kg一天两次口服和兰索拉唑0.5 mg/kg口服治疗(下图)。
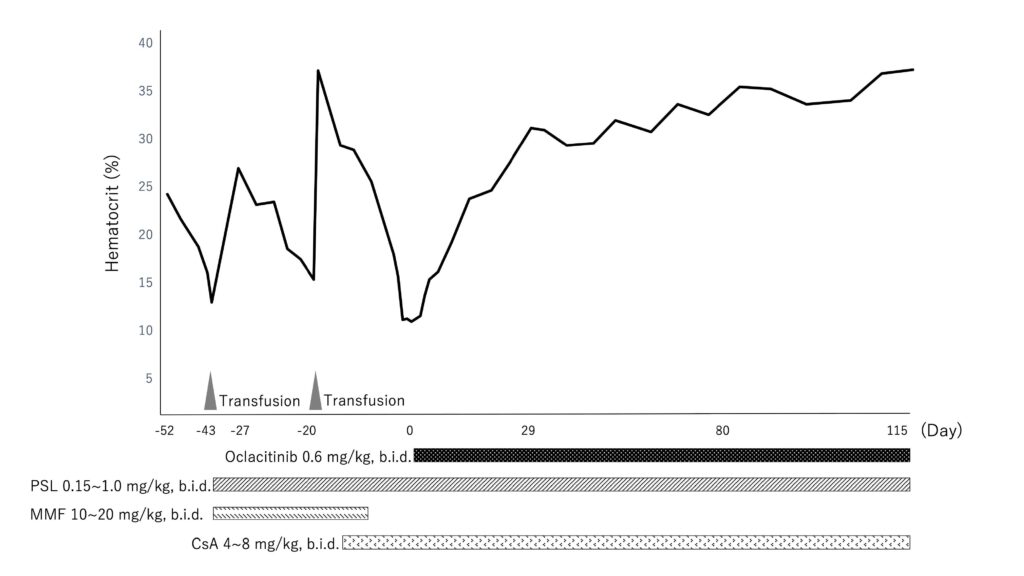
7天后Ht降至19.7%,将MMF剂量增至20 mg/kg一天两次。
19天后,将MMF改为CsA 7 mg/kg一天两次口服。全血输注后,Ht为34%,但在开始服用CsA 12天后,Ht降至14.9%。还出现了嗜睡、厌食和腹泻,血小板31,000/μL (148,000-484,000)、丙氨酸转氨酶349 U/L(17-78)、碱性磷酸酶3,272 U/L、γ-谷氨酰转移酶102 U/L(5-14)、总胆红素1.5 mg/dL(0.1-0.5)、CRP 14.0 mg/dL。
活化部分凝血活酶时间39.2 秒(12.0-24)。抗凝血酶水平较低93%(116-161),凝血酶-抗凝血酶Ⅲ复合物0.767 ng/mL(<0.251)和D-二聚体141 μg/dL(<1μg/dL)浓度较高。
腹部超声显示胆囊壁增厚,这表明细菌性胆管炎或血栓栓塞导致了血管内凝血。该犬立即接受抗生素治疗:氨苄西林20 mg/kg一天两次皮下和恩诺沙星10 mg/kg每天一次皮下和静脉输液的重症监护。PSL立即减量至0.6 mg/kg隔日一次。如果出现血管内凝血或血栓栓塞则使用利伐沙班0.6 mg/kg口服。
由于无法找到输血供体,也怀疑该犬有细菌感染或血栓栓塞,未增加PSL剂量。在征得主人同意后,开始了PSL、CsA和奥卡替尼0.6 mg/kg一天两次口服的联合治疗。
10天后临床症状有所改善,显示出恢复趋势,入院时异常的结果也几乎改善到正常范围。于是出院。
奥卡替尼联合疗法13天后,网织红细胞从41,500升至146,700 个/μL,Ht从17.9%升至 19.2%。发病第17天Ht为23.8%,第31天Ht为31%,约4个月后完全缓解。
奥卡替尼联合疗法5个月后,CsA开始减量,11个月后,CsA成功停药,并通过PSL 0.25 mg/kg每天一次和奥卡替尼0.45 mg/kg一天两次口服维持完全缓解状态。
07 讨论
前体靶向免疫介导性贫血(Precursor-targeted immune-mediated anemia,PIMA)已在非再生性贫血和红细胞生成无效的犬中得到描述。尽管有人认为其发生可能与红细胞前体的免疫靶向有关,但这一发病机制尚未确定[1,2,3]。
14只患有PIMA的犬中有5只表现出IgG与红细胞前体结合[4]。此外,还假设IgM、补体蛋白3、IgA和其他吞噬和细胞介导免疫的介质以及免疫介导的溶血性贫血参与了该病的发病机制[4]。
事实上,在大多数PIMA犬的骨髓样本中都发现了外观正常的巨噬细胞对完整红细胞前体的吞噬作用[2,3]。许多PIMA病例对免疫抑制疗法有反应[3,5,6]。
出现非再生性贫血超过5天并伴有骨髓红细胞生成无效的犬被诊断为PIMA[2,3]。此外,提示免疫介导机制的发现,如完整红细胞前体的红细胞吞噬和对糖皮质激素治疗的反应,也可用于进一步确诊PIMA[2,3]。
虽然PIMA主要采用糖皮质激素治疗,但在单用糖皮质激素无效的情况下,免疫抑制剂(如硫唑嘌呤、霉酚酸酯[MMF]、环孢素A [CsA]、人γ-球蛋白和生物制剂)可作为联合疗法使用[3,5-8]。然而,并非所有PIMA病例在接受这些治疗后都能得到缓解。
Janus激酶(JAK)是细胞内的胞浆酪氨酸激酶,通过信号转导子和转录激活子(STAT)的磷酸化转导细胞因子介导的膜受体激活[9]。目前已知的JAK亚型有四种(JAK1、JAK2、JAK3和酪氨酸激酶2),通过抑制JAK-STAT通路阻断细胞因子信号传导是治疗免疫介导疾病的一种很有前景的选择[10]。
近年来,JAK1抑制剂已开始在人类医学中临床应用,用于治疗类风湿性关节炎[11]、炎症性肠病[12]和再生障碍性贫血[15]。在兽医领域,已开发出一种JAK1抑制剂(奥卡替尼),并已应用于临床,以抑制IL-31介导的细胞内信号传导,这种信号传导会诱发犬特应性或过敏性皮炎[16]。
最近,有报道称奥卡替尼对犬免疫介导的皮肤病有效,如缺血性皮肤病、自身免疫性表皮下大疱性皮肤病、过度角化性多形红斑、寻常天疱疮和皮肤红斑狼疮[17-21]。
一项关于奥卡替尼对T细胞增殖和细胞因子分泌影响的体外研究发现,这种药物能显著减少克隆激活细胞因子(IL-2和IL-15)、促炎细胞因子(干扰素-γ和IL-18)以及调节细胞因子IL-10的分泌。而肿瘤坏死因子α和IL-6的分泌则受到轻度抑制[22]。这些作用被认为参与了奥卡替尼对免疫介导的皮肤病的治疗效果。然而,其潜在机制的细节尚未明确。
本文报告了两只犬,在泼尼松龙(PSL)和CsA的基础上,使用奥卡替尼联合疗法后,PIMA的病情得到了完全缓解,推测JAK1抑制剂的免疫抑制或调节作用会对之前未能缓解的PIMA病例产生影响。
本文介绍的两个病例都是根据Assenmacher等人[3]提出的诊断标准确诊为PIMA。在使用PSL和免疫抑制剂(如硫唑嘌呤、CsA 和 MMF)联合治疗后,73% 的PIMA患者获得了临床缓解。根据该报告,本研究也采用了类似的治疗方法。尽管病例1通过这些治疗获得了暂时缓解,但持续时间很短,而且无法维持。而病例2对这些治疗方法均无反应,不得不反复输血。
在人类医学中,JAK抑制剂抑制JAK1-STAT通路,用于抑制类风湿关节炎[11]和炎症性肠病[12]等疾病患者的炎症细胞因子,如干扰素-α和IL-6。
近年来,由于对不良反应(如泛JAK抑制引发的全血细胞减少)的担忧,选择性抑制JAK1的upadacitinib[12]、filgotinib[13]和itacitinib[14]已被开发出来并获得批准。
在人类血液病方面,根据一例STAT1功能增益变异的再生障碍性贫血患者在服用JAK1抑制剂itacitinib后病情得到缓解的病例,证明JAK1-STAT1通路的失调与病情的发展有关[15]。
此外,JAK1/2抑制剂Ruxolitinib在小鼠免疫性再生障碍性贫血中的疗效支持了JAK1/2抑制剂在人类再生障碍性贫血和其他免疫介导的骨髓病中的临床试验[23]。
PIMA与再生障碍性贫血相似,即免疫系统会误杀并破坏骨髓中的血细胞前体[2,24]。考虑到PIMA的病理也可能涉及JAK1-STAT通路,本研究对两例PIMA犬给予奥卡替尼治疗,两例患者均获得完全缓解。
虽然这一作用的详细机制尚未明确,但这些发现表明,JAK1-STAT通路参与了PIMA的发病机制,正如在再生障碍性贫血中观察到的那样,阻断JAK1可防止血细胞祖细胞的定向破坏。然而,奥卡替尼在PIMA中的作用机制还有待进一步研究。
奥卡替尼的许可剂量为0.4-0.6 mg/kg,每天两次,持续2周,后根据需要每天一次,推荐用于治疗犬特应性或过敏性皮炎[25]。最近,一项关于长期服用奥卡替尼每日两次治疗犬特应性疾病的安全性研究被报道,该研究描述了包括脓皮病、胃肠道症状和外耳道炎在内的不良事件,而血液检测显示白细胞、中性粒细胞、嗜酸性粒细胞和单核细胞计数略有下降;不过,频率与批准的方案一致[26]。
此外,迄今为止用于治疗免疫介导的皮肤病的剂量为0.5-0.7 mg/kg,每天两次,持续时间长达6周至2年或更长,且未报告任何不良反应[17-21]。
在本研究纳入的两个病例中,长期服用0.5-0.6 mg/kg奥卡替尼每天两次,未观察到不良反应。奥卡替尼治疗免疫介导的皮肤病时,曾单独使用奥卡替尼或与PSL联合使用[17-21]。而在本研究中,两只狗接受了PSL和CsA与奥卡替尼的联合治疗,直至达到完全缓解。
在达到完全缓解前的一段时间里,密切监测了不良反应,但两例患者均未出现不良反应。也有报道称,人类使用CsA和tofacitinib长期联合治疗类固醇耐药的溃疡性结肠炎达6个月之久,未出现任何不良反应[27]。
本研究中的两个病例并未单独接受奥卡替尼治疗,因此尚不清楚是否需要同时使用PSL或CsA才能使PIMA缓解。PSL、CsA和奥卡替尼联合使用可能会引起严重的不良反应,因此应仔细考虑是否需要联合使用这些药物。
参考文献
[1] Weiss D.J. Bone marrow pathology in dogs and cats with non-regenerative immune-mediated haemolytic anaemia and pure red cell aplasia. J. Comp. Pathol. 2008;138:46–53.
[2] Lucidi C.A, de Rezende C.L.E, Jutkowitz L.A, Scott M.A. Histologic and cytologic bone marrow findings in dogs with suspected precursor-targeted immune-mediated anemia and associated phagocytosis of erythroid precursors. Vet. Clin. Pathol. 2017;46:401–415.
[3] Assenmacher T.D, Jutkowitz L.A, Koenigshof A.M, de A.L.C, Scott M.A. Clinical features of precursor-targeted immune-mediated anemia in dogs: 66 cases (2004–2013) J. Am. Vet. Med. Assoc. 2019;255:366–376.
[4] Lucidi C.A, Gerlach J.A, Jutkowitz A, Scott M.A. Immunoglobulin G and phosphatidylserine in regenerative and nonregenerative immune-mediated anemias of dogs. J. Vet. Intern. Med. 2021;35:2713–2721.
[5] Stokol T, Blue J.T, French T.W. Idiopathic pure red cell aplasia and nonregenerative immune-mediated anemia in dogs: 43 cases (1988–1999) J. Am. Vet. Med. Assoc. 2000;216:1429–1436.
[6] Morishita K, Sugawara-Suda M, Yamazaki J, Sasaki N, Nakamura K, Ohta H, Takiguchi M. Evaluation of responses to immunosuppressive therapy in dogs with suspected non-regenerative immune-mediated anaemia: 11 cases (2012–2018) J. Small. Anim. Pract. 2023 Online ahead of print.
[7] Scott-Moncrieff J.C, Reagan W.J, Glickman L.T, DeNicola D.B, Harrington D. Treatment of nonregenerative anemia with human gamma-globulin in dogs. J. Am. Vet. Med. Assoc. 1995;206:1895–1900.
[8] Yuki M. A case of non-regenerative immune-mediated anemia treated by combination therapy of human immune globulin and mycophenolate mofetil in a dog. Open. Vet. J. 2011;1:46–49.
[9] Schwartz D.M, Bonelli M, Gadina M, O’Shea J.J. Type I/II cytokines, JAKs, and new strategies for treating autoimmune diseases. Nat. Rev. Rheumatol. 2016;12:25–36.
[10] Kim H.O. Development of JAK inhibitors for the treatment of immune-mediated diseases: kinase-targeted inhibitors and pseudokinase-targeted inhibitors. Arch. Pharm. Res. 2020;43:1173–1186.
[11] Kim E.S, Keam S.J. Correction to: filgotinib in rheumatoid arthritis: a profile of its use. Clin. Drug Investig. 2022;42:101.
[12] Harris C, Cummings J.R.F. JAK1 inhibition and inflammatory bowel disease. Rheumatology (Oxf. Engl.) 2021;60:ii45–ii51.
[13] Kavanaugh A, Kremer J, Ponce L, Cseuz R, Reshetko O.V, Stanislavchuk M, Greenwald M, Van der Aa A, Vanhoutte F, Tasset C, Harrison P. Filgotinib (GLPG0634/GS-6034), an oral selective JAK1 inhibitor, is effective as monotherapy in patients with active rheumatoid arthritis: results from a randomised, dose-finding study (DARWIN 2) Ann. Rheum. Dis. 2017;76:1009–1019.
[14] Avci A.B, Feist E, Burmester G.R. Early phase studies of JAK1 selective inhibitors in rheumatoid arthritis. Rheumatology. 2021;60:ii11–ii16.
[15] Rosenberg J.M, Peters J.M, Hughes T, Lareau C.A, Ludwig L.S, Massoth L.R, Austin-Tse C, Rehm H.L, Bryson B, Chen Y.B, Regev A, Shalek A.K, Fortune S.M, Sykes D.B. JAK inhibition in a patient with a STAT1 gain-of-function variant reveals STAT1 dysregulation as a common feature of aplastic anemia. Med. 2022;3:42–57.e45.
[16] Gonzales A.J, Bowman J.W, Fici G.J, Zhang M, Mann D.W, Mitton-Fry M. Oclacitinib (APOQUEL(®)) is a novel Janus kinase inhibitor with activity against cytokines involved in allergy. J. Vet. Pharmacol. Ther. 2014;37:317–324.
[17] Aymeric E, Bensignor E. A case of presumed autoimmune subepidermal blistering dermatosis treated with oclacitinib. Vet. Dermatol. 2017;28:512–e123.
[18] Levy B.J, Linder K.E, Olivry T. The role of oclacitinib in the management of ischaemic dermatopathy in four dogs. Vet. Dermatol. 2019;30:201–e263.
[19] High E.J, Linder K.E, Mamo L.B, Levy B.J, Herrmann I, Bizikova P. Rapid response of hyperkeratotic erythema multiforme to oclacitinib in two dogs. Vet. Dermatol. 2020;31:e330–e386.
[20] Martinez N, McDonald B, Crowley A. A case report of the beneficial effect of oclacitinib in a dog with pemphigus vulgaris. Vet. Dermatol. 2022;33:237–e265.
[21] Harvey R.G, Olivri A, Lima T, Olivry T. Effective treatment of canine chronic cutaneous lupus erythematosus variants with oclacitinib: seven cases. Vet. Dermatol. 2023;34:53–58.
[22] Banovic F, Tarigo J, Gordon H, Barber J.P, Gogal R.M., Jr Immunomodulatory in vitro effects of oclacitinib on canine T-cell proliferation and cytokine production. Vet. Dermatol. 2019;30:17–e16.
[23] Groarke E.M, Feng X, Aggarwal N, Manley A.L, Wu Z, Gao S, Patel B.A, Chen J, Young N.S. Efficacy of JAK1/2 inhibition in murine immune bone marrow failure. Blood. 2023;141:72–89.
[24] Young N.S. Aplastic anemia. N. Engl. J. Med. 2018;379:1643–1656.
[25] Cosgrove S.B, Wren J.A, Cleaver D.M, Walsh K.F, Follis S.I, King V.I, Tena J.K, Stegemann M.R. A blinded, randomized, placebo-controlled trial of the efficacy and safety of the Janus kinase inhibitor oclacitinib (Apoquel®) in client-owned dogs with atopic dermatitis. Vet. Dermatol. 2013;24:587–597. e141-582.
[26] Denti D, Caldin M, Ventura L, De Lucia M. Prolonged twice-daily administration of oclacitinib for the control of canine atopic dermatitis: a retrospective study of 53 client-owned atopic dogs. Vet. Dermatol. 2022;33:e149–e142.
[27] Yang Q, Chen L, Feng L, Liu C, Fang L, Liu Z, Sun X. Success of cyclosporin and tofacitinib combination therapy in a patient with severe steroid-refractory ulcerative colitis. Inflam. Bowel. Dis. 2021;27:e157–e158.