
| 一般情况 | |
|---|---|
 | 品种:迷你贵宾犬 |
| 年龄:11岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:掌跖痛性红斑 | |
01 主诉及病史
3个月前接受过肛周肿块切除手术,现前来复查。
3个月前CT显示左侧肛门外括约肌周围有一个边缘不清的软组织肿块(21.1×11.6×18.2 mm),左侧骶淋巴结和左侧胃下淋巴结轻度至中度肿大。手术切除了肿块、左侧骶骨淋巴结和左侧胃下淋巴结。病理学检查显示肛门括约肌周围的软组织肿块为腺癌,骶骨淋巴结为转移,胃下淋巴结未发现肿瘤。该犬被诊断为肛囊腺癌3期。
每隔一天注射25毫克(3.2 mg/kg)磷酸妥拉尼布(帕拉丁)。一周后发现嘴部周围出现红斑和脱屑,存在瘙痒。第10天,爪垫出现红斑(下图)。
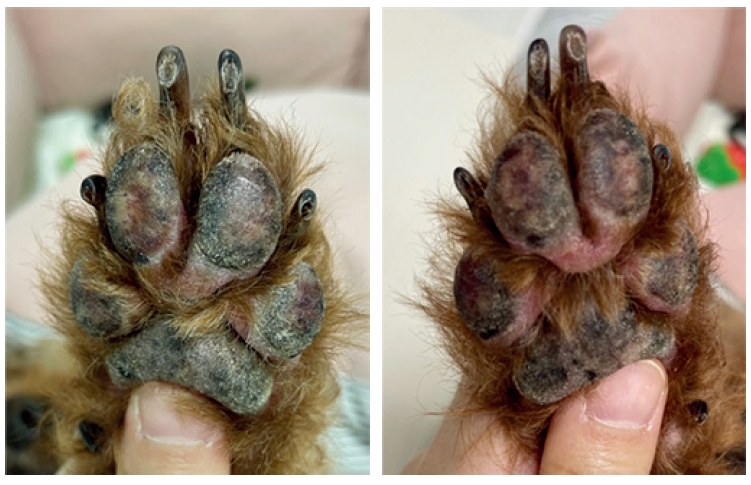
02 治疗
由于怀疑存在药物毒性,第11天停用了帕拉丁。停用后红斑轻微减轻,但爪垫出现脱色(下图)。
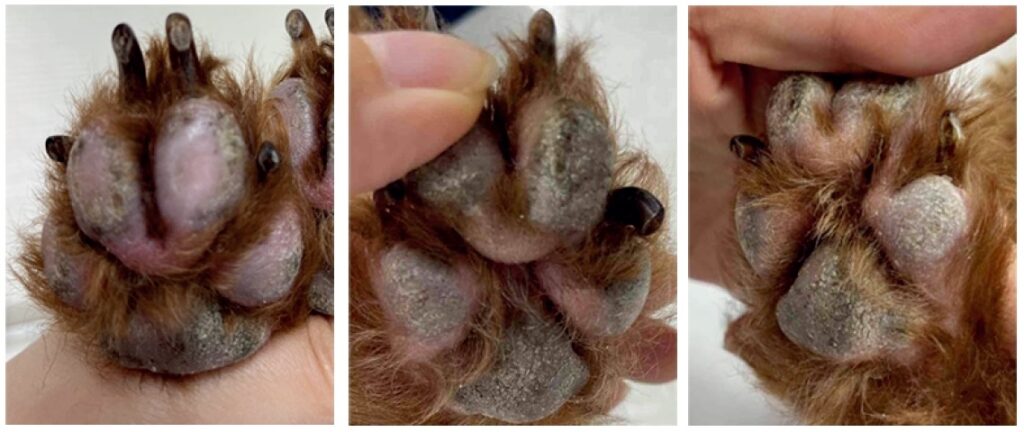
第21天,重新开始使用帕拉丁。7天后全身出现红斑和脱屑。12天后,爪垫出现红斑,精神萎靡,厌食。爪垫出现水肿,从爪垫到掌骨/跖骨病变处出现过度角化。最后,该犬因疼痛而停止行走,并停用了帕拉丁(第42天,下图)。

停用帕拉丁后,该犬食欲良好,不再疼痛或跛行。停用14天后,爪垫逐渐变黑并恢复正常(下图)。

停药7周后恢复正常(下图)。

由于主人未同意,无法对皮肤损伤进行组织病理学检查,但根据病史、临床检查、纳兰霍量表和VCOG-CTCAE,诊断为3级掌跖痛性红斑,是继发于帕拉丁的不良反应。
停用帕拉丁后,该犬接受了美法仑治疗。美法仑治疗5个月后,CT显示肺部和左腰下淋巴结有转移。根据目前关于帕拉丁对3-4期肛囊腺癌有效的报道,患者开始服用低剂量、低频率的帕拉丁(每周二、四、六口服2.5 mg/kg),并密切评估皮肤病的变化。
在服用两次帕拉丁后,该犬开始出现与之前相同的皮肤问题(下图),于是使用多柔比星/卡铂方案替代帕拉丁。

为了明确是否存在MDR1基因突变,进行了基因分析,但没有检测到突变。
03 讨论
宠物癌症靶向药磷酸妥拉尼布(Toceranib phosphate,帕拉丁)是美国FDA批准用于治疗犬肥大细胞瘤的药物。虽然该药被批准用于1级和2级犬肥大细胞瘤,但它已被广泛用于多种癌症[1]。最近的研究表明,使用帕拉丁化疗可改善犬腺体肛囊腺癌的无进展间期和中位生存时间[2,3]。
掌跖痛性红斑又称手足综合征,是人化疗中一种较为常见的副作用。它是一种以手掌或脚底发红、明显不适、肿胀和刺痛为特征的疾病[4]。它根据皮肤变化的严重程度、有无疼痛以及日常生活活动受限的程度分为三个等级[4]。有报道称,索拉非尼、舒尼替尼、塞地拉尼、多西他赛、多柔比星、阿糖胞苷和卡培他滨等多种抗癌药物均可导致该病的发生[5,6]。
该病在兽医临床中的表现却相对罕见。本病例报告介绍了一例特殊病例,即一只狗在接受帕拉丁治疗癌症后出现掌跖痛性红斑,从而揭示了帕拉丁在兽医学中罕见的不良反应。
在人类医学中,接受表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗的患者中,70%-90%都会出现皮肤毒性[6,10]。观察到的皮肤不良反应包括干癣、瘙痒、丘疹脓疱疹、副癣和手足综合征(掌跖痛性红斑)[5,6,10-14]。
有几项研究调查了这些EGFR-TKI诱导的皮肤毒性的潜在机制,但尚未完全清楚。一些研究表明,皮肤毒性可能与EGFR-TKI诱导的角质细胞凋亡、炎症或毛细血管内皮损伤以及真皮乳头的药物浓度有关[15]。皮肤毒性可能与EGFR抑制、血管表皮生长因子-表皮生长因子受体抑制以及下游信号(如 STAT3)的抑制有关 [14]。
在狗身上,EGFR-TKI的皮肤毒性并不常见,也不像人类的毒性那么严重。帕拉丁常见的副作用包括胃肠道症状,如呕吐和腹泻、中性粒细胞减少、厌食、贫血、肝酶升高和跛行[1]。关于犬服用帕拉丁引起皮肤毒性的报道很少。已发表的病例报告中有一例皮肤色素沉着,一例爪垫变薄和色素沉着[1,16]。本病例报告是首例描述狗掌跖痛性红斑为帕拉丁不良反应的病例。
在这种情况下,帕拉丁的皮肤毒性似乎与人类报道的皮肤毒性类似,其机制也被认为是相似的。包括帕拉丁在内的酪氨酸激酶抑制剂可能会在犬身上出现皮肤不良反应。
考虑到本病例和其他两例报告病例[1,16],帕拉丁的皮肤毒性可能会在用药后三天至三周内发生,并在停药后一周或几周内缓解。
参考文献
[1] Bernabe LF, Portela R, Nguyen S, Kisseberth WC, Pennell M, Yancey MF, et al. Evaluation of the adverse event profile and pharmacodynamics of toceranib phosphate administered to dogs with solid tumors at doses below the maximum tolerated dose. BMC Vet Res 2013;9(1):190.
[2] Elliott JW. Response and outcome following toceranib phosphate treatment for stage four anal sac apocrine gland adenocarcinoma in dogs: 15 cases (2013–2017). J Am Vet Med Assoc 2019;254(8):960–966.
[3] Heaton CM, Fernandes AF, Jark PC, Pan X. Evaluation of toceranib for treatment of apocrine gland anal sac adenocarcinoma in dogs. J Vet Intern Med 2020;34(2):873–881.
[4] Chen AP, Setser A, Anadkat MJ, Cotliar J, Olsen EA, Garden BC, et al. Grading dermatologic adverse events of cancer treatments: the Common Terminology Criteria for Adverse Events Version 4.0. J Am Acad Dermatol 2012;67(5):1025–1039.
[5] Lipworth AD, Robert C, Zhu AX. Hand-foot syndrome (hand-foot skin reaction, palmar-plantar erythrodysesthesia): focus on sorafenib and sunitinib. Oncology 2009;77(5):257–271.
[6] Nikolaou V, Syrigos K, Saif MW. Incidence and implications of chemotherapy related hand-foot syndrome. Expert Opin Drug Saf 2016;15(12):1625–1633.
[7] Polton GA, Brearley MJ. Clinical stage, therapy, and prognosis in canine anal sac gland carcinoma. J Vet Intern Med 2007;21(2):274–280.
[8] Naranjo C, Busto U, Sellers E, Sandor P, Ruiz I, Roberts E. Naranjo ADR probability scale. Clin Pharmacol Ther 1981;30:239–245.
[9] Common terminology criteria for adverse events (VCOG-CTCAE) following chemotherapy or biological antineoplastic therapy in dogs and cats v1.1. Vet Comp Oncol 2016;14(4):417–446.
[10] Tseng LC, Chen KH, Wang CL, Weng LC. Effects of tyrosine kinase inhibitor therapy on skin toxicity and skin-related quality of life in patients with lung cancer: An observational study. Medicine (Baltimore) 2020;99(23):e20510
[11] Petrelli F, Borgonovo K, Cabiddu M, Lonati V, Barni S. Relationship between skin rash and outcome in non-small-cell lung cancer patients treated with anti-EGFR tyrosine kinase inhibitors: a literature-based meta-analysis of 24 trials. Lung Cancer 2012;78(1):8–15.
[12] Liu HB, Wu Y, Lv TF, Yao YW, Xiao YY, Yuan DM, et al. Skin rash could predict the response to EGFR tyrosine kinase inhibitor and the prognosis for patients with non-small cell lung cancer: a systematic review and meta-analysis. PLoS One 2013;8(1):e55128
[13] Califano R, Tariq N, Compton S, Fitzgerald DA, Harwood CA, Lal R, et al. Expert consensus on the management of adverse events from EGFR tyrosine kinase inhibitors in the UK. Drugs 2015;75(12):1335–1348.
[14] Lacouture ME. Mechanisms of cutaneous toxicities to EGFR inhibitors. Nat Rev Cancer 2006;6(10):803–812.
[15] Terada T, Noda S, Inui K. Management of dose variability and side effects for individualized cancer pharmacotherapy with tyrosine kinase inhibitors. Pharmacol Ther 2015;152:125–134.
[16] Cavalcanti JV, Hasbach A, Barnes K, Dange RB, Patterson J, Saavedra PV. Skin depigmentation associated with toceranib phosphate in a dog. Vet Dermatol 2017;28(4):400–e95.