
| 一般情况 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:9岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:猫嗜酸性硬化性纤维增生症(FESF) | |
01 主诉及病史
5周前开始咳嗽,咳嗽3天后出现急性呼吸困难,表现为呼气费力、呼吸急促和张口呼吸。胸部X光片上发现了一个纵隔肿块。
猫免疫缺陷病毒(FIV)抗体和猫白血病病毒(FeLV)抗原呈阴性。经过非甾体抗炎和抗菌治疗后,临床症状有所缓解。1周后复查胸部X线显示肿块依然存在。
02 检查
体格检查无异常。血液学和生化检查发现了嗜酸性粒细胞增多(嗜酸性粒细胞2.68×10^9/L,参考:0-1.5)和高球蛋白血症(球蛋白60.6 g/L,参考:24-40)。弓形虫血清学检查结果显示非活动性感染(IgG>800,IgM<20)。
胸腹部CT发现纵隔内有一个对比度增强、软组织增强的肿块(4.3×2.5×2.3 cm),围绕气管(下图)。胸部淋巴结和消化道均无异常。
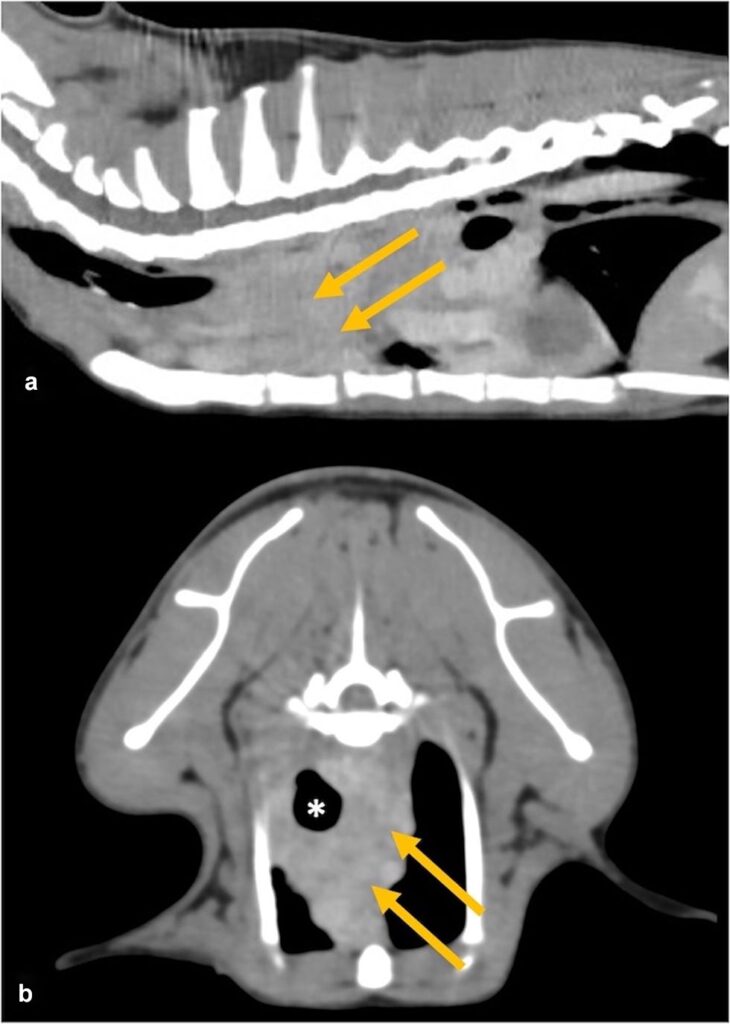
胸部超声发现气管周围有异质高回声结构。穿刺细胞学检查结果为无细胞,因此无法得出结论。组织病理学发现有浆细胞、巨噬细胞、淋巴细胞和少量中性粒细胞的非特异性炎症过程。
03 手术
鉴于无法排除潜在的肿瘤,进一步进行侵入性检查。在胸骨切开探查术后,对肿块进行了手术切除。由于肿块与气管粘连,没有进行完全切除。肿块细胞学检查发现了混合性中性粒细胞和嗜酸性粒细胞炎症,以及大小和形状类似球菌的细胞外颗粒。
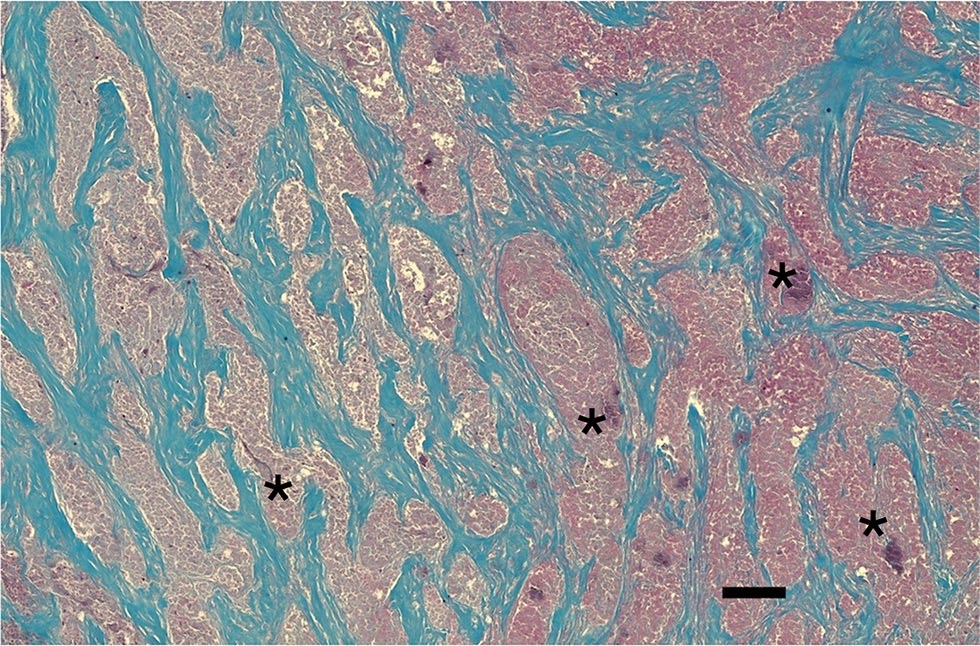
组织病理学检查发现,致密的胶原组织被大量嗜酸性粒细胞、淋巴细胞、浆细胞、中性粒细胞、大吞噬细胞和多核细胞破坏,并伴有大量血管增生和坏死区域(下图)。这些特征与猫嗜酸性硬化性纤维增生症(FESF)一致。
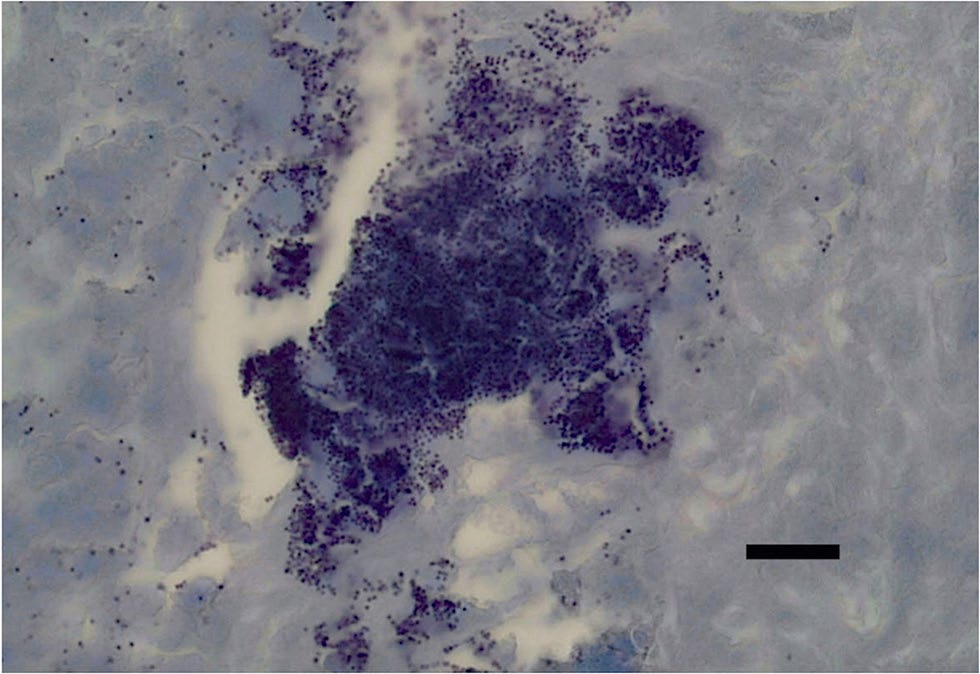
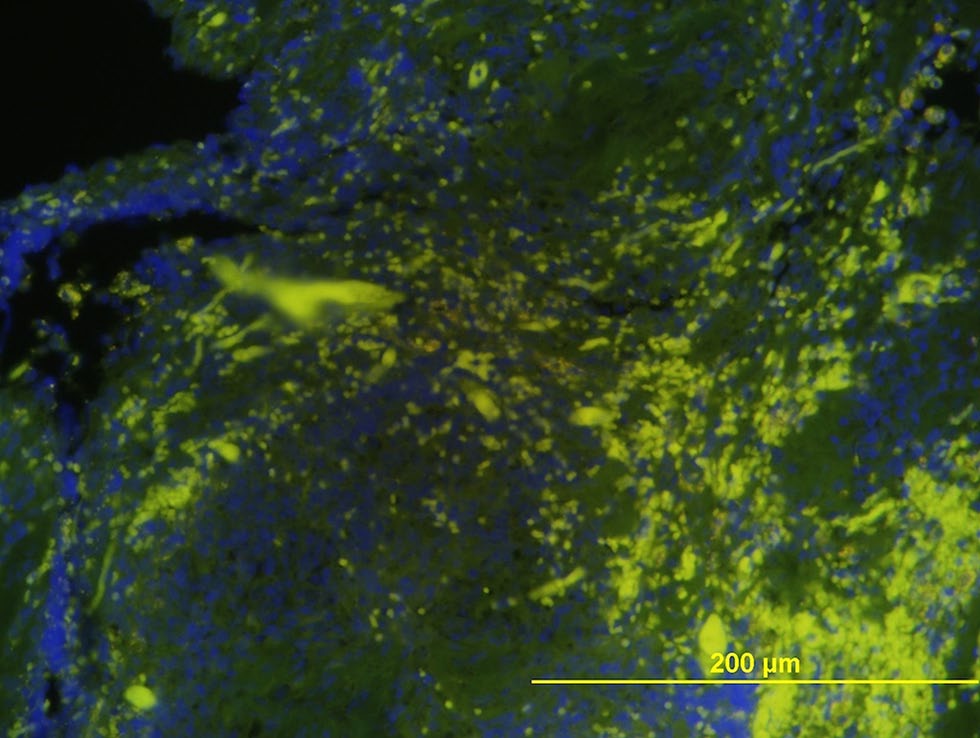
Ziehl-Neelsen染色法对耐酸菌检测呈阴性。定期酸性希夫染色法没有发现真菌。甲苯胺蓝染色仅显示出一些散在的肥大细胞。同时进行了革兰氏染色(下图上)和使用eubacteria探针(EUB338)的FISH检查(下图下),以最大限度提高细菌检测的灵敏度,结果发现了大量革兰氏阳性球菌。
04 预后
进行了广谱抗菌药物治疗(阿莫西林克拉维酸,20 mg/kg,PO,q12h)。在确诊为FESF后接受了泼尼松龙免疫抑制治疗(2 mg/kg,PO,q24h)。
3周后,嗜酸性粒细胞增多和高球蛋白血症症状消失(嗜酸性粒细胞0.94×10^9/L,球蛋白36.5 g/L)。2周后停止抗菌治疗,并建议2个月后再次进行胸部CT检查。
4周后出现了严重的出血性腹泻。胸部X光发现轻度胸腔积液,尾部背侧肺叶有局部肺泡形态,但没有纵隔肿块的迹象。送往医院后不久死亡,没有进行进一步检查(包括尸检)。
05 讨论
猫嗜酸性硬化性纤维增生症(FESF)是一种新出现的临床病症[1],自2009年首次正式定性以来,已报告了53个病例[1-14]。大多数病例表现为局限于胃肠道的肿块,肠系膜淋巴结可能受累[2,3,5]。罕见的情况是肝脏、胰腺和胸骨或纵隔淋巴结同时受累[1,2,5,6,11]。
主要的组织病理学特征包括被大的成纤维细胞分隔的致密胶原小梁,以及明显的嗜酸性炎症[2]。FESF的发病机制尚不清楚,但怀疑是抗原刺激引发了易感基因猫的异常炎症[2]。
感染病原体(主要是细菌)通常会在这些病变中被发现,但并不总是如此[1-3,5,6,10,14,15]。感染可能是导致炎症失调的诱因。由于位于胃肠道,非无菌环境中的粘膜改变也可能促进继发感染。FESF的治疗方法包括手术切除、免疫抑制和抗菌治疗,预后各异[1,2,5]。
本文首次报道了因纵隔肿块引起下呼吸道症状而出现FESF的病例。本病例发现了腔内细菌,证明原发性感染可能是FESF发病机制中免疫介导反应失调的驱动因素。
FESF的胃肠道外病例也有报道,但很少见。有两例此类病例的腹腔内病变分别局限于肠系膜或腹膜后间隙[9,10]。另一只猫的胰腺和肝脏受累,但同时消化道(幽门)也受累[11]。还有一只猫出现鼻腔肿块[13]。另有两份报告描述了胸腔内淋巴结病变,纵隔淋巴结病变伴或不伴有胸腔积液。
在这些病例中,消化道同时受累,胸腔内受累怀疑是通过胸骨淋巴结播散所致[1,7]。本文报告的病例未进行腹部超声检查。鉴于最初未报告胃肠道体征,腹部触诊无异常,腹部CT扫描正常,因此不太可能漏诊消化道肿块。不过,也不能排除漏诊微小病变的可能性。猫死前出现了胃肠道症状,没有进行尸检。因此不能完全排除胃肠道病变未被发现的可能性。
该病例中发现了鞘内细菌,这与其他报道相似[1-3,9,13]。其他区域内感染性病原体(线虫和真菌)也鲜有报道[6,8,14]。传染源在FESF发病机制中的作用尚不清楚。有观点认为,感染性病原体是导致炎症反应的主要诱因,或者仅仅反映了在非无菌环境中的继发性机会性感染,这种环境中组织结构异常,粘膜完整性可能受到破坏[1,2]。细菌诱发的皮下和肠系膜肿块具有类似FESF的组织病理学特征[15],证实了前一种可能性。
支持后一种可能性的是,区域内的细菌并不总能被识别出来[1]。然而,猫通常在接受抗菌治疗后才转诊。此外,培养、特殊染色(如革兰氏染色)和FISH检查并不总是同时进行,因此并不能完全排除细菌感染的可能性[2,4,5,7,8,10,11]。
正如本病例和其他病例所示,在标准组织病理学检查中未能发现感染性病原体并不能排除感染性病原体的存在,可能还需要进行细菌和真菌培养、革兰氏染色或FISH等其他检查[1]。遗憾的是,在本病例中,由于最初的主要怀疑是肿瘤而非感染,因此没有获得培养样本。
参考文献
1. Linton M, Nimmo JS, Norris JM, et al. Feline gastrointestinal eosinophilic sclerosing fibroplasia: 13 cases and review of an emerging clinical entity. J Feline Med Surg 2015; 17: 392–404.
2. Craig LE, Hardam EE, Hertzke DM, et al. Feline gastrointestinal eosinophilic sclerosing fibroplasia. Vet Pathol 2009; 46: 63–70.
3. Sihvo HK, Simola OT, Vainionpää MH, et al. Pathology in practice. Severe chronic multifocal intramural fibrosing and eosinophilic enteritis, with occasional intralesional bacteria, consistent with feline gastrointestinal eosinophilic sclerosing fibroplasia. (FIESF). J Am Vet Med Assoc 2011; 238: 585–587.
4. Suzuki M, Onchi M, Ozaki M. A case of feline gastrointestinal eosinophilic sclerosing fibroplasia. J Toxicol Pathol 2013; 26: 51–53.
5. Weissman A, Penninck D, Webster C, et al. Ultrasonographic and clinicopathological features of feline gastrointestinal eosinophilic sclerosing fibroplasia in four cats. J Feline Med Surg 2013; 15: 148–154.
6. Grau-Roma L, Galindo-Cardiel I, Isidoro-Ayza M, et al. A case of feline gastrointestinal eosinophilic sclerosing fibroplasia associated with phycomycetes. J Comp Pathol 2014; 151: 318–321.
7. Munday JS, Martinez AW, Soo M. A case of feline gastrointestinal eosinophilic sclerosing fibroplasia mimicking metastatic neoplasia. N Z Vet J 2014; 62: 356–360.
8. Crossland NA, Hanks CR, Ferguson JA, et al. First report of Cylicospirura felineus in a feral domestic shorthair cat in North America. JFMS Open Rep 2015; 1.
9. Thieme ME, Olsen AM, Woolcock AD, et al. Diagnosis and management of a case of retroperitoneal eosinophilic sclerosing fibroplasia in a cat. JFMS Open Rep 2019; 5.
10. Kambe N, Okabe R, Osada H, et al. A case of feline gastrointestinal eosinophilic sclerosing fibroplasia limited to the mesentery. J Small Anim Pract 2020; 61: 64–67.
11. Davidson GA, Taylor SS, Dobromylskyj MJ, et al. A case of an intramural, cavitated feline gastrointestinal eosinophilic sclerosing fibroplasia of the cranial abdomen in a domestic longhair cat. JFMS Open Rep 2021; 7.
12. Goffart LM, Durand A, Dettwiler M, et al. Feline gastrointestinal eosinophilic sclerosing fibroplasia presenting as a rectal mass. JFMS Open Rep 2022; 8.
13. Zampieri B, Church ME, Walsh K, et al. Feline eosinophilic sclerosing fibroplasia – a characteristic inflammatory response in sites beyond the gastrointestinal tract: case report and proposed nomenclature. JFMS Open Rep 2022; 8.
14. Martineau M, Tilmant C, Risco Castillo V, et al. A case of feline gastrointestinal eosinophilic sclerosing fibroplasia associated with fungal colonisation: endoscopic features, treatment and follow-up. JFMS Open Rep 2023; 9.
15. Ozaki K, Yamagami T, Nomura K, et al. Abscess-forming inflammatory granulation tissue with Gram-positive cocci and prominent eosinophil infiltration in cats: possible infection of methicillin-resistant Staphylococcus. Vet Pathol 2003; 40: 283–287.