
| 一般情况 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:8岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:肝脓肿继发心包炎 | |
01 主诉及病史
3天前出现嗜睡和食欲不振就诊,检查发现发热(40.5°C)和III/VI级左侧心脏杂音。杂音首次出现在两周前的疫苗接种时。
该猫定期接种疫苗,生活在室内,可以外出,曾有尿道梗阻和牙周病病史。
患者接受了为期7天的克拉维酸钾阿莫西林(16 mg/kg,q12h)治疗,并注射了一针地塞米松(0.2 mg/kg)。治疗后发热症状缓解,但在初次发病3天后,患者被发现处于侧卧状态,于是再次就诊。
02 检查
就诊时处于侧卧状态,但很警觉,反应灵敏。粘膜呈淡粉色,毛细血管再充盈时间(CRT)延长至3秒,外周脉搏微弱。呼吸急促,频率为每分钟60次,呼吸强度明显增加。心脏听诊发现双侧心音低钝,心率为每分钟160次。体况评分低至3/9。体重为3.89千克,被毛质量差。其余临床指标均在正常范围内。
床旁超声检查显示存在心包积液和右侧心脏填塞。未见胸腔或腹腔积液。镇静后进行心包穿刺,排出120 mL黄色浑浊液体。引流后血流动力学状况明显改善,外周脉搏质量良好,CRT为2秒。
穿刺液体的细胞学评估结果与脓性渗出物一致。液体有核细胞为50.30×10^9/L,主要是变性的中性粒细胞和杆菌,总蛋白为34 g/L。首次心包穿刺术后数小时,患者出现明显发热,体温达40.4°C。在细菌培养和药敏结果出来之前,抗生素治疗从克拉维酸钾阿莫西林改为普拉多沙星3 mg/kg,q24h口服。
血液学评估发现了非再生性贫血和炎性白斑。生化分析表明有低白蛋白血症,肌酸激酶略有升高。FIV/FeLV快速检测呈阴性。膀胱穿刺术采集了尿液,尿液分析结果显示尿液浓度适中(1.032),化学参数无异常,无炎症或感染迹象。尿培养呈阴性。血液中的巴尔通体PCR呈阴性。心包积液培养和抗菌药耐药性显示大肠埃希菌大量生长。
心包引流术两天后进行了进一步检查。腹部超声发现肝脏右侧胆囊背外侧突出一个15×34 mm巨大空腔肿块(下图)。其余肝实质无异常,无肝肿大迹象。
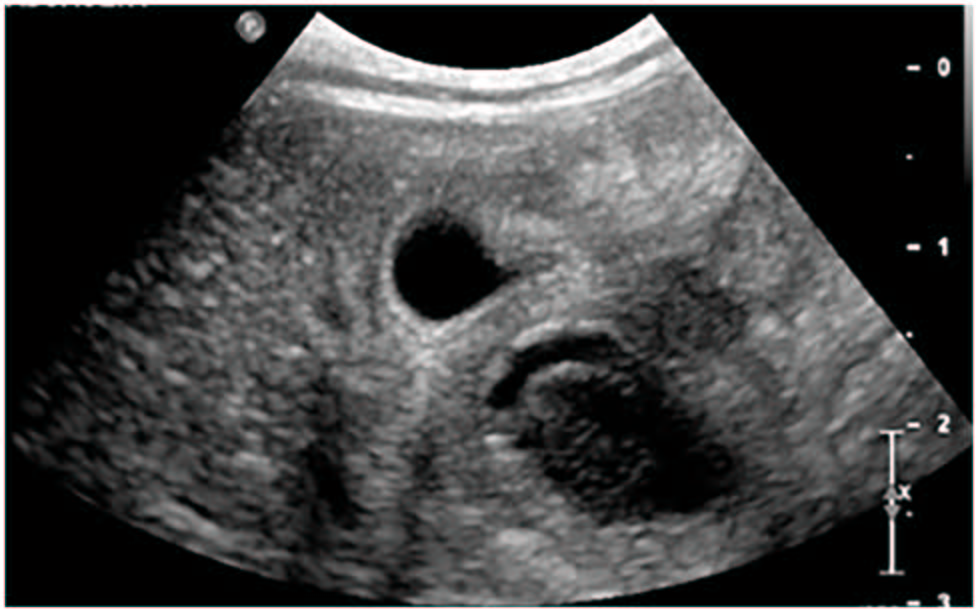
脾脏弥漫性肿大,顶端呈圆形。脾实质表现为多灶性、界限不清的低回声斑块。从空洞化的肝脏肿块中采集了细针吸出物,细胞学检查发现了化脓性中性粒细胞。细菌培养和分离确定为大肠杆菌。对腹腔渗出物进行了取样,结果与炎性渗出物一致。液体有核细胞为120.50 ×10^9/L,虽然没有观察到细菌,但考虑到检查结果,怀疑是感染。
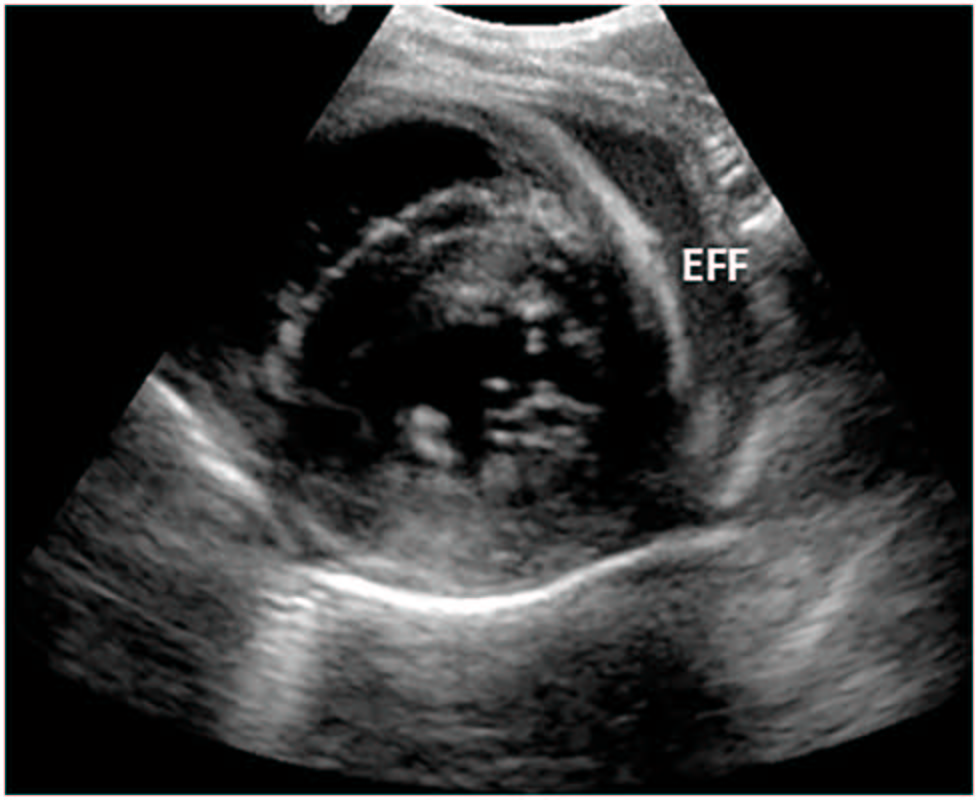
超声心动图检查发现少量残留积液,但未造成心包填塞(下图)。心壁厚度和心腔尺寸均在正常范围内。在心包腔内观察到一个线状阴影结构,从左心室心尖一直延伸到右心室游离壁。这一发现与气体或异物相符。心包引流术后的胸部放射线检查显示,胸腔积液较少,呈支气管间质形态,心脏轮廓中度扩大。
03 治疗
肝脏肿块取样后不久,患者的脉搏质量下降,粘膜变得苍白。考虑到对巨大肝脓肿的药物治疗具有挑战性,而且患者的病情稳定性已经下降,再加上对可能发生化脓性腹膜炎的担忧,建议进行探查性开腹手术。
在发现大量腹水的情况下,对患者进行了腹中线联合开腹手术。探查时发现胆囊上附着一个肝脓肿。胆囊本身增厚并与右内侧肝叶粘连。接受了右肝叶切除术和胆囊切除术。脾脏出现严重异常,因此也进行了脾脏切除术。还进行了胸骨正中切开术和心包次全切除术,并用无菌生理盐水大量冲洗胸腹腔。
患者恢复顺利,无需入住重症监护室。心包、肝脏和胆囊的组织病理学评估显示出明显的化脓性炎症。未发现肿瘤迹象。脾脏组织病理学评估显示反应性淋巴细胞增生伴髓外造血。患者出院后接受了3 mg/kg,q24h的普拉多沙星治疗,疗程为2周。
04 预后
出院3周后复查状况良好,体重(4.60 千克)和体况评分(5/9)均有显著改善。外周脉搏强劲,粘膜呈粉红色。检查中发现的唯一异常是伴有II/VI级心尖收缩期杂音的驰张音。血液学评估显示贫血有所改善,血红蛋白在参考范围内。还有轻度中性粒细胞增多、嗜酸性粒细胞增多和嗜碱性粒细胞增多。之前的低白蛋白血症已经缓解。出院时服用了为期5天的芬苯达唑(50 mg/kg,q24h)作为预防。主人拒绝继续随访。
05 讨论
兽医文献中有关猫细菌性心包炎的报道很少。一项对146例心包积液的猫科动物进行的回顾性研究没有报告一例败血症病因的病例[2],凸显了这种病症的罕见性。
犬猫化脓性心包炎的发病原因很多,包括并发胸膜或肺部感染、穿透性创伤、异物移位或其他细菌病灶的血源性传播[3]。猫也有少数病例报道[4-8]。已报道病例的可疑机制包括血源性传播[4,5]、局部感染传播[6]、异物移位[7]和不明原因[8]。
在本病例中,化脓性心包炎被怀疑是由肝脏病变引起的血源性传播。在肝胆疾病犬猫的阳性培养样本中通常会分离到大肠杆菌[9,10]。其他常见病原体包括肠球菌、乳酸杆菌和梭状芽孢杆菌。这些细菌通常存在于胃肠道中,并通过胆道系统或门静脉转移到肝脏。
一项关于14只猫肝脓肿的小型病例系列研究发现,培养出的细菌群通常是胃肠道中的细菌,包括最常培养出的大肠杆菌以及链球菌、肠球菌、假单胞菌、肠杆菌属和杆菌属细菌[11]。因此,鉴于感染病原体是大肠杆菌,怀疑肝脓肿是原发部位,经门静脉血源性传播导致播散到心包。
肝脓肿是猫科动物中比较少见的病理结果。在一项已发表的研究中,58只患有全身肝胆疾病的猫未报告肝脓肿;但14%的肝脏和36%的胆汁培养样本细菌生长呈阳性[10]。说明即使在肝组织培养阳性的猫中,脓肿也并不常见。
猫肝脓肿的治疗方法尚不明确。在人类医学中,对于小于3-5厘米的肝脓肿通常采用经皮引流,并根据培养和抗菌药敏感性使用抗生素治疗。较大的脓肿有时需要手术治疗和全身抗生素[12]。
一个小型病例系列记录了5只狗和1只猫的肝脓肿经皮引流和酒精治疗,效果非常好[13]。考虑到化脓性腹膜炎的问题,本病例没有考虑这种创伤较小的治疗方法。这种治疗方法更适用于临床病情稳定、无其他需要手术的并发症的患者。
有几篇兽医报告描述了猫因怀疑血源性传播而继发化脓性心包炎的情况。有一个病例描述了一名最近接受过牙科手术的患者因口腔假定血源性传播而引发的化脓性心包炎。该猫只接受了药物治疗,并记录了心包积液的消退情况[4]。
另一份报告描述了一只未绝育雌猫因子宫脓肿引发的化脓性心包炎。该患者接受了手术和药物治疗,包括心包次全切除术和卵巢切除术,以及为期4周的恩诺沙星和甲硝唑治疗。1年后,患者临床康复[5]。
由于猫化脓性心包炎的发病率较低[2],最合适的治疗方法尚未确定。有报道称,一些化脓性心包积液可以通过心包穿刺、抗菌治疗和支持性护理进行保守治疗[4,8];但由于有后续并发症的报道,建议在患者病情稳定后进行心包切除术[6]。
缩窄性心包炎是人类急性心包炎的一种罕见并发症,发病率为1.8%,但考虑到具体病因,化脓性心包炎患者的发病风险更高[14]。在狗中,缩窄性心包炎最常见的病因是特发性或与感染有关[15],但关于猫的报道却很有限。
之前报道的病例描述了对一只患有细菌性心包炎的猫的医疗处理,怀疑该病继发于肺部感染[6]。该患者在随后发展为缩窄性心包炎后未能存活。这表明对猫科病例进行额外的手术治疗可能会有好处。
在本文介绍的病例中,患者失去了随访机会,虽然出现了良好的反应,但无法获得长期随访结果。在三周的检查中记录到的心脏杂音没有得到详细检查。鉴于怀疑细菌感染来自血源性传播,心内膜炎是一个需要考虑的后遗症。
在人类患者中,通常要进行血培养,因为脓毒性心包炎病例的血培养样本中有40%-70%呈阳性[16]。本病例未进行血培养,但可在今后的病例中加以考虑。
参考文献
1. Laflamme DP. Development and validation of a body condition score system for cats. Feline Pract 1997; 25: 13–18.
2. Hall DJ, Shofer F, Meier CK, et al. Pericardial effusion in cats: a retrospective study of clinical findings and outcome in 146 cats. J Vet Intern Med 2007; 21: 1002–1007.
3. Calvert C, Thomason J. Cardiovascular infections. In: Greene C, Sykes J. (eds). Infectious disease of the dog and cat. 4th ed. USA, Saunders, 2012, pp 934–935.
4. Lobetti RG. Anaerobic bacterial pericardial effusion in a cat. J S Afr Vet Assoc 2007; 78: 175–177.
5. Majoy SB, Sharp CR, Dickinson AE, et al. Septic pericarditis in a cat with pyometra. J Vet Emerg Crit Care 2013; 23: 68–76.
6. Tagawa M, Kurashima C, Shimbo G, et al. Fibrinous pericarditis secondary to bacterial infection in a cat. J Vet Med Sci 2017; 79: 957–961.
7. Denroche K, Fox PR, Prittie J, et al. Septic pericarditis caused by a migrating grass awn in a cat. J Vet Cardiol 2021; 36: 14–19.
8. LeBlanc N, Scollan KF. Bacterial pericarditis in a cat. JFMS Open Rep 2015; 1.
9. Center SA, Randolph JF, Warner KL, et al. Bacterial culture and immunohistochemical detection of bacteria and endotoxin in cats with suppurative cholangitis-cholangiohepatitis syndrome. J Am Vet Med Assoc 2022; 260: 194–211.
10. Wagner K, Hartmann F, Trepanier L. Bacterial culture results from liver, gallbladder, or bile in 248 dogs and cats evaluated for hepatobiliary disease: 1998–2003. J Vet Intern Med 2007; 21: 417–424.
11. Sergeef J, Armstrong J, Bunch S. Hepatic abscesses in cats: 14 cases (1985–2002). J Vet Intern Med 2004; 18: 295–300.
12. Lardiere-Deguelte S, Ragot E, Amroun K, et al. Hepatic abscess: diagnosis and management. J Visc Surg 2015; 152: 231–243.
13. Zatellie A, Bonfanti U, Zini E, et al. Percutaneous drainage and alcoholization of hepatic abscesses in five dogs and a cat. J Am Anim Hosp Assoc 2005; 41: 34–38.
14. Imazio M, Brucato A, Maestroni S, et al. Risk of constrictive pericarditis after acute pericarditis. Circulation 2011; 124: 1270–1275.
15. Thomas W, Reed J, Bauer T, et al. Constrictive pericardial disease in the dog. J Am Vet Med Assoc 1984; 184: 546–553.
16. Brook I. Pericarditis caused by anaerobic bacteria. Int J Antimicrob Agents 2009; 33: 297–300.