
| 一般情况 | |
|---|---|
 | 品种:西施犬 |
| 年龄:5岁 | |
| 性别:雌 | |
| 是否绝育:未知 | |
| 诊断:脊髓肿瘤 | |
01 主诉及病史
后腿瘫痪、在垫子上大小便、连续三天不进食水和食物。
02 检查
全身状况良好,截瘫,前腿脊髓反射正常,双侧骨盆腿除屈肌反射外均增强,双侧骨盆腿浅感觉缺失,深痛觉缺失,T2尾部肌皮反射缺失,脊柱触诊无痛。诊断结果为T3-L3脊髓病变。
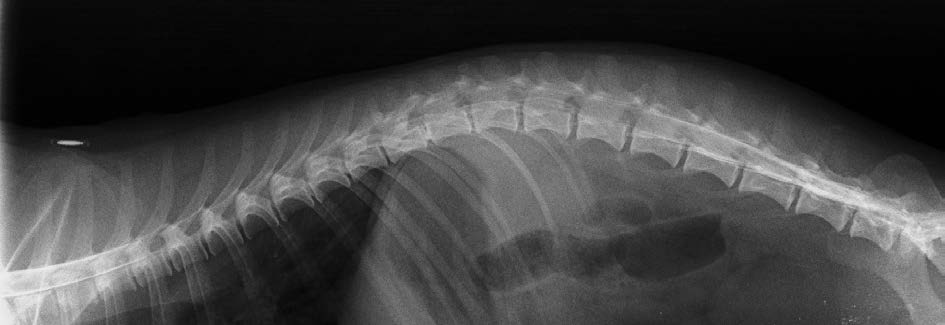
血液学检查显示仅有轻度贫血(红细胞4.6×10^12/L;范围4.95-7.87);生化检查显示碱性磷酸酶活性略有升高(2.0 μkat/L,范围0.02-1.90)。影像学检查显示膀胱明显充盈,胃和结肠内有气体,脾脏边缘变圆,T11-T12椎间盘钙化,T12-T13椎间盘间隙轻微变窄。腹腔超声无其他病理变化。脊髓造影显示,从T5-L3椎管内有充盈缺损(下图)。
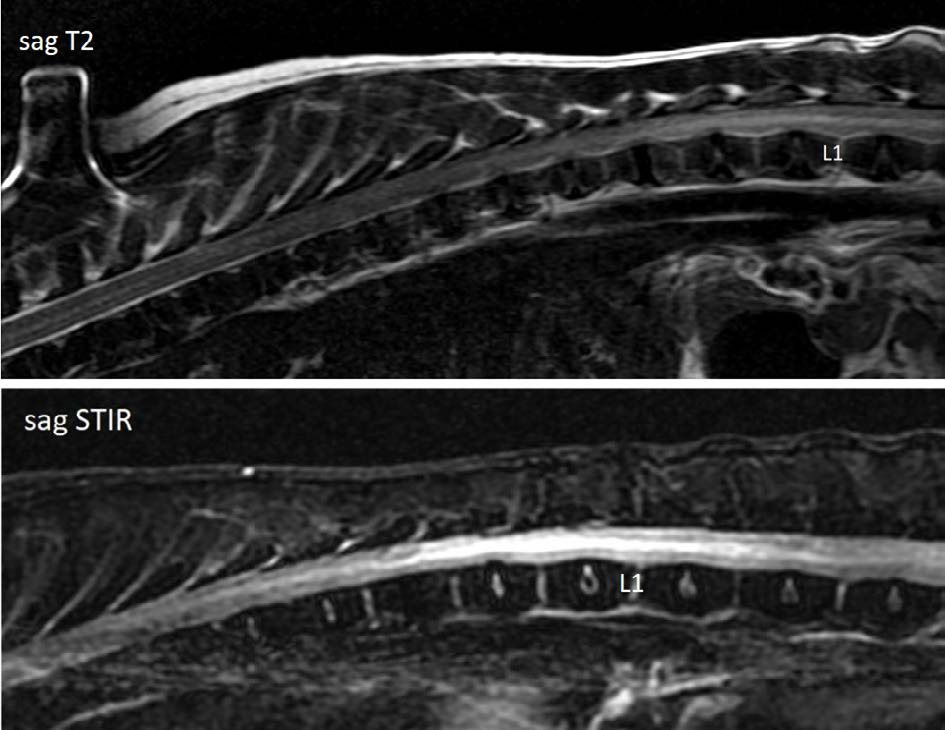
MRI显示,T5和L6椎体之间的脊髓实质相当混杂,该位置看不到背侧和腹侧脑脊液间隙。在T2-w序列上,在右背外侧、右外侧、右腹外侧硬膜外腔和硬膜下腔发现了肿块,信号强度很低;这种物质是均质的。在脊髓中,T2w序列在T11-L3区域的脊髓中部发现了一个清晰的高信号强度区域。在T2 GRE序列中,在前述位置的脊髓中发现了界限清晰、信号强度极低的均质区域。之前提到的硬膜外硬膜下肿块在T2 GRE序列中的信号强度也很低。由于椎间盘膨出,脊髓受到轻微压迫(下图)。
脑脊液检查显示外观略微发黄,红细胞数量增多,蛋白质含量增加。细胞学检查没有发现肿瘤细胞。
03 预后
应主人的安乐死要求,在对脊髓标本进行组织学检查后,对胸椎和腰椎的所有节段进行了背侧椎板切除术。脊髓明显畸形,硬膜外、硬膜下和髓内均有出血(下图)。
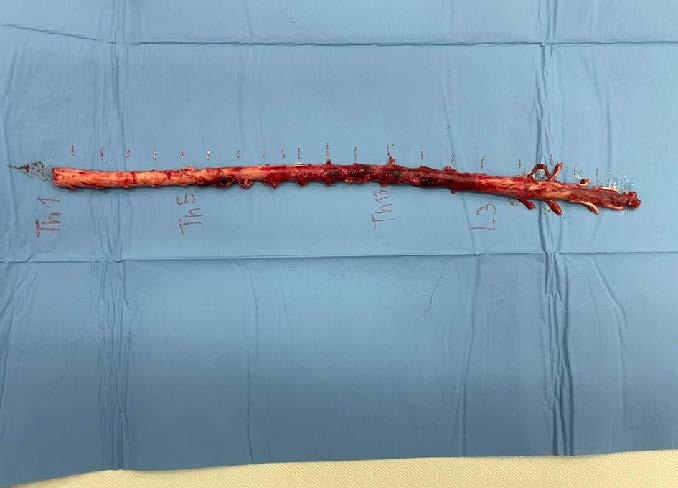
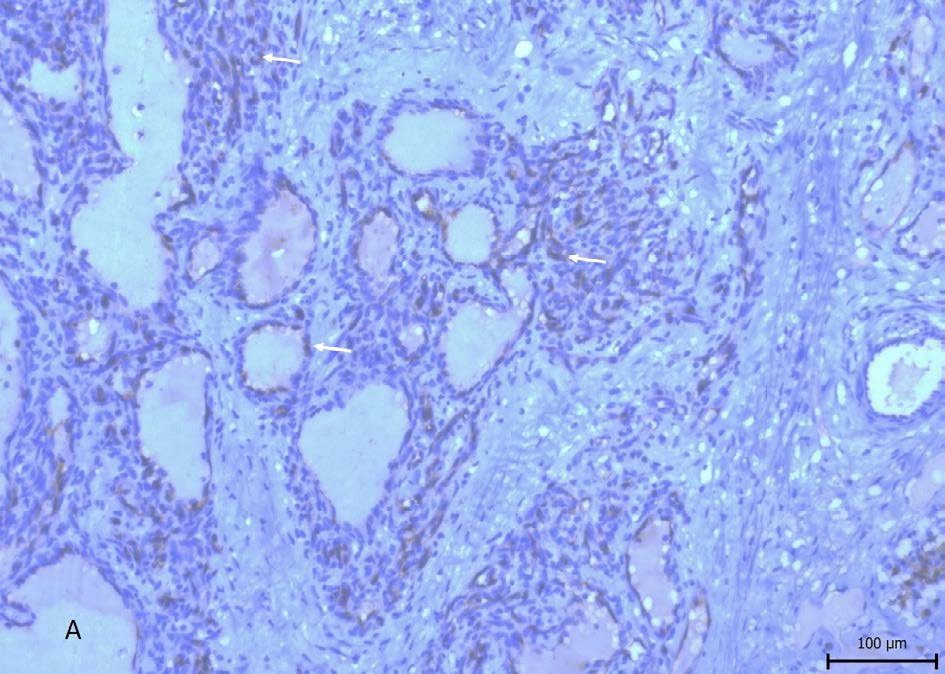
来自T5-T6、T10-T11和L1-L2节段的脊髓标本进行组织病理学检查。这些标本经过常规组织学处理(HE)和免疫组化处理(L1,CD 31)(下图)。
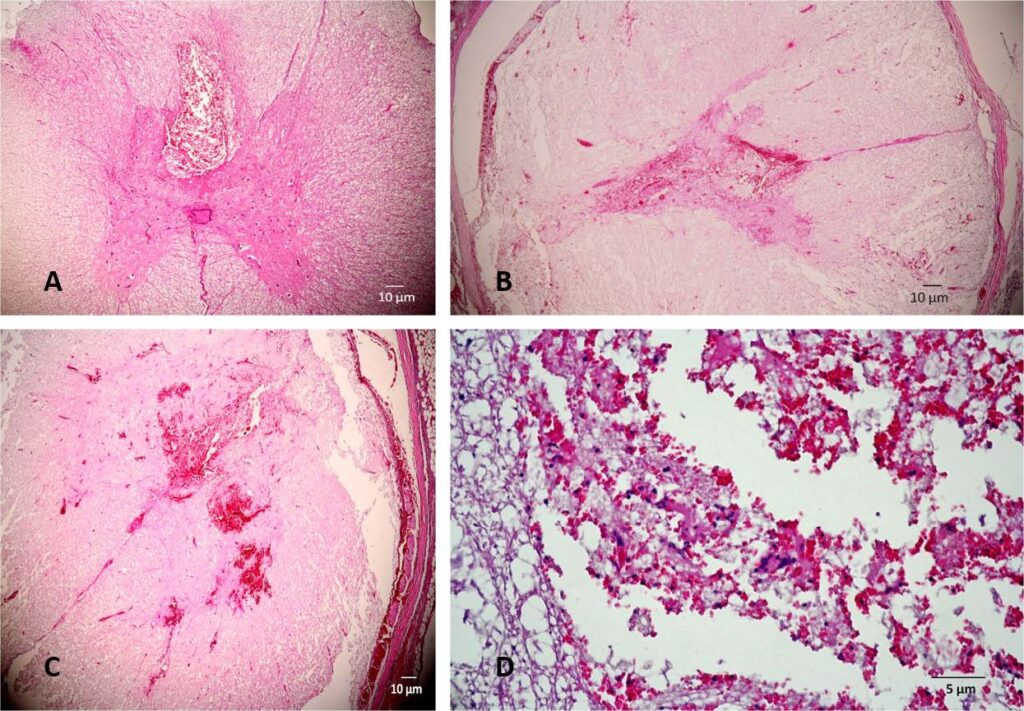
T5-T6标本中,中央管内充满了粉红色的均匀液体,在灰质和白质的脊髓背柱之间,可见广泛的卵圆形出血,出血范围相对有限,没有炎症浸润,破坏了脊髓神经组织的完整性。脊髓周围组织中有瘀血的小毛细血管(下图)。
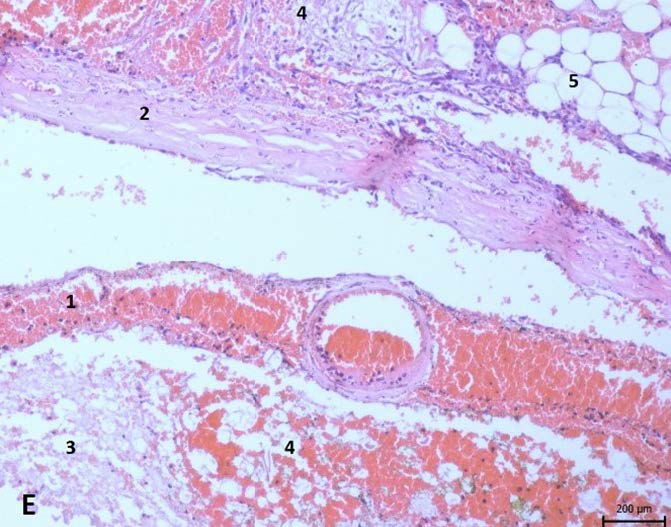
在T10-T11切片中,与T5标本相比,出血部位的脊髓实质原有的破坏并不明显。观察到更多的毛细血管、外渗和脊髓实质水肿。这些变化不仅出现在白质和灰质中,也出现在脊髓脑膜中(下图)。
在L1-L2水平的脊髓切片中也出现了同样的弥漫性出血,但在硬脑膜上方也发现了血管。
内皮呈纺锤形,核内很少出现病理性有丝分裂。有局灶性中性粒细胞浸润,神经元内有血色素积聚,血色素游离存在于外渗区域的梭形细胞内。诊断结果为血管肉瘤。
04 讨论
犬的脊髓肿瘤根据其在脊髓中的位置分为原发性和继发性,以及硬膜外肿瘤(最常见,占50%)、硬膜内-髓外肿瘤(占30%)和髓内肿瘤(罕见,占15%)。原发性脊髓肿瘤在大多数家养动物中都比较罕见,但狗和猫除外。
在狗中,最常见的脊髓肿瘤是脑膜瘤,主要影响颈椎节段。狗的髓内脊髓肿瘤也很罕见,主要是胶质细胞瘤、星形细胞瘤、少突胶质细胞瘤、未分化肉瘤、上皮瘤和脉络丛乳头状瘤。
原发性硬膜外肿瘤通常在幼犬(6个月至3岁)中确诊。它们分为神经上皮瘤、上皮瘤、髓上皮瘤、肾母细胞瘤和脊柱胚芽瘤。
影响犬脊髓的最常见继发性肿瘤是血管肉瘤。血管肉瘤和淋巴瘤往往会侵入脊髓髓内,继发性转移性疾病也以乳腺腺癌和恶性黑色素瘤的形式出现[1-5]。
脊髓髓外肿瘤通常生长缓慢,并逐渐压迫脊髓。脊髓功能障碍的症状会在数周或数月内恶化。有些临床症状的急性发作可能与肿瘤引起的出血或缺血有关。髓内肿瘤生长较快,缺血、坏死和出血的发生率较高。
与脊髓肿瘤相关的临床症状通常反映出肿瘤的位置,而且往往与同一部位的其他横贯性骨髓病引起的症状没有区别。脊髓过度兴奋是脑膜肿瘤和脊神经根或神经片肿瘤的临床表现之一,会导致不同程度的不适。
血管肉瘤是一种血管内皮来源的肿瘤,常见于犬,除了一种非常常见的内脏型血管肉瘤外,皮肤也是它的好发部位。内脏血管肉瘤没有好发部位,通常累及脾脏、右心房和肝脏。它们被认为是高度转移性肿瘤,80%以上的病例会出现播散性肿瘤[6,7]。
在本病例中,没有发现其他器官有原发肿瘤的迹象。Aschenbroich等人描述了一只瘫痪的金毛猎犬的内脏和播散性血管肉瘤,脊髓、心脏和肺部均受累[8]。在
大多数病例中,由于肿瘤同时存在于多个器官,因此很难区分是多中心过程还是转移过程。在Mallol等人进行的一项多中心、回顾性病例系列研究中,椎体血管肉瘤是节段性的、边缘不清的、多骨质的、侵袭胸椎椎管和脊柱旁组织的侵袭性非常强的病变。硬膜外血管肉瘤是胸腰部和/或腰部的单发、界限清楚的病变。髓内血管肉瘤为颈部血管肉瘤,有转移来源,经常(3/4)伴有颅内病变[9]。
本文作者认为该病例中脊髓内的血管肉瘤是原发性的,而不是转移性的,尽管不能完全排除转移源。
参考文献
[1] Drost WT, Love NE, Berry CR. Comparison of radiography, myelography and computed tomography for the evaluation of canine vertebral and spinal cord tumors in sixteen dogs. Vet Radiol Ultrasound. 1996;37(1):28-33.
[2] Le Couter RA, Withrow SJ. Tumors of the nervous system. In: Withrow SJ, Vail DM, editors. Withrow MacEwen’s small animal clinical oncology. St. Louis: Elsevier; 2007. p. 659-85.
[3] Bagley RS. Spinal neoplasms in small animals. Vet Clin North Am: Small Anim Pract. 2010 Sep;40(5):915-27.
[4] Pancotto TE, Rossmeisl JH Jr, Zimmerman K, Robertson JL, Werre SR. Intramedullary spinal cord neoplasia in 53 dogs (1990–2010): Distribution, clinicopathologic characteristics, and clinical behavior. J Vet Intern Med. 2013 Nov-Dec;27(6):1500-8.
[5] Higgins RJ, Bollen AW, Dickinson PJ, Siso-Llonch S. Tumors of the nervous system. In: Meuten DJ, editor. Tumors in domestic animals. CA, USA: John Wiley & Sons; 2017. p. 834-91.
[6] Hargis AM, Ihrke PJ, Spangleran WL, Stannard AA. A retrospective clinicopathologic study of 212 dogs with cutaneous hemangiomas and hemangiosarcomas. Vet Pathol. 1992 Jul;29:(3)316-28.
[7] Smith AN. Hemangiosarcoma in dogs and cats. Vet Clin North Am Small Anim Pract. 2003 May;33:533-52.
[8] Aschenbroich S, Woolcock A, Rissi DR. Paraparesis in a Golden Retriever. Vet Pathol. 2014 Sep;51(5):996-9.
[9] Mallol C, Gutierrez-Quintana R, Hammond G, Schweizer-Gorgas D, De Decker S, Novellas R, Espada Y, Oevermann A, Ortega M, Parry A, Coelho AM. MRI features of canine hemangiosarcoma affecting the central nervous system. Vet Radiol Ultrasound. 2022 Mar;63:185-96.