
| 一般情况 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:10岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:心包积液病因不明 | |
01 主诉及病史
4天前出现嗜睡、食欲下降和呼吸困难。
这只猫住在室内,极少外出,间歇性地接受局部赛拉霉素治疗,疫苗接种也在进行中。两位主人在猫发病前6周对COVID-19检测呈阳性反应。
02 检查
呼吸困难,心音低沉。由于主人曾感染过COVID-19,根据医院规定,猫被隔离住院,在进行新冠病毒PCR检测之前,初步诊断受到限制。
超声心动图检查发现心包有1.5 cm低回声积液和少量胸腔积液(转诊前已清除140 mL胸腔积液)。血液动力学稳定,没有心脏结构异常。
夜间临床症状恶化,呼吸急促发展为呼吸困难,并出现低血压。超声检查显示有心包填塞,需要进行心包穿刺。患者接受了静脉注射丁吗啡诺、氯胺酮和阿法沙龙镇静和镇痛。穿刺出约60 mL血性心包积液和少量胸腔积液,并将其送去进行评估。
心包积液中细胞明显增多,有核细胞计数和总蛋白与嗜酸性粒细胞增多的出血性渗出物一致(下表)。
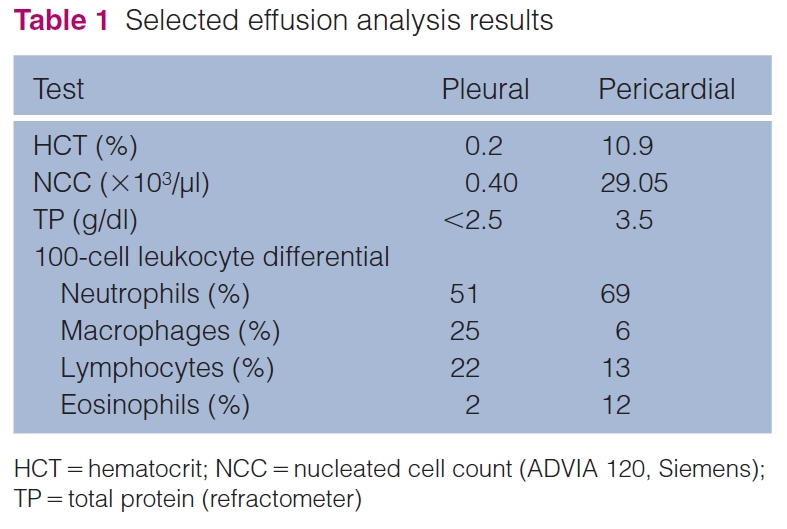
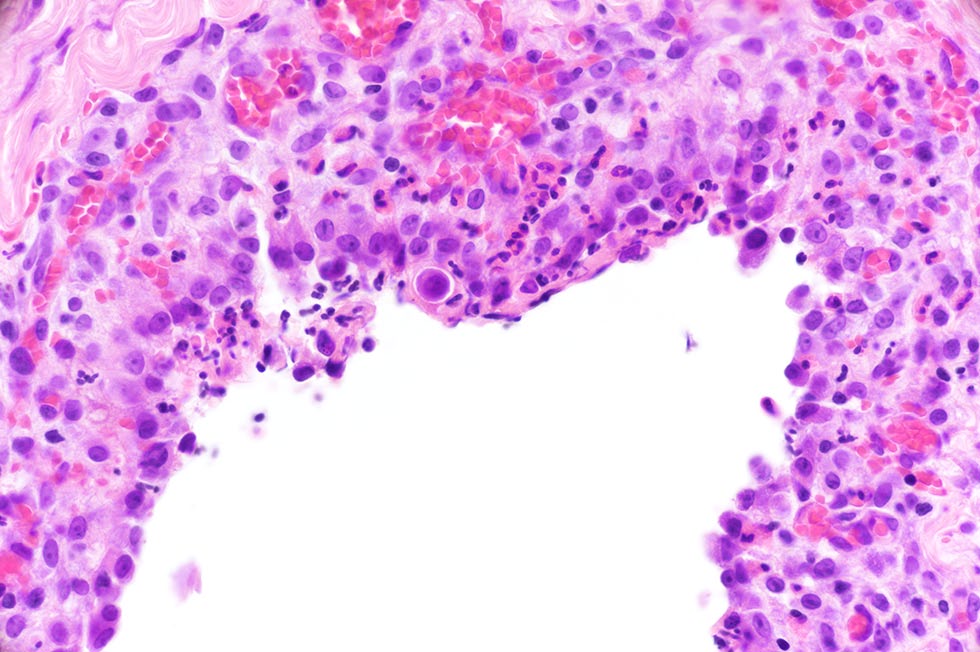
大量单个和聚集的大圆形非典型细胞伴有中度到明显的异形细胞增多(下图)。
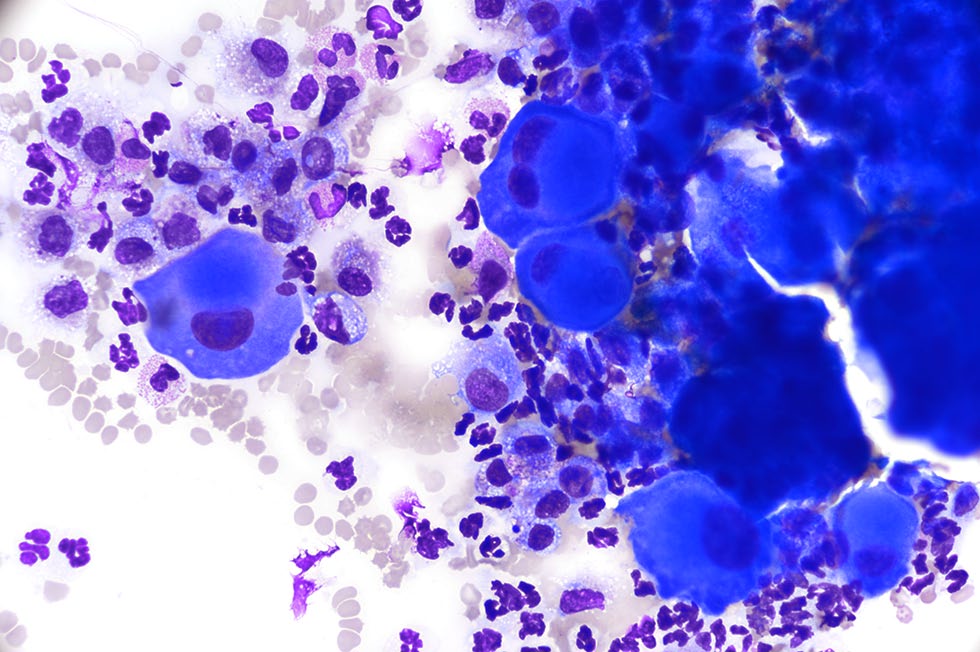
可见大量多核细胞(多达9个核),显示中度至明显的异核现象,核仁大而突出,偶尔可见核成型(下图)。
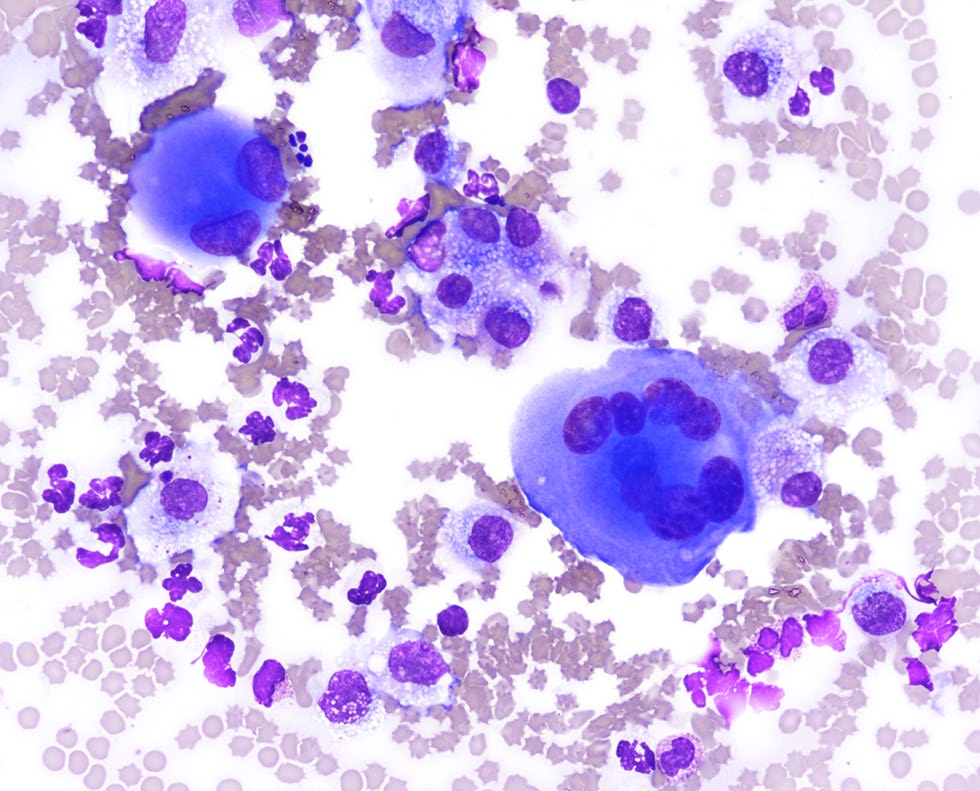
胸腔积液被解释为渗出液,其中有少量疑似反应性间皮细胞,但不能排除肿瘤细胞群。胸腔积液需氧和厌氧细菌培养均未发现生长。未进行真菌培养。
细胞有大量深蓝色胞质,少数细胞显示粉红色胞质边缘。细胞学解释为嗜酸性粒细胞出血性渗出,细胞群不典型,可能为肿瘤,但也不排除炎症或慢性积液导致间皮细胞高度发育不良的可能性。
住院第三天,新冠病毒鼻拭子结果为阴性,因此可以进一步进行影像学诊断。影像学检查结果发现右颅肺叶塌陷和尾腹纵隔不透明。腹部超声检查未发现明显异常。胸部CT显示持续性中度心包积液,心包轻度增厚,胸腔少量积液。
在最初的胸腔穿刺术和心包穿刺术后,患者的临床症状一直很稳定,但持续的心包积液促使医生建议患者进行诊断性和治疗性心包切除术,并进行巴尔通体血清学检查。主人报告说,几年前她因被患者抓伤而被诊断患有巴尔通体病。
03 手术
患者接受了右侧胸腔镜下心包次全切除术,术后恢复顺利,手术部位注射了布比卡因脂质体混悬液,并持续静脉注射芬太尼和氯胺酮。
患者开始接受为期8周的抗巴尔通体治疗(普拉多沙星、多西环素)。在整个住院期间,患者接受了连续的全血细胞计数检查,未发现外周血嗜酸性粒细胞增多。血液学、生化学和尿液分析结果均无明显异常。9天后出院。
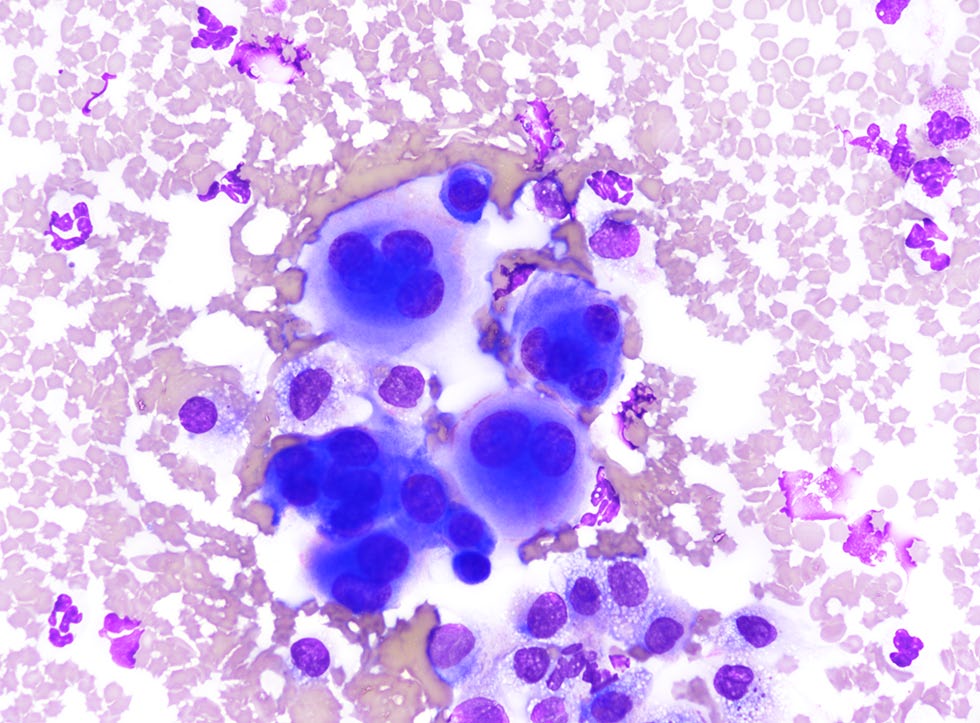
手术组织病理学显示,心包旁肉芽组织明显扩张(下图)。
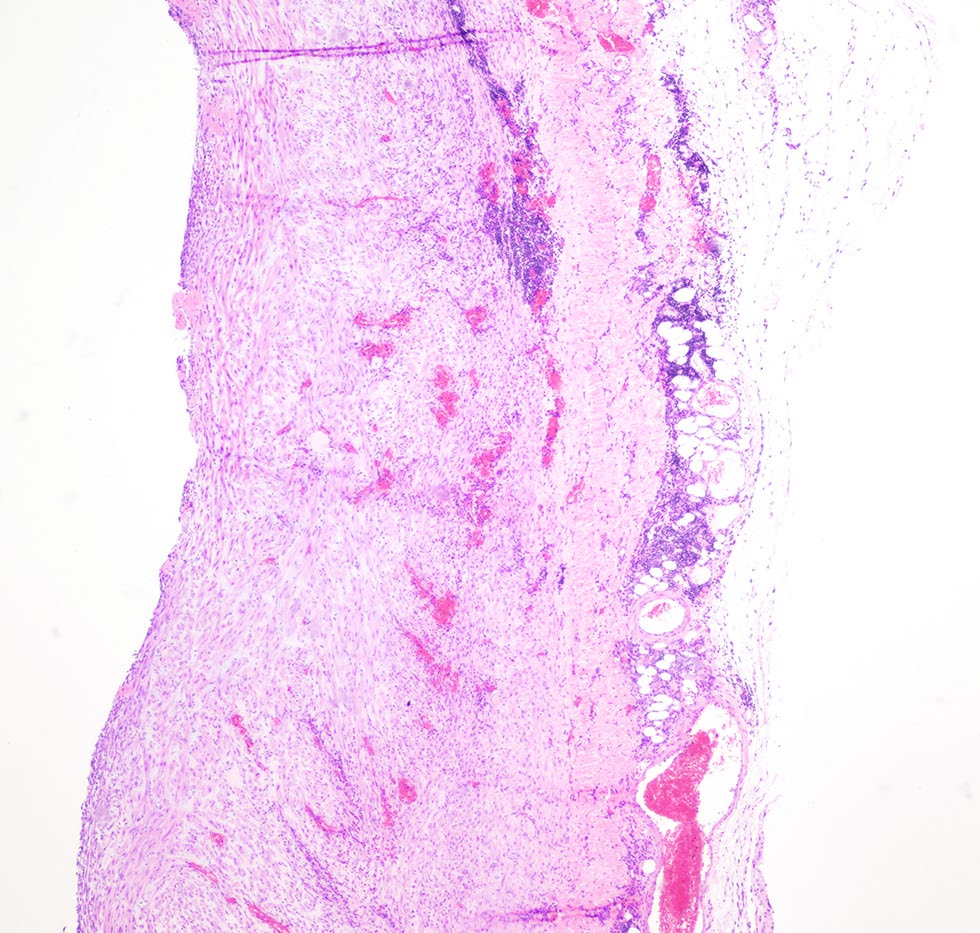
血管周围有大量炎性细胞浸润,主要是嗜酸性粒细胞,被肥厚的间皮细胞覆盖(下图)。
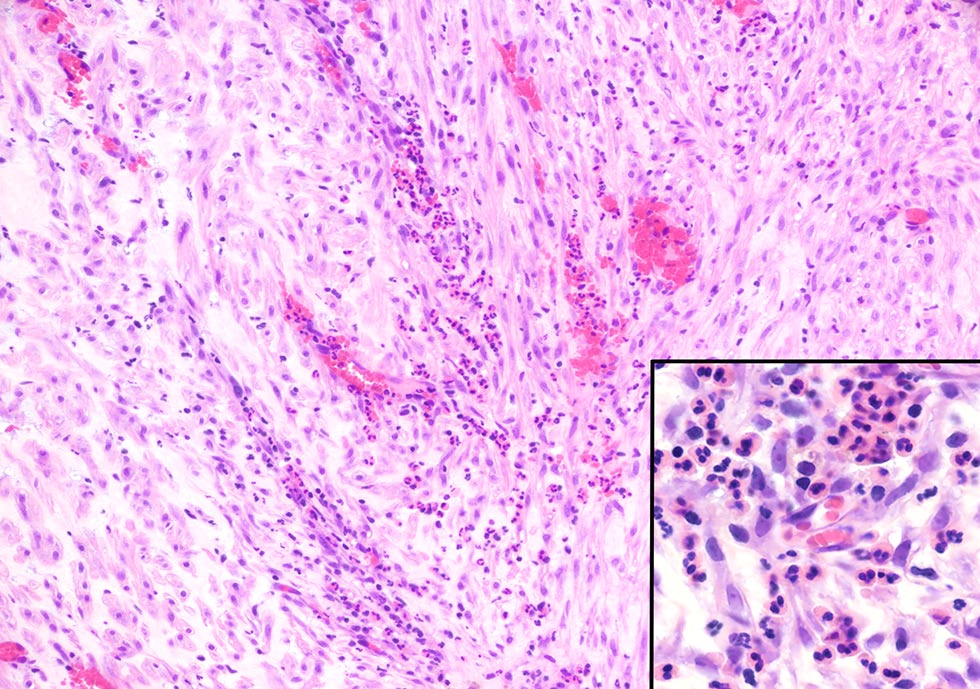
形态学诊断为明显的慢性、弥漫性嗜酸性粒细胞、中性粒细胞和淋巴细胞性纤维蛋白性心包炎,伴有多灶性间皮细胞肥大、溃疡和慢性出血。没有肿瘤或感染性病原体的证据。
心包的猫冠状病毒免疫组化染色、Warthin-Starry嗜螨感染性有机体染色、Gomori甲氰胺银和PAS原生动物和真菌特殊染色均为阴性。
由于没有其他诊断方法,且很难明确排除巴尔通体感染,因此患者接受了为期8周的普拉多沙星和强力霉素治疗。
弓形虫滴度显示IgM滴度持续弱阳性,但IgG滴度没有增加,表面之前接触过或潜在的弓形虫再活化。
对胸腔积液、心包积液和死后送回的心包使用梨形虫/巴尔通体/疏螺旋体进行PCR检测,结果在心包积液中检测到了文氏巴尔通体亚种berkhoffii的DNA。从为期14天的外周血液体富集培养液中扩增出了梨形虫DNA。经过DNA浓缩和qPCR检测,部分18S rRNA基因DNA序列与一种顶复门原生生物Colpodella(GenBank编号:FJ410758)有90%的同源性。
04 预后
心包切除术4周后复查时,胸部超声检查没有发现复发性渗出。
出院3个月后,该猫在另一家医院发现胸腔积液复发,经胸腔穿刺术进行了处理。不久后,患者被安乐死,没有进行尸检。
05 讨论
猫心包积液并不常见,尸检报告显示其发生率为1-2.3%[3,4]。猫因心脏疾病(各种心肌病)导致充血性心力衰竭时,心包积液通常较少,这是猫心包积液最常见的原因[5,6]。肿瘤性病因包括淋巴瘤、癌和间皮瘤。感染性病因包括猫传腹、细菌性心包炎、隐球菌病、弓形虫病、猫白血病病毒和泛白细胞减少症。炎症性疾病、尿毒症和凝血功能障碍也与心包积液有关[3-6]。
可能导致心脏填塞的大量积液在猫中非常罕见[6]。虽然它们可能是由于潜在的心脏疾病引起的,但大量积液通常与肿瘤或感染有关[5,7,8]。在本患者中,由于胸腔穿刺前的超声检查观察到大量心包积液,因此怀疑发生了心包填塞。复发性胸腔积液可能是导致临床失代偿的原因之一。
由于猫科动物心包积液的特点是体积小,且经常与心肌病相关,因此很少对其进行采样。当体积或临床症状促使进行治疗性或诊断性心包穿刺时,报告的细胞学结果仅限于最相关的诊断特征(如淋巴母细胞、感染性病原体)或简短的解释性结果(如乳糜性渗出、间皮细胞增生)[5,7,8]。
心包积液细胞学检查的主要用途是评估淋巴瘤、炎症或感染性疾病。脱落的间皮细胞是一种预料之中的发现,反应性或发育不良的细胞往往显示出恶性的标准,因此在许多病例中很难甚至不可能明确区分反应性间皮细胞和肿瘤细胞(主要是癌或间皮瘤)[9,10]。
在本病例中,反应性间皮细胞密集成群,具有较典型的反应性,但也经常出现大的非典型细胞。观察到的恶性肿瘤标准包括多核、明显的异形细胞增多、明显的异形核分裂、核成型和拥挤、突出的核小体和异核。这些发现,再加上临床表现,促使人们将非典型细胞解释为肿瘤,并与间皮瘤和癌进行初步鉴别。
要区分反应性间皮细胞增生和肿瘤,必须对足够大的组织样本进行组织病理学评估,免疫组化通常用于进一步确定肿瘤群体的特征[11]。本病例采用胸腔镜下心包次全切除术进行治疗和诊断。提交了两张相对较大的组织切片(最大尺寸为2.5×2.5×0.2 cm),以便对心包变化进行可靠评估,并排除影响心包的肿瘤过程。在大约6天后获得的组织学样本中,细胞学检查发现的间皮细胞明显不典型。
猫是多种巴尔通体的天然宿主,在健康猫和伴有心内膜炎和心内膜炎等病变的猫中都能发现[19 -21]。常用的诊断方法包括血清学、培养(通过巴尔通体α蛋白杆菌生长培养基)、PCR 和组织免疫组化;但是,排除巴尔通体感染的可信度仍然不高[1,20]。
近年来,中国研究人员报告了感染了与顶复门(Apicomplexa)关系密切的成员Colpodella的两名人类患者(其中一名患者有长期乏力、溶血性贫血和红细胞内有机体病史,另一名患者有神经系统症状)[22]。
在系统发育上,Colpodella与致病原生动物沙眼衣原体、弓形虫和巴贝西虫关系密切[23]。从这只猫的增殖血培养液中获得的序列是否为Colpodella与这只猫的嗜酸性心包炎和渗出物是否有临床意义尚不清楚。
胸腔积液复发的原因可能是不明的感染病因、不明的肿瘤或不明的炎症。由于缺乏尸检,嗜酸性粒细胞性心包炎和积液的病因仍然不明。细胞学检查中反应性间皮细胞明显不典型,而组织学样本中却没有这种细胞,这为心包积液细胞学解释提供了一个值得警惕的例子,尤其是在不常描述的猫科动物样本中。
参考文献
1. Maggi RG, Richardson T, Breitschwerdt EB, et al. Development and validation of a droplet digital PCR assay for the detection and quantification of Bartonella species within human clinical samples. J Microbiol Methods 2020; 176.
2. Liedig C, Neupane P, Lashnits E, et al. Blood supplementation enhances Bartonella henselae growth and molecular detection of bacterial DNA in liquid culture. Microbiol Spectrum 2023; 11.
3. Davidson BJ, Paling AC, Lahmers SL, et al. Disease association and clinical assessment of feline pericardial effusion. J Am Anim Hosp Assoc 2008; 44: 5–9.
4. Rush JE, Keene BW, Fox PR. Pericardial disease in the cat: a retrospective evaluation of 66 cases. J Am Anim Hosp Assoc 1990; 26: 39–46.
5. Hall DJ, Shofer F, Meier CK, et al. Pericardial effusion in cats: a retrospective study of clinical findings and outcome in 146 cats. J Vet Intern Med 2007; 21: 1002–1007.
6. Côté E, MacDonald KA, Meurs KM, et al. Pericardial effusion and other disorders of the pericardium. In: Côté E, MacDonald KA, Meurs KM, et al. (eds). Feline cardiology. Chichester: John Wiley & Sons, Inc., 2011, pp 343–349.
7. Nelissen P, Tappin S, Smith P, et al. Thoracoscopic pericardiectomy for the management of a neoplastic pericardial effusion. Companion Anim 2013; 18: 484–487.
8. LeBlanc N, Scollan KF. Bacterial pericarditis in a cat. JFMS Open Rep 2015; 1.
9. Thompson CA, Rebar AH. Body cavity fluids. In: Raskin RE, Meyer DJ. (eds). Canine and feline cytology: a color atlas and interpretation guide. 3rd ed. St. Louis, MO: Elsevier, 2016, pp 191–219.
10. Garrett LD. Miscellaneous tumors. In:Vail DM, Thamm D, Liptak J. (eds). Withrow and Macewen’s small animal clinical oncology. 6th ed. St. Louis, MO: Elsevier, 2020, pp 784–787.
11. Munday JS, Löhr CV, Kiupel M. Tumors of the alimentary tract. In: Meuten DJ. (ed). Tumors in domestic animals. 5th ed. Ames, IA: John Wiley & Sons, 2016, pp 592–595.
12. Adelman M, Albelda SM, Gottlieb J, et al. Diagnostic utility of pleural fluid eosinophilia. Am J Med 1984; 77: 915–920.
13. Fossum TW, Wellman M, Relford RL, et al. Eosinophilic pleural or peritoneal effusions in dogs and cats: 14 cases (1986-1992). J Am Vet Med Assoc 1993; 202: 1873–1876.
14. Cowgill E, Neel J. Pleural fluid from a dog with marked eosinophilia. Vet Clin Pathol 2003; 32: 147–149.
15. Prado Checa I, Woods GA, Oikonomidis IL, et al. Eosinophilic pericardial effusion in a cat with complex systemic disease and associated peripheral eosinophilia. J Vet Cardiol 2021; 35: 55–62.
16. Piech TL, Jaffey JA, Hostnik ET, et al. Bicavitary eosinophilic effusion in a dog with coccidioidomycosis. J Vet Intern Med 2020; 34: 1582–1586.
17. Miller BH, Roudebush P, Ward HG. Pleural effusion as a sequela to aelurostrongylosis in a cat. J Am Vet Med Assoc 1984; 185: 556–557.
18. Takeuchi Y, Takahashi M, Tsuboi M, et al. Intestinal T-cell lymphoma with severe hypereosinophilic syndrome in a cat. J Vet Med Sci 2012; 74: 1057–1062.
19. Perez C, Hummel JB, Keene BW, et al. Successful treatment of Bartonella henselae endocarditis in a cat. J Feline Med Surg 2010; 12: 483–486.
20. Álvarez-Fernández A, Breitschwerdt EB, Solano-Gallego L. Bartonella infections in cats and dogs including zoonotic aspects. Parasit Vectors 2018; 11.
21. Weeden AL, Cherry NA, Breitschwerdt EB, et al. Bartonella henselae in canine cavitary effusions: prevalence, identification, and clinical associations. Vet Clin Pathol 2017; 46: 326–330.
22. Xu M, Hu Y, Qiu H, et al. Colpodella sp. (phylum Apicomplexa) identified in horses shed light on its potential transmission and zoonotic pathogenicity. Front Microbiol 2022; 13.