
| 一般情况 | |
|---|---|
 | 品种:泰迪贵宾犬 |
| 年龄:12岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:高血压危象 | |
01 主诉及病史
体检发现右侧肾上腺肿块和左肾囊肿。
该犬之前曾被诊断患有肌瘤性二尖瓣病和胆汁淤积症。口服匹莫本丹、二硝酸异山梨酯、茶碱和熊去氧胆酸。
02 检查
心率(138 次/分)和血压(收缩压、平均血压和舒张压分别为141、115和103 mmHg)均正常。听诊发现Ⅲ/Ⅵ级收缩期杂音。由于患者气喘,因此无法获得呼吸频率。胸部放射线检查未发现异常。
经胸超声心动图显示二尖瓣反流(峰值速度为5.4 m/s),无左心房扩张。二尖瓣E波速度为0.9-1.0 m/s。腹部超声显示右肾上腺增大(最大宽度为27 mm),胆汁淤积回声减弱。很难确定增大的肾上腺是否有血管侵犯。尿游离正肾上腺素与肌酐的比值较高(259.05),提示为嗜铬细胞瘤。
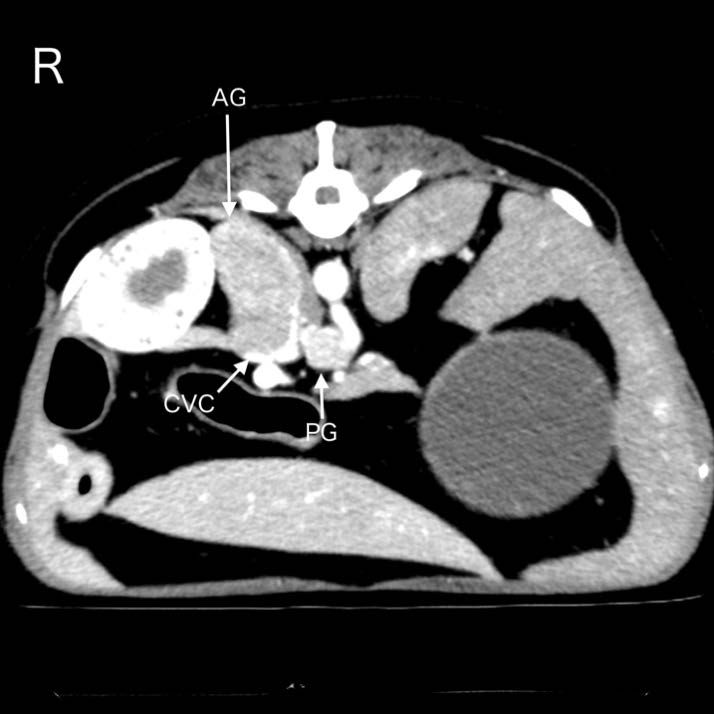
CT扫描显示右侧肾上腺肿块侵入尾腔静脉(下图)。腹腔动脉和肠系膜动脉周围肿块疑似副神经节瘤。
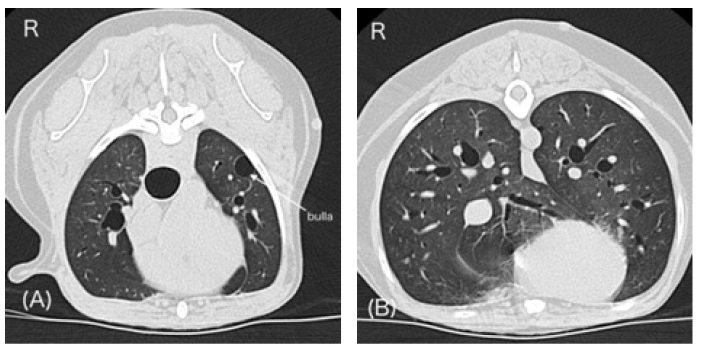
肺部CT图像正常(下图)。
03 高血压危象
完成CT检查转入病房约15分钟后,该犬出现呼吸困难和鼻出血。口腔黏膜苍白,收缩压大于200 mmHg,SpO2为70-80%。脉搏没有记录。怀疑发生了高血压危象,静脉注射0.01 mg/kg乙酰丙嗪以扩张血管和镇静。在吸出上气道的血液和分泌物后,通过面罩或导流管供氧。
经过这些治疗后,患者的血压有所下降。收缩压和平均血压分别为140和100 mmHg。但尽管进行了吸氧,SpO2仍保持在90%左右,呼吸困难明显。
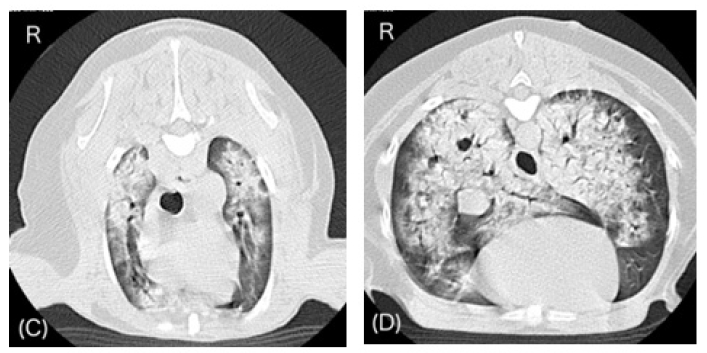
肺部超声显示左侧尾背和肺周区域出现了提示通气性肺部合并症的影像。在左肺还观察到多条提示湿肺的B线。麻醉恢复90分钟后拍摄的清醒CT显示肺部严重合并症,所有肺野都有气管影(下图),因此决定在血流动力学稳定的情况下启动呼吸机支持。
用0.2 mg/kg静脉注射丁吗啡和丙泊酚麻醉。插管后,用1.5%异氟醚混合氧气(1 L/min)通过循环再呼吸系统和带有回路外蒸发器的麻醉机维持自主呼吸,并使用手动半封闭可调限压阀调节5 cmH2O呼气末正压以支持通气。还静脉注射了1 mg/kg呋塞米以降低肺毛细血管渗透压。
呼吸支持3小时后,肺部CT图像显示病情略有好转。治疗期间,脉搏和血压分别为108-140次/分和81-92 mmHg。呼吸频率介于43-48次/分之间,潮气末二氧化碳浓度介于32-35 mmHg。SpO2保持在96-100%。
第三次CT扫描后,动脉血氧分压(PaO2)和二氧化碳分压(PaCO2)分别为152和46 mmHg。PaO2与吸入氧分数的比值(P/F比值)为152,诊断为急性呼吸衰竭导致的严重氧合衰竭。在获得知情同意后,决定在ICU实施更积极的通气治疗。
为患者连接了重症监护呼吸机,并停止了异氟醚麻醉。使用丙泊酚和芬太尼以恒速输注(分别为0.3 mg/kg/min和0.1 μg/kg/min)维持全身麻醉。为了保持患者的呼吸同步,额外静脉注射了丙泊酚、芬太尼或咪达唑仑。
使用持续气道正压(CPAP)进行压力支持通气,并维持通气一夜。初始通气设置为:支持压力8 cm H2O(ΔP support);CPAP 5 cmH2O;压力上升到目标压力的时间0.15秒;呼气触发灵敏度30%;流量触发1.0 L/min。通气时,ΔP support范围为7-10 cmH2O,潮气量为8-14 mL/kg。
到第二天早上,吸入氧分压(FiO2)逐渐下降到30%,而SpO2则保持在95%以上。除了通气管理外,还每4小时静脉注射0.01 mg/kg乙酰丙嗪,以增加镇静和预防高血压。液体疗法包括低渗晶体液(1 mL/kg/h)。包括其他药物在内的总输液量按2-3 mL/kg/h计算。静脉注射三次呋塞米(0.5或1 mg/kg)维持体液负平衡。头孢唑啉(20 mg/kg IV)作为预防性抗生素每8小时给药一次。通气期间,患者的血流动力学保持稳定,自主呼吸频率逐渐降至20-30次/分。
04 预后
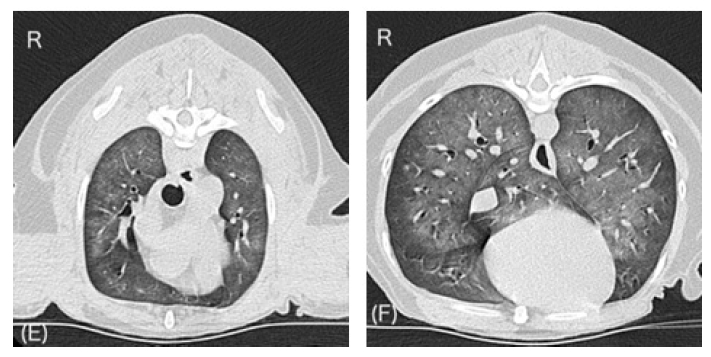
在重症监护室通气14小时后的早晨,PaO2和PaCO2分别为93和33 mmHg。P/F比值为 310。通气设置为 ΔP support 7 cmH2O;CPAP 5 cmH2O;FiO2 0.3。在肺部超声波中仅观察到几条B线。肺部CT图像也有所改善(下图)。
在重症监护室通气15小时后(呼吸衰竭发生24小时后),开始尝试让患者脱离呼吸机。停止恒速输液。10分钟后拔出气管插管。在拔出的导管顶端观察到血痰粘附。在鼻腔供氧0.5L/min的情况下,SpO2为96%。PaO2和PaCO2分别为77和27 mmHg。体重比呼吸衰竭发生前减少了170 克。住院期间,作为预防性抗生素使用了头孢唑啉和恩诺沙星。还恢复了匹莫苯丹的口服治疗。拔管后继续吸氧24小时。
该犬在3天后出院。狗主人拒绝对腹内病变进行额外治疗。该犬在停止机械通气后存活了14个月,期间未出现任何呼吸或神经系统并发症。
05 讨论
发生呼吸衰竭的原因是疾病或损伤导致肺部输送氧气或清除二氧化碳的能力下降[1]。急性呼吸衰竭的症状会突然出现,并可能危及生命,需要立即用药或补充氧气。如果氧合或通气功能严重受损,则需要长期机械通气。机械通气治疗犬呼吸系统疾病的预后在很大程度上取决于潜在的疾病[2-7]。
在人类中,急性肺水肿是嗜铬细胞瘤高血压危象的表现之一。它可以是心源性的,也可以是非心源性的[8]。在犬中,之前的一篇综述文章将肺水肿描述为嗜铬细胞瘤高血压危象的并发症[9]。然而,关于犬高血压危象后急性呼吸衰竭的发病和治疗,此前尚未见报道。
高血压危象是嗜铬细胞瘤和副神经节瘤的主要并发症[8,9]。在人类中,急性肺水肿是嗜铬细胞瘤高血压危象的一种表现,可以是心源性或非心源性肺水肿[8,9]。
心源性肺水肿更为常见,可能是由于儿茶酚胺诱发的心肌病,包括扩张型心肌病、肥厚型心肌病或人类的塔克图博心肌病[8,10]。然而,在本病例中,除了轻度至中度MMVD外,未发现心血管异常,麻醉前检查也未发现左心房压力升高导致心源性肺水肿的证据。在机械通气期间,超声心动图检查也没有发现提示这些心肌病变的结果,而且在没有使用心血管药物的情况下,血流动力学保持稳定。
另一方面,非心源性肺水肿在人类中非常罕见[8]。嗜铬细胞瘤导致非心源性肺水肿的原因与神经源性肺水肿相似。神经源性肺水肿的发病机制也与儿茶酚胺风暴有关[11-13]。在这种病理情况下,高浓度儿茶酚胺会因大量血管收缩而导致肺毛细血管压力突然升高,并改变肺毛细血管的通透性[11-13]。遗憾的是,本病例没有在高血压危象期间测量血浆儿茶酚胺水平,因此缺乏本病例中儿茶酚胺风暴的直接证据。初次检查当天观察到尿液中游离的去甲肾上腺素与肌酐的比率很高,这表明儿茶酚胺风暴在该患者中是可能存在的。
犬神经源性肺水肿的常见影像学表现为双侧、对称、多灶、肺泡与肺间质混合型,集中于尾部肺叶或分布于所有肺野[14]。该犬的CT和肺部超声图像与之前的报道一致。推测该犬急性呼吸衰竭的主要发病机制是非心源性肺水肿,如儿茶酚胺风暴诱发的神经源性肺水肿。MMVD的存在可能加剧了肺水肿。
严重心源性肺水肿常见的有痰咳嗽伴有粉红色泡沫状鼻涕或痰液[15],但在这只狗上没有观察到。此外,在机械通气期间也不需要进行气管插管抽吸。在拔出的气管导管顶端观察到少量血痰,但这可能是高血压危象后吸入鼻腔出血所致。
起初还怀疑本病例的急性呼吸困难是由于高血压危象导致鼻出血引起的上呼吸道阻塞造成的。然而,尽管通过镇静、吸痰和张口等措施确保上呼吸道通畅,但仍未发现呼吸状况有所改善,而且在进行CT检查时也未发现气道阻塞。
本病例肺水肿的发生和发展极为迅速。在启动重症监护室通气之前,根据P/F比值检测到了严重的氧合衰竭。对该犬的肺水肿治疗采用了机械通气和负液体平衡(根据体重测量值为负 170 克),并服用了呋塞米。
该犬采用了CPAP压力支持通气,以减少自发呼吸,改善氧合。治疗反应良好,肺水肿得到改善,在机械通气24小时后拔管。与本病例类似,也有关于犬神经源性肺水肿快速发病和恢复的报道[2,6,7,12,13]。
在接受机械通气治疗的神经源性肺水肿犬中,观察到了很高的死亡率[2,7]。不利的结果归因于潜在疾病的严重程度,而不是肺水肿或机械通气的并发症[2,12,13]。在本病例中,机械通气期间没有观察到额外的高血压危象。为控制嗜铬细胞瘤的高血压危象,通常使用短效注射用α-受体阻滞剂,如酚妥拉明。另一方面,长效口服α-受体阻滞剂(如苯氧苄胺)常用于术前稳定嗜铬细胞瘤的病情[16]。
乙酰丙嗪是一种长效注射型镇静剂,同时具有α1受体阻滞作用。在重症监护室通气期间使用乙酰丙嗪的主要原因是希望这只狗能获得血流动力学稳定,类似于嗜铬细胞瘤术前α-受体阻滞剂治疗。同时,乙酰丙嗪可能有助于机械通气期间的镇静。
本病例报道了一只因高血压危象导致急性呼吸衰竭、需要机械通气治疗24小时的狗成功脱机并出院的过程。该犬的肺水肿可能与嗜铬细胞瘤或副神经节瘤引起的儿茶酚胺风暴有关。肺水肿的发生和发展都非常迅速,不过改善也很快。除了及时诊断和积极的机械通气干预外,血液动力学的稳定也可能有助于良好的预后。
参考文献
[1] Summers C, Todd R.S, Vercruysse G.A, Moore F.A. Acute respiratory failure. Perioper. Med. 2022;2022:576–586.
[2] Drobatz K.J, Saunders H.M, Pugh C.R, Hendricks J.C. Noncardiogenic pulmonary edema in dogs and cats: 26 cases (1987-1993) J. Am. Vet. Med. Assoc. 1995;206:1732–1736.
[3] Hopper K, Haskins S.C, Kass P.H, Rezende M.L, Aldrich J. Indications, management, and outcome of long-term positive-pressure ventilation in dogs and cats: 148 cases (1990-2001) J. Am. Vet. Med. Assoc. 2007;230:64–75.
[4] Edwards T.H, Erickson Coleman A.E, Brainard B.M, DeFrancesco T.C, Hansen B.D, Keene B.W, Koenig A. Outcome of positive-pressure ventilation in dogs and cats with congestive heart failure: 16 cases (1992-2012) J. Vet. Emerg. Crit. Care. (San Antonio) 2014;24:586–593.
[5] Cagle L.A, Hopper K, Epstein S.E. Complications associated with long-term positive-pressure ventilation in dogs and cats: 67 cases. J. Vet. Emerg. Crit. Care. (San Antonio) 2022;32:376–385.
[6] Herrería-Bustillo V.J, Adamantos S, Lamb C.R, García-Arce M, Thomas E, Saiz-Álvarez M.R, Cook S, Cortellini S. Retrospective evaluation of negative-pressure pulmonary edema in dogs (2006-2018): 35 cases. J. Vet. Emerg. Crit. Care. (San Antonio) 2022;32:397–404.
[7] Nemi J.R, Hopper K, Epstein S.E. Retrospective evaluation of noncardiogenic pulmonary edema in dogs and cats (2000-2021): 31 cases. J. Vet. Emerg. Crit. Care. (San Antonio) 2023;33:354–359.
[8] Ng D.Z, Than Yu K.P, Rajkanna J. Acute pulmonary edema as a cardiovascular manifestation of pheochromocytoma. Cureus. 2023;15:e33675.
[9] Galac S, Korpershoek E. Pheochromocytomas and paragangliomas in humans and dogs. Vet. Comp. Oncol. 2017;15:1158–1170.
[10] Kumar A, Pappachan J.M, Fernandez C.J. Catecholamine-induced cardiomyopathy: an endocrinologist’s perspective. Rev. Cardiovasc. Med. 2021;22:1215–1228.
[11] Davison D.L, Terek M, Chawla L.S. Neurogenic pulmonary edema. Crit. Care. 2012;16:212.
[12] Drobatz K.J. Neurogenic pulmonary edema. In: Drobatz K.J, Hopper K, Rozanski E, Silverstein D.C, editors. In Textbook of small animal emergency medicine. 1st. Hoboken, NJ: Willey Blackwell; 2019. pp. 247–252.
[13] Unger K, Martin L.G. Noncardiogenic pulmonary edema in small animals. J. Vet. Emerg. Crit. Care. (San Antonio) 2023;33:156–172.
[14] Bouyssou S, Specchi S, Desquilbet L, Pey P. Radiographic appearance of presumed noncardiogenic pulmonary edema and correlation with the underlying cause in dogs and cats. Vet. Radiol. Ultrasound. 2017;58:259–265.
[15] Oyama M.A. Cardiogenic pulmonary edema. In: Drobatz K.J, Hopper K, Rozanski E, Silverstein D.C, editors. In Textbook of small animal emergency medicine. 1st. Hoboken, NJ: Willey Blackwell; 2019. pp. 242–246.
[16] Herrera M.A, Mehl M.L, Kass P.H, Pascoe P.J, Feldman E.C, Nelson R.W. Predictive factors and the effect of phenoxybenzamine on outcome in dogs undergoing adrenalectomy for pheochromocytoma. J. Vet. Intern. Med. 2008;22:1333–1339.