
| 一般情况 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:12岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:肝囊肿 | |
01 主诉及病史
11个月前的超声检查中发现腹部有一个囊肿。
患者最初因每周呕吐数次、厌食和间歇性腹泻就诊。在前11个月里,该囊肿被多次引流。现再次出现呕吐和食欲不振就诊。
02 检查
神志清醒,反应灵敏,生命体征在正常范围内。疼痛评分为1/4,腹部触诊时有轻微不适。腹部左右两侧均可触及一个巨大、圆形、坚实的肿块,但右侧更为明显。触诊左肾正常;但触诊不到右肾。
血液学和血生化未发现明显异常。腹部CT显示肝脏右侧有一个巨大的单发液性结构,与右内侧肝叶相连(下图)。该结构大小为7.2×6.2×5.5 cm,并将胆囊和胃向左侧移位。胆总管轻度扩张,直径4 mm,肝淋巴结轻度肿大,厚度7 mm。
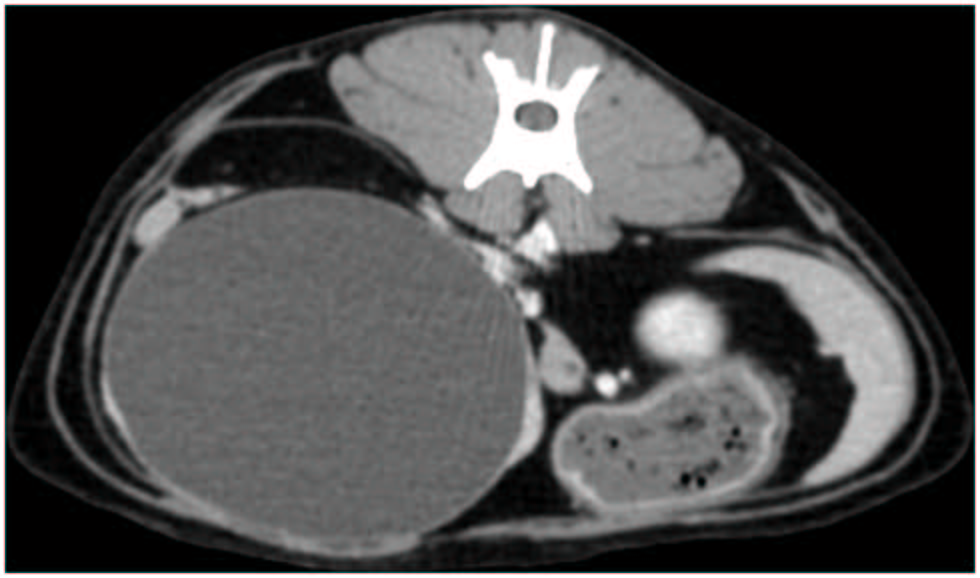
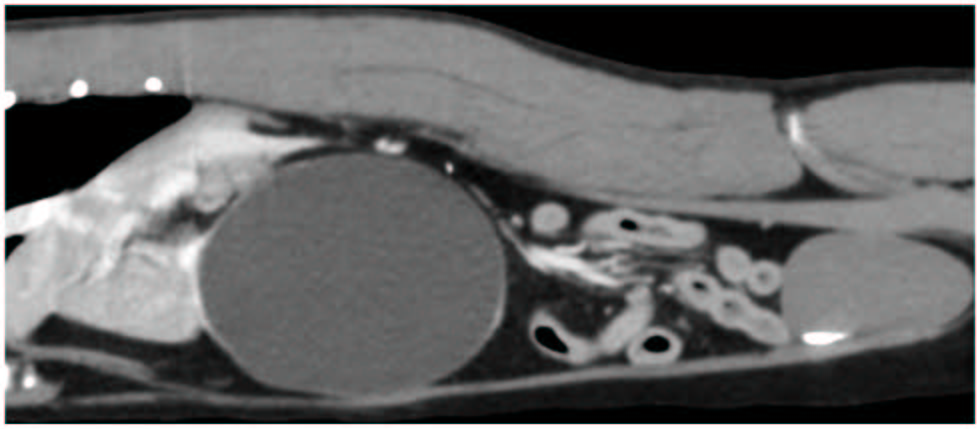
03 治疗
麻醉后,右侧腹部被剪开并进行无菌准备,以便在超声引导下放置闭环导管。在进入肝囊肿前,经皮置入一根25 cm、8.5 Fr的闭环导管(下图),将闭环导管锁定在囊肿内。

在透视引导下引流囊肿,共收集了120 mL黄色透明液体。这些液体被送去做细胞学检查和细菌培养及药敏试验。然后通过闭环导管向囊腔内注入相同体积(120 mL)的1:1稀释 0.9%生理盐水和非离子碘化碘海醇造影剂,以确保腹膜、肝实质或肝血管之间没有因放置闭环导管而发生连通。
排出造影剂,将99.5%的无水药用乙醇注入囊腔。注入的乙醇量相当于排出量的10%,即12 mL。乙醇在囊腔中共停留10分钟,每2.5分钟旋转患者一次,以使乙醇充分接触整个囊腔内壁。10分钟后排出乙醇,用200 mL 0.9%氯化钠冲洗囊腔,以清除残余乙醇。然后解开并移除闭环导管。
04 预后
患者恢复顺利,当天出院,并服用了3天的丁丙诺啡用于口腔黏膜镇痛。
细胞学检查结果显示腔内液体为透明无细胞液,含有极少量红细胞和白细胞,与单纯性肝囊肿一致。需氧或厌氧细菌培养均未发现生长。
患者在家中恢复良好,两周后复查时主人称所有临床症状均已消失。 6个月后进行了超声检查(下图)以重新评估肝囊肿的大小。患者情况依然良好,没有任何临床症状。检查时,猫没有疼痛感,腹部也没有肿块。超声检查结果显示在之前囊肿的区域出现了一个体积为8 cm3的低回声液体填充结构,与之前相比体积缩小了95%。
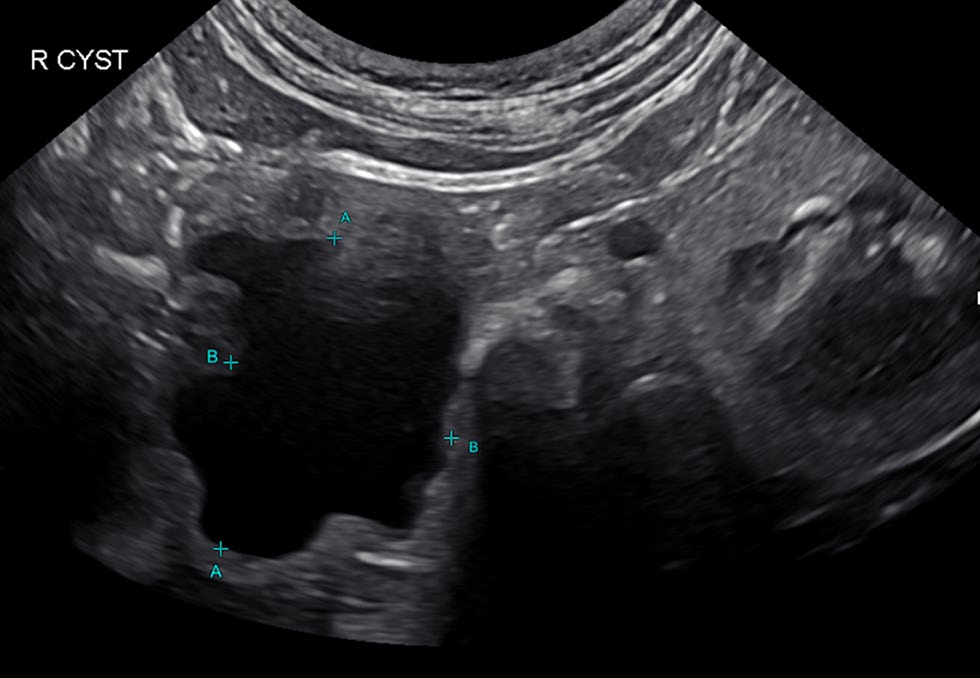
05 讨论
在猫科动物中,肝囊肿最常见于波斯猫,同时伴有先天性多囊肾[1,2]。囊肿的原因可能是肿瘤、炎症或外伤。像本病例中出现的巨大单发肝囊肿的报道很少。推测猫的肝囊肿起源于胆道[3,4]。在兽医文献中,此类病变的命名存在差异,发病机制也缺乏共识。
最近,Chenin等人[5]在人类医学文献中描述了基于影像学外观和液基细胞学的肝脏病变分类。单发性肝巨大囊肿的影像学表现和内容物符合”单纯性肝囊肿”的描述[5,6]。
单纯性肝囊肿可能是偶然发现,患者没有症状[1,3],但在某些情况下,单纯性肝囊肿可能会不断长大并影响肝胆功能[1,3],此时可能会出现临床症状。这些临床症状可能包括腹痛或腹胀、黄疸、呕吐或厌食[3]。虽然这不是组织病理学诊断,但由于本病例的临床症状、影像学检查结果和囊肿结构及内容物与单纯性肝囊肿一致[5,6],因此本病例倾向于单纯性肝囊肿。
对于有症状的单纯性肝囊肿患者,治疗方法包括肝叶部分切除术、囊膜切除术、囊肿切开术和网膜化疗,或反复腹腔穿刺和囊肿引流术[1,4]。本研究首次报道了猫科动物单纯性肝囊肿在透视引导下进行经皮肝囊肿引流和乙醇硬化剂治疗。
乙醇是一种硬化剂,用于抑制囊肿腔内上皮细胞的分泌能力[7]。在一项回顾性研究中,9只患有肝囊肿的猫接受了超声辅助引流和乙醇治疗,肝囊肿从15 mm到26 mm不等。这些患者都有嗜睡、呕吐和不合群的临床症状。治疗后所有患者的临床症状均在3-4周内消失,术后1个月的超声显示囊肿病灶变小[6-8]。这项研究中的患者在康复过程中没有得到进一步跟踪,因此,长期结果尚不清楚[7]。
虽然猫的预后不明,但这种手术在人类中很常见,并有成功的报道[9-11]。在Larssen等人[9]进行的一项人类试验中,对47名良性无症状肝囊肿患者进行了至少24个月至16年的随访。这些患者的中位囊肿体积缩小了99.7%,复发率为0%。
本病例的肝囊肿在乙醇中暴露了10分钟。在已发表的唯一一例猫肝囊肿乙醇消融术病例报告中,囊肿在一次治疗中暴露于乙醇两次,每次3分钟[7]。Larssen等人[9]的人体试验将肝囊肿暴露于乙醇中,每次10-20分钟。
囊肿暴露于硬化剂的时间长短因进行治疗的医生而异。另一项人类研究评估了31名人类患者接受乙醇暴露2小时与4小时的囊肿缩小率差异[12]。这项研究确定了即使暴露时间不同,囊肿缩小率也没有差异。两组患者的囊肿缩小率均超过97.7%[12]。这表明,暴露时间越长并不等于囊肿缩小的幅度越大[8,9,12]。此外,乙醇在体内停留的时间越长,乙醇中毒的风险就越大[8,12]。
在本病例中,医生向主人提供了多种治疗方案,并讨论了每种方案的风险和益处。由于能够观察到肝脏结构、获取样本进行组织病理学检查,而且有机会进行彻底切除,因此一开始建议进行肝叶部分切除术,这样不会有复发的风险。同时与主人讨论了经皮消融术的局限性,包括无法进行全腹探查、评估肝实质和采集组织样本进行组织学检查。
虽然在猫身上没有报道过使用乙醇硬化疗法的副作用——乙醇中毒和短暂疼痛[11,15,17],但还是告知了主人这些风险以及之前提到的手术限制。最终,与开放手术相比,经皮消融术的风险更容易被主人接受,而且费用大大降低,患者恢复更快,痛苦更少。
总的来说,被诊断为肝囊肿的猫有多种治疗选择。对于单纯性肝囊肿,应考虑经皮乙醇硬化疗法,因为这种疗法无创伤、患者更容易恢复、饲主花费更少、并发症风险更低且预后乐观。
参考文献
1. Roberts JN. Congential and inherited anomalies of the liver in animals. In: Aiello S, Moses M. (eds). The Merck veterinary manual. 11th ed. Kenilworth: Merck & Co, 2016, pp 147, 477–481.
2. Lafuente S, Fresno L, Anselmi C, et al. Complete laparoscopic excision of a hepatic cyst and omentopexy in a Persian cat. JFMS Open Rep 2018; 4.
3. Otte CM, Penning L, Rothuizen J. Feline biliary tree and gallbladder disease: aetiology, diagnosis and treatment. J Feline Med Surg 2017; 19: 514–528.
4. Johnston S, Tobias K. Liver and biliary system. In: Johnston S, Tobias K. (eds). Veterinary surgery: small animal. 2nd ed. St. Louis, MO: Elsevier Inc., 2018, pp 1837–1852.
5. Chenin M, Paisant A, Lebigot J, et al. Cystic liver lesions: a pictorial review. Insights Imaging 2022; 13: 116.
6. Mavilia MG, Pakala T, Molina M, et al. Differentiating cystic liver lesions: a review of imaging modalities, diagnosis and management. J Clin Transl Hepatol 2018;6: 208–216.
7. Zatelli A, D’Ippolito P, Bonfanti U, et al. Ultrasound-assisted drainage and alcoholization of hepatic and renal cysts: 22 cases. J Am Anim Hosp Assoc 2007; 43: 112–116.
8. Wijnands T, Gortjes A, Gevers T, et al. Efficacy and safety of aspiration sclerotherapy of simple hepatic cysts: a systematic review. Am J Roentgenol 2017; 208: 201–207.
9. Larssen TB, Viste A, Horn A, et al. Single-session alcohol sclerotherapy of symptomatic liver cysts using 10–20 min of ethanol exposure: no recurrence at 2–16 years of follow-up. Abdom Radiol (NY) 2016; 41: 1776–1781.
10. Jang C, Park S, Tak W, et al. Long-term follow-up of large symptomatic hepatic cysts treated by percutaneous ethanol sclerotherapy. Acta Radiol 2016; 57: 1205–1209.
11. Mastrolonardo E, Jia JB, Eng B, et al. Comparison of percutaneous ethanol injection and radiofrequency ablation for the treatment of hepatocellular carcinoma. Am J Interv Radiol 2020; 4: 16.
12. Yang C, Liang H, Pan H, et al. Single-session prolonged alcohol-retention sclerotherapy for large hepatic cysts. Am J Roentgenol 2006; 187: 940–943.
13. Shiina S, Tateishi R, Imamura M, et al. Percutaneous ethanol injection for hepatocellular carcinoma: 20-year outcome and prognostic factors. Liver Int 2012; 32: 1434–1442.
14. Livraghi T, Giorgio A, Marin G, et al. Hepatocellular carcinoma and cirrhosis in 746 patients: long-term results of percutaneous ethanol injection. Radiology 1995; 197: 101–108.
15. Van Dyck R, Fina C, Buresova E, et al. Successful management of a solitary simple renal cyst in a dog. Vlaams Diergeneeskd Tijdschr 2018; 87: 134–138.
16. Yu JH, Du Y, Li Y, et al. CT-guided sclerotherapy for simple renal cysts: value of ethanol concentration monitoring. Korean J Radiol 2014; 15: 80–86.
17. Barron E, Garden OJ. Non-parasitic cystic diseases of the liver. In: Balzan S, Gava V. (eds). Principals of hepatic surgery. Sharjah: Bentham Science Publishers, 2016, pp 324–342.