
| 一般情况 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:13岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:硬化性腹膜癌 | |
01 主诉及病史
出现厌食和嗜睡症状两周。
在室内生活,从未被带到户外。幼年时期接种了猫科动物基本疫苗。虽然每年都进行驱虫,但没有采取预防体外寄生虫的措施。无外伤史。接受过两次手术,不到一岁时的绝育手术和两年前的疣切除手术。疣位于右前肢脚背处,直径不到0.5 cm,几年来未长大,被认为是良性肿瘤。
02 检查
体格检查显示生命体征正常,腹部严重胀大,有腹水迹象。腹腔穿刺取出了1 L血样液体。
除了血清对称二甲基精氨酸水平轻度升高至21 μg/dL(0-14)外,其他血液检测结果均在正常范围内。NT-proBNP水平低于50 pmol/L(0-270),排除了腹水的心源性病因。
猫白血病病毒(FeLV)抗原、猫免疫缺陷病毒(FIV)抗体以及使用SNAP猫三重检测试剂盒进行的心丝虫抗原检测结果均为阴性。
在腹水分析中,总核细胞计数(TNCC)为2040个/μL,总蛋白(TP)为3.4 g/dL,证实腹水为渗出液。腹水中含有少量巨噬细胞、中性粒细胞、淋巴细胞和红细胞,没有发现肿瘤细胞。
猫冠状病毒的PCR检测和腹水的微生物培养结果均为阴性,表明猫传染性腹膜炎或化脓性腹膜炎的可能性很低。
腹腔穿刺术后的X光显示上腹部和右中下腹部出现异常的异质性高脂肪密度影(下图)。此外,充满气体的肠子向左腹部移位。腹部超声显示肠系膜和网膜呈多叶状,脂肪回声局部增高,腹腔内有少量游离液体。部分腹腔顶膜增厚,右腹部肠系膜钙化,内膜呈高回声,伴有强声影。充满气体的肠段呈轻度波纹状。
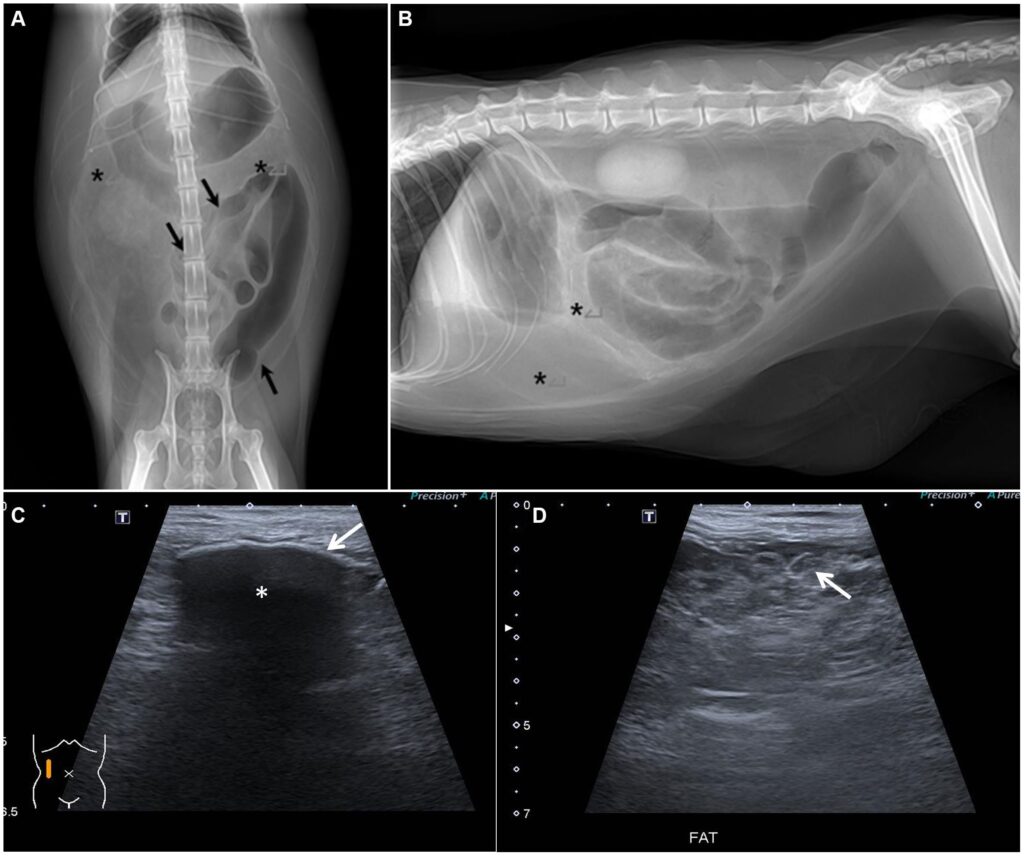
按照结肠炎的治疗方法,猫接受了补液、抗生素和H2受体阻滞剂治疗。为了解决厌食问题,还插入了鼻食管进行肠内喂食。
次日,全麻下进行了CT检查(下图)。在右侧腹腔观察到肠系膜和网膜脂肪堆积,表现为多个线性高增强团块。这导致堆积的肠道向左尾外侧移位和腹腔积液。一些小肠充满气体,降十二指肠因胃液潴留而严重扩张。膀胱周围增厚的顶腹膜和内脏腹膜呈强强化。腹侧顶腹膜观察到广泛的钙化,网膜和肠系膜观察到小的钙化灶。根据这些CT结果,怀疑腹水是由包裹性腹膜硬化症(EPS)引起的。
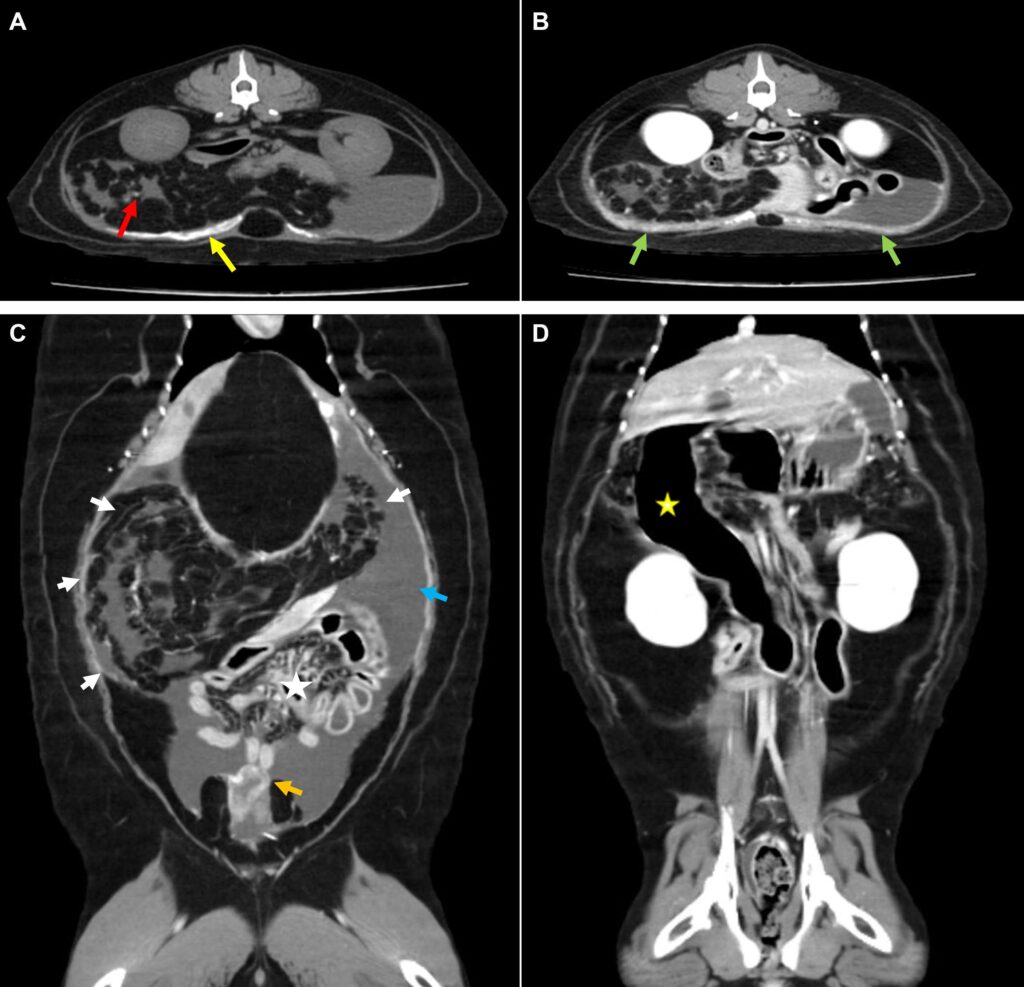
03 手术
为确定病因,通过开腹手术进行了多处活检。切开腹壁后观察到纤维膜将腹壁与包裹的腹腔脏器和腹水连接起来(下图)。
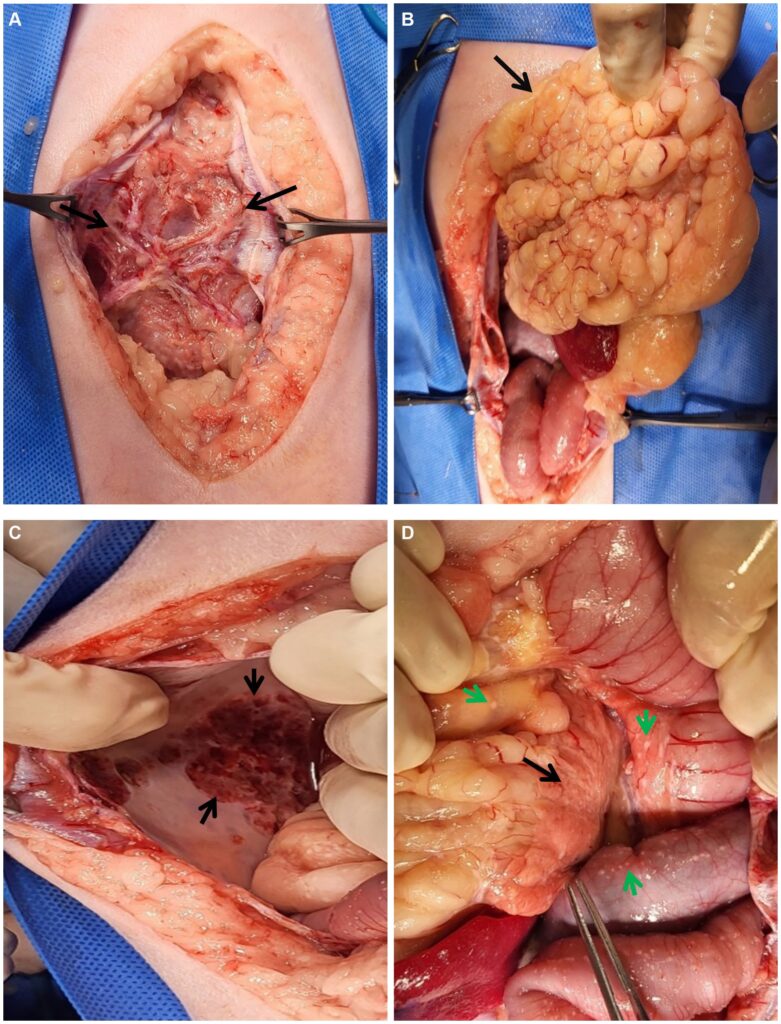
网膜脂肪钙化,并向头颅方向凝结。腹壁顶叶部分也有钙化迹象,因此需要从这些部位采集活检样本。腹膜和肠浆膜壁弥漫分布着大小不一的异常结节。大体检查进一步发现膀胱浆膜壁红斑和胰腺挛缩,与CT检查结果一致。
H&E染色显示出分化不良的浸润性恶性肿瘤(在10个0.237 mm2高倍视野中有丝分裂计数为5-8个)(下图A-C)。肿瘤细胞边界不清,有少量至中等量的嗜酸性细胞质,圆形细胞核,染色质呈细条纹状,有一个或两个明显的核小体。附着在腹壁上的纤维组织由脂肪结缔组织和丰富的鳞状基质组成,基质中存在分化不良的肿瘤细胞岛和细胞簇。在网膜和钙化腹壁的切片中,可以明显观察到骨质形成,其特征是骨小梁和裂隙内的细胞与肿瘤细胞非常接近。
免疫组化中细胞角蛋白(AE1/AE3)和波形蛋白被用作染色剂,结果显示90%以上的侵袭性、分化不良的肿瘤细胞在胞质中对细胞角蛋白(AE1/AE3)表现出强免疫反应(下图E)。肿瘤细胞群中只有少数细胞的波形蛋白检测呈阳性(下图F),这与癌的特征一致。为明确排除间皮瘤,还进行了Wilm’s tumor 1(WT1)免疫测定,结果为阴性(下图D)。
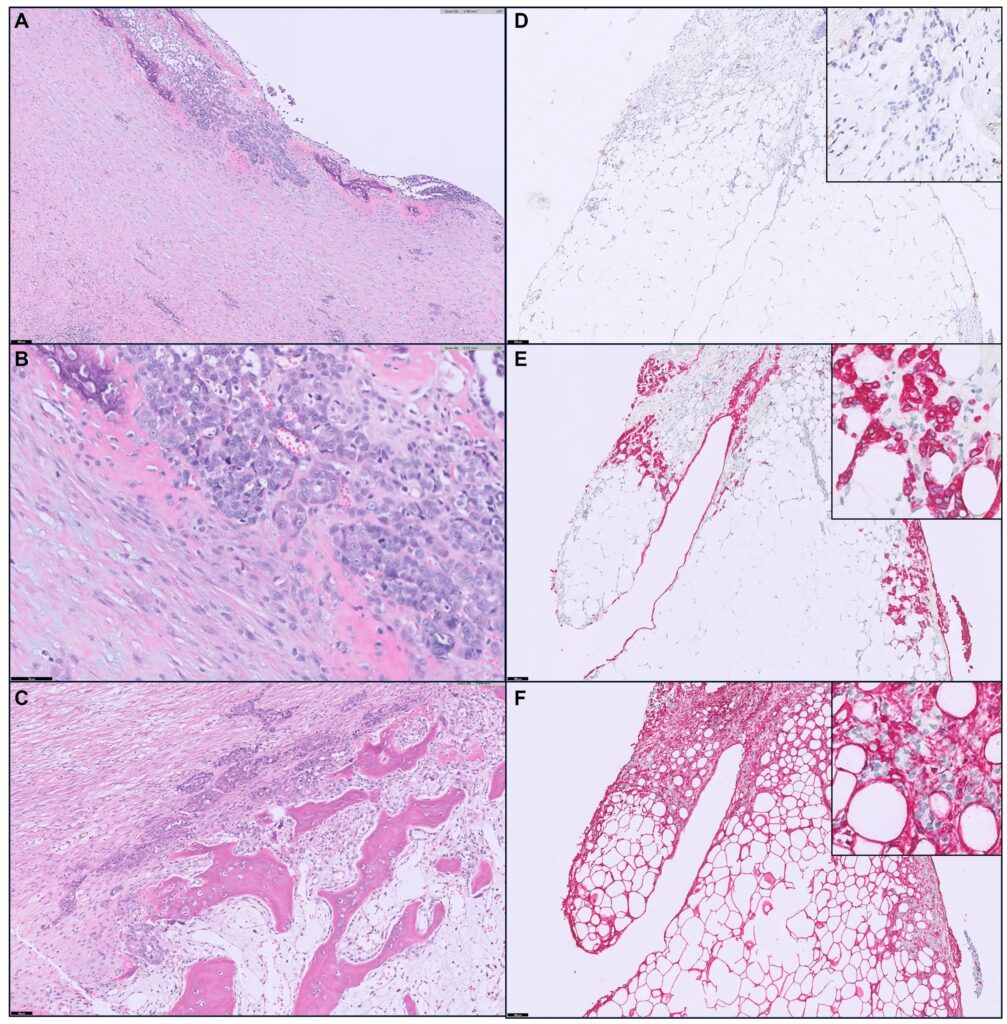
由于在超声、CT和手术中均未发现可疑的原发肿瘤,该猫被诊断为硬化性腹膜癌(SPC)。考虑到腹腔脏器被纤维组织包裹和骨质形成的情况,SPC伴骨化的诊断得以确立。
04 预后
由于在开腹手术后病情迅速恶化,最终实施了安乐死,没有进行任何治疗。主人拒绝进行尸检。
05 讨论
包裹性腹膜硬化症(EPS),又称硬化性包裹性腹膜炎,是一种罕见的疾病,其特征是纤维性腹膜增厚包裹腹腔器官,最早出现在人类医学中[1],通常表现为腹水。在人类医学中,腹膜透析诱发的EPS最为常见,腹部手术或异物也可引起EPS[2]。人类医学中也有一些特发性EPS的报道[2]。
在兽医学中,EPS与人类一样分为原发性(特发性)和继发性[3,4]。在猫科动物中,有涉及特发性EPS、感染或子宫肌瘤的EPS病例报道[3-5]。在人类医学[6]和兽医学[5]中,EPS在影像学上表现为腹胀、肠系膜脂肪滞留、定位性腹腔积液、肠套叠和钙化。
本研究介绍了一例13岁的绝育雄性短毛猫的病例,根据放射线检查、超声和CT,怀疑这只猫患有EPS;然而,组织病理学检查却意外地发现它被诊断为伴有骨质变性的硬化性腹膜癌(SPC)。
兽医学中有关EPS影像特征的信息非常有限。一项关于推测患有EPS的动物研究包括七只狗和两只猫,它们都出现了腹水[5]。该研究的影像学特征包括肠襻聚集和腹胀,而超声检查显示有回声性液体、肠襻聚集或波纹状以及腹腔淋巴结肿大。
所有接受CT检查的动物都出现了肠系膜脂肪滞留。其他猫科动物病例报告也显示了类似的影像学特征:小肠襻呈波纹状、胃或肠道扩张并充满液体、超声显示淋巴结肿大、X光显示腹水充满腹部[3,9]。
在本病例中,影像学特征提示了EPS,包括X线显示单侧肠道堆叠,超声显示肠系膜和网膜多分层,脂肪回声增强,腹膜增厚伴钙化,肠道呈波纹状。CT检查显示肠系膜和网膜脂肪滞留、单侧肠道堆积、肠道充气、腹膜增厚和钙化。根据这些综合影像学检查结果,患者被怀疑为EPS。在开腹手术中观察到纤维膜包裹着腹腔器官和腹水,这与之前报道的另一只患有EPS的猫的大体特征相似[5]。
癌症钙化的发病机制涉及肿瘤细胞与肿瘤微环境之间复杂的相互作用,其中癌症相关成纤维细胞(CAF)发挥了重要作用[12,13]。CAF可分泌细胞外基质蛋白,如胶原蛋白和纤连蛋白,以及促进组织重塑和血管生成的信号分子,从而促进肿瘤的生长和侵袭性[12]。
在人类医学中,钙化的严重程度被证实与多种类型癌症的不良预后有关,包括胰腺导管腺癌、结肠直肠癌和子宫内膜样腺癌[14-17]。在本病例中,鉴于其明显的血性变化,很可能与患者病情的迅速恶化有关。
肿瘤中的骨形成可分为三种类型:骨肉瘤中的成骨、肉瘤样癌中的成骨细胞分化和骨质形成[18]。据报道,猫科动物的口腔鳞状细胞癌、胃肠癌和胸腺淋巴肉瘤中都有骨质形成[19-22]。
虽然猫科动物任何类型的癌症都存在骨质移行症,但目前还没有确定的机制,而肿瘤细胞产生的粘蛋白、骨生成素、MAPK、P53和CD44被认为参与了人类肠癌的骨质移行症[23,24],而骨形态发生蛋白(BMP)诱导的基质细胞向成骨细胞的转化、碱性磷酸酶活性、局部钙和磷酸盐水平被认为参与了人类尿路上皮癌的骨质形成[18]。鉴于本病例中观察到的广泛钙化现象,考虑基质细胞转化导致骨化的可能性。进一步研究猫腹膜癌变的骨化机制将非常有价值。
总之,本病例报告为疑似EPS猫的诊断过程提供了宝贵的临床见解,组织病理学分析表明该患者被诊断为SPC。兽医在遇到疑似EPS病例时应将SPC作为鉴别诊断的一部分,尤其是当放射学和临床特征不典型或不确定时。分享类似的临床经验将提高诊断的准确性,并有可能改进猫腹膜疾病的治疗方法。
参考文献
1. Danford CJ, Lin SC, Smith MP, Wolf JL. Encapsulating peritoneal sclerosis. World J Gastroenterol. (2018) 24:3101–11.
2. Machado NO. Sclerosing encapsulating peritonitis: review. Sultan Qaboos Univ Med J. (2016) 16:e142–51.
3. Kiniger C, Janssen JN, Lederer KA, Lipnik K, Doulidis PG. Sclerosing encapsulating peritonitis in cats: a two-case report and literature review. JFMS Open Rep. (2023) 9:20551169231178447.
4. Hardie EM, Rottman JB, Levy JK. Sclerosing encapsulating peritonitis in four dogs and a cat. Vet Surg. (1994) 23:107–14.
5. Gremillet BCH, Porsmoguer C, Bolen G, Billen F, Noël S, Brutinel F, et al.. Imaging findings in dogs and cats with presumptive sclerosing encapsulating peritonitis. Front Vet Sci. (2022) 9:891492.
6. George C, Al-Zwae K, Nair S, Cast JEI. Computed tomography appearances of sclerosing encapsulating peritonitis. Clin Radiol. (2007) 62:732–7.
7. Tannoury JN, Abboud BN. Idiopathic sclerosing encapsulating peritonitis: abdominal cocoon. World J Gastroenterol. (2012) 18:1999–2004.
8. Zhang Z, Zhang M, Li L. Sclerosing encapsulating peritonitis: three case reports and review of the literature. J Int Med Res. (2020) 48:300060520949104.
9. Sonck L, Chiers K, Ducatelle R, Van Brantegem L. Encapsulating peritoneal sclerosis in a young cat. Vet Rec Case Rep. (2018) 6:e000541.
10. Wu B, Kastl B, Cino-Ozuna AG, Springer NL, Thakkar R, Biller D, et al.. Feline sarcomatoid renal cell carcinoma with peritoneal carcinomatosis and effusion. J Vet Diagn Investig. (2022) 34:153–9.
11. Weston PJ, Baines SJ, Finotello R, Mortier JR. Clinical, CT, and ultrasonographic features of canine and feline pleural and peritoneal carcinomatosis and sarcomatosis. Vet Radiol Ultrasound. (2021) 62:331–41.
12. Franco OE, Shaw AK, Strand DW, Hayward SW. Cancer associated fibroblasts in cancer pathogenesis. Semin Cell Dev Biol. (2010) 21:33–9.
13. Lee JI, Campbell JS. Role of desmoplasia in cholangiocarcinoma and hepatocellular carcinoma. J Hepatol. (2014) 61:432–4.
14. Ao T, Kajiwara Y, Yonemura K, Shinto E, Mochizuki S, Okamoto K, et al.. Morphological consistency of desmoplastic reactions between the primary colorectal cancer lesion and associated metastatic lesions. Virchows Arch. (2020) 477:47–55.
15. Whatcott CJ, Diep CH, Jiang P, Watanabe A, LoBello J, Sima C, et al.. Desmoplasia in primary tumors and metastatic lesions of pancreatic Cancer. Clin Cancer Res. (2015) 21:3561–8.
16. Nakayama H, Ohuchida K, Yoshida M, Miyazaki T, Takesue S, Abe T, et al.. Degree of desmoplasia in metastatic lymph node lesions is associated with lesion size and poor prognosis in pancreatic cancer patients. Oncol Lett. (2017) 14:3141–7.
17. Wei S, Conner MG, Zhang K, Siegal GP, Novak L. Juxtatumoral stromal reactions in uterine endometrioid adenocarcinoma and their prognostic significance. Int J Gynecol Pathol. (2010) 29:562–7.
18. Razafimahefa J, Gosset C, Mongiat-Artus P, Andriamampionona TF, Verine J. Stromal osseous metaplasia in urothelial carcinoma of the bladder: a rare case report and literature review. Diagn Pathol. (2019) 14:75.
19. Jung JH, Kim NY, Yang Y, Seo D, Choi G, Hong H, et al.. Metastatic intestinal adenocarcinoma with osseous metaplasia in two domestic Korean shorthair cats. J Vet Sci. (2023) 24:24.
20. Uneyama M, Chambers JK, Nakashima K, Uchida K, Nakayama H. Histological classification and immunohistochemical study of feline colorectal epithelial tumors. Vet Pathol. (2021) 58:305–14.
21. Martin CK, Tannehill-Gregg SH, Wolfe TD, Rosol TJ. Bone-invasive oral squamous cell carcinoma in cats: pathology and expression of parathyroid hormone-related protein. Vet Pathol. (2011) 48:302–12.
22. Thilsted JP, Bolton RG. Thymic lymphosarcoma with bony metaplasia in a cat. Vet Pathol. (1985) 22:424–5.
23. Haque S, Eisen RN, West AB. Heterotopic bone formation in the gastrointestinal tract. Arch Pathol Lab Med. (1996) 120:666–70.
24. Liu X, Xu J, Chen L. Colorectal carcinoma with osseous metaplasia. Oncotarget. (2017) 8:65407–13.