
| 一般情况 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:10个月 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:全身性破伤风 | |
01 主诉及病史
嗜睡,左后肢存在慢性感染性伤口。
三天前,该猫在外出两天后回来发现左后肢伤口,原因不明。当地兽医开具了一种未知的消炎药(可能是美洛昔康)和一种未知的抗生素进行治疗。
02 检查
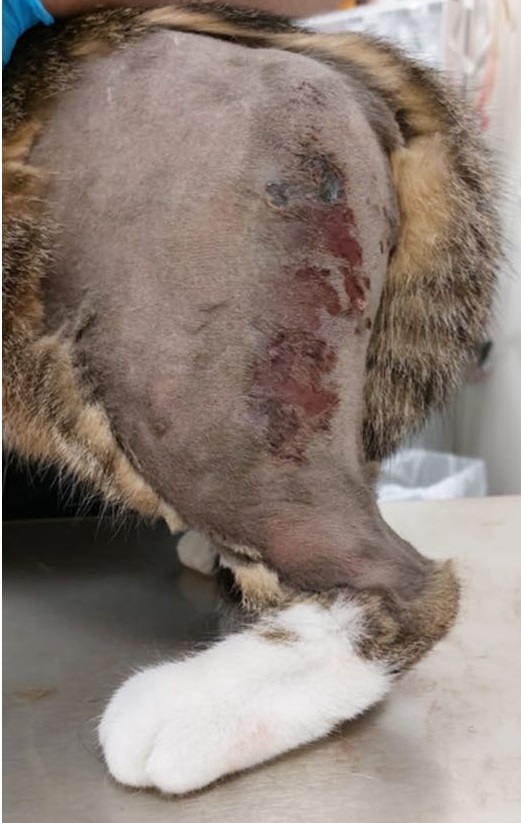
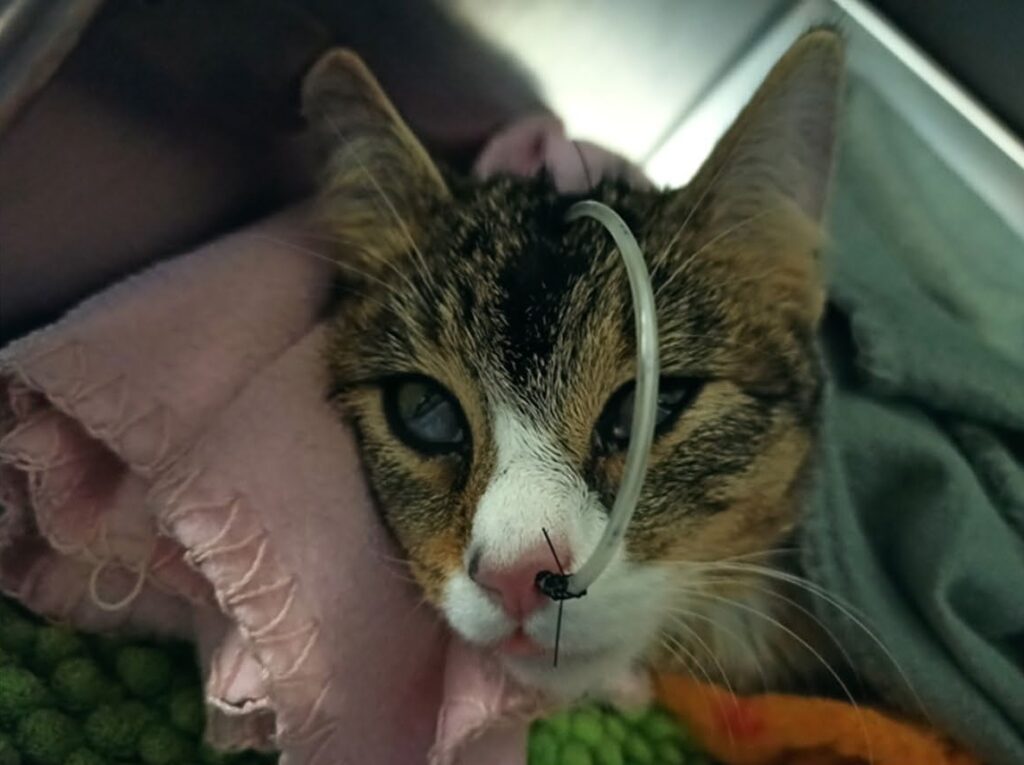
左后肢中度肿胀,跗关节近端水肿。左大腿近端外侧有一个直径1 cm伤口,大腿外侧有一处渗出性皮损(下图)。左侧腹股沟区域皮肤有多处轻微裂伤。左后肢出现中度负重跛行,为2/4级。肢体检查时明显感到严重不适,患处周围皮下气肿明显。
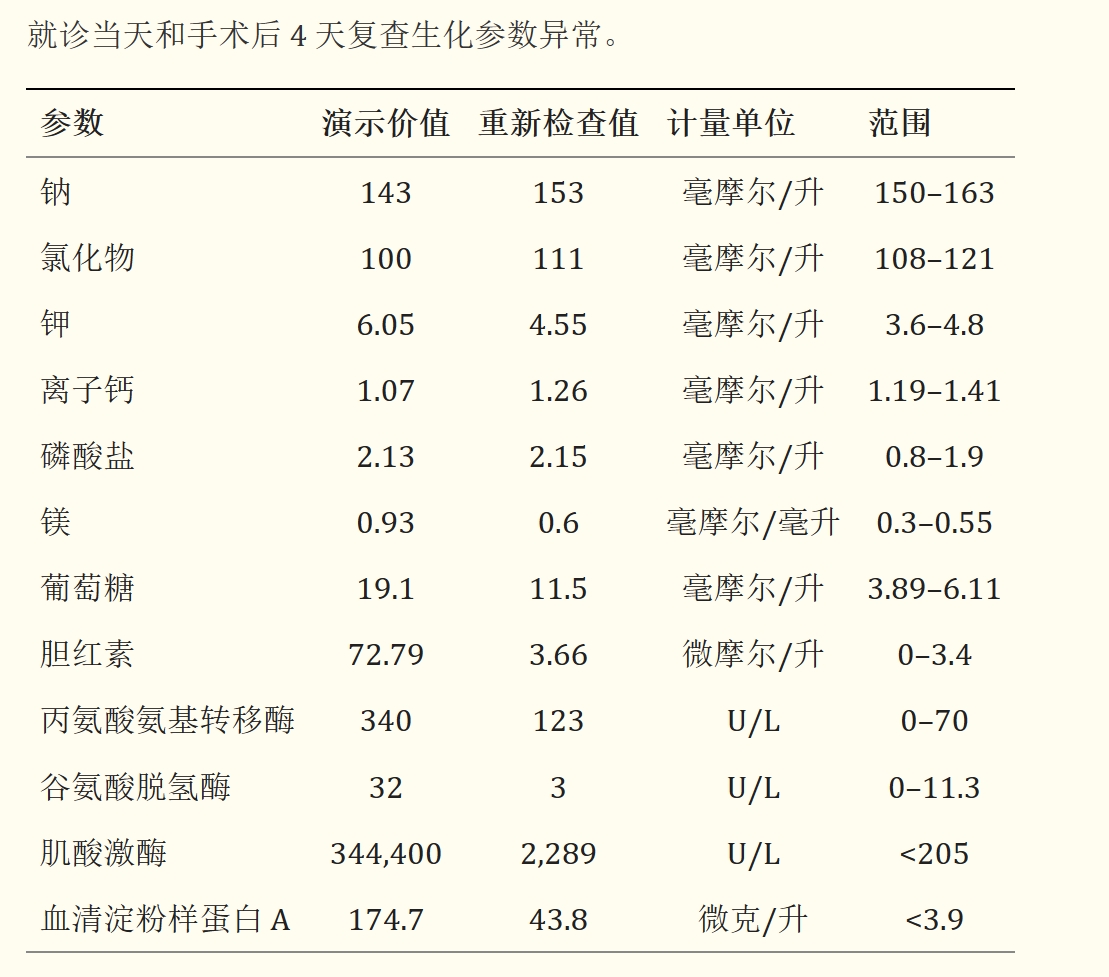
全血细胞计数显示轻度正常红细胞、正色素、非再生性贫血,血细胞比容为0.3 L/L(0.31-0.52)。血浆生化指标显示多种异常,包括电解质紊乱、肝功能指标升高、肌酸激酶和血清淀粉样蛋白 A(SAA)明显升高(下表)。血液涂片的细胞学显示中性粒细胞发生了严重的毒性变化。
胸部和腹部X光片无异常。除了左大腿近端出现严重的皮下气肿外,左后肢X光片正常。
03 治疗
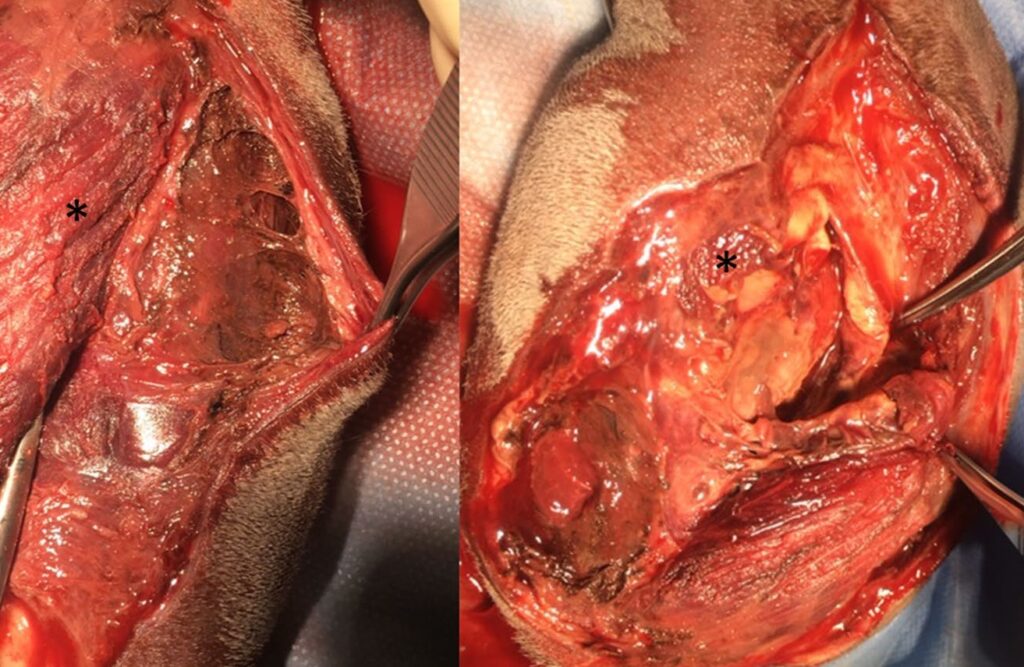
在使用等渗盐水(2 mL/kg/h)输液治疗初步稳定病情后,接受了手术治疗。术中发现大腿肌肉组织坏死,多处血管血栓形成(下图)。在髋关节水平进行截肢。在皮肤缝合前,放置了两个密闭的抽吸引流系统,并从皮损处和手术部位采集了拭子进行体外培养。
术后疼痛由芬太尼恒速输注控制,剂量为5 μg/kg/h。术后猫精神轻度萎靡,心动过速(160-200 /分钟),血压低(80-110 mmHg),无任何神经系统异常。由于感染严重,在使用阿莫西林-克拉维酸进行抗生素治疗的基础上,又添加了马勃沙星(2 mg/kg,IV q24h)。使用去甲肾上腺素(0.2 μg/kg/分钟,IV)维持血压。手术后放置了中心静脉导管,并通过鼻食管插管进行早期喂食。
04 预后
术后1天,前额肌肉出现收缩,右后肢肌张力轻度增强。
术后2天,神经系统异常变得更加明显:开始昏迷,对光线和响声开始变得非常敏感,全身肌张力增加,并伴有间歇性肌张力亢进(下图)。右后肢和尾巴的肌张力明显增加,右侧跗关节过度伸展,两侧前肢的张力也增加,人工刺激后肌肉收缩加剧。
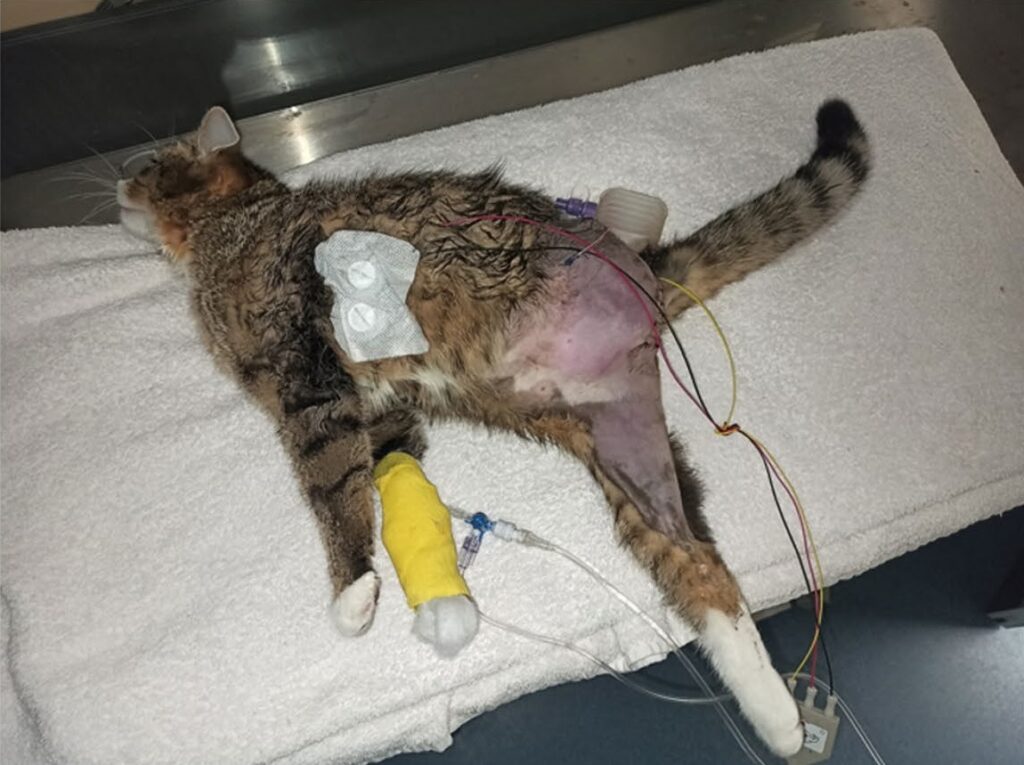
由于肌张力增强,三个肢体的脊髓反射无法被激发。还观察到第三眼睑间歇性突出,面部肌肉轻度收缩。主人拒绝进行肌电图检查以进一步确定病情。
注射咪达唑仑(0.5 mg/kg,IV)和甲氧苄氨嘧啶(20 mg/kg,IV)后,症状得到了轻微改善。进一步的治疗包括持续输注咪达唑仑(0.5 mg/kg/h)和甲氧苄啶(10 mg/kg/h),以及使用泪液替代物(q6h)。开始使用甲硝唑(25 mg/kg,IV q12h)治疗,并停用马勃沙星。阿莫西林-克拉维酸和去甲肾上腺素继续使用,芬太尼改为丁丙诺啡(0.1 mg/kg,IV q8h),并使用美洛昔康(0.05 mg/kg,PO q24h)。将猫饲养在安静、黑暗环境中,每4小时更换一次卧姿,以避免出现通气问题和压疮。
尽管进行了强化治疗后,血液指标也有了明显改善,但病情还是逐渐恶化。术后第4天,突然出现四肢抽搐,伴有高热和室性心律失常。注射咪达唑仑(0.5 mg/kg,IV)后抽搐症状得以缓解。神经系统检查显示持续昏迷,耳朵竖起且僵硬,面部肌肉收缩,第三眼睑永久性突出(下图),三个肢体及尾巴中度至重度僵硬。通过鼻食道插管又注射了骨骼肌松弛剂丹曲林(2 mg/kg,PO q8h),并开始使用右美托咪定(0.5-2 μg/kg/h,IV)。
皮损处的培养结果显示存在产气荚膜梭菌(Clostridium perfringens)和脆弱梭杆菌(Pseudescherichia vulneris)。尽管继续进行了强化治疗,但四肢抽搐的情况并未改善,猫在术后7天出现了心肺骤停。主人拒绝心肺复苏。没有对其进行尸检。
05 讨论
破伤风是一种神经系统疾病,由破伤风痉挛毒素引起,这种毒素是由革兰氏阴性厌氧菌——破伤风梭菌(Clostridium tetani)产生的。破伤风梭菌通常从皮肤或粘膜的伤口侵入,在厌氧条件下,破伤风梭菌能够产生毒素[1]。
破伤风梭菌从感染部位到达外周运动神经元的局部末梢,通过逆行轴突运输将毒素带入中枢神经系统,干扰脑干和脊髓中抑制性神经递质甘氨酸和γ-氨基丁酸(GABA)的释放[2,3]。这种中枢抑制失调的后果是骨骼肌持续和不受控制的收缩。病情较重的患者还可能出现明显的自主神经症状[1]。
破伤风梭菌在环境中无处不在,但感染和发病在犬中并不常见,在猫中也非常罕见。与人类、马、小鼠和豚鼠相比,狗和猫对破伤风痉挛毒素的抵抗力相对较弱,猫的抵抗力比犬略强[1,4,5]。
虽然犬的全身型破伤风描述得很清楚,但猫通常受局部型破伤风影响,而且症状通常不如犬严重。此外,猫的发病时间通常较晚,可能在感染后3周内发病,而犬的发病时间则在5-10天(范围:3-18天)[1,5]。
本病例报告描述了一例严重的短毛家猫全身性破伤风病例。该病例的病情发展迅速,猫在首次出现临床症状后一周内死亡。死因是心律失常和严重的肌肉收缩导致心肺功能停止,并可能发生了呼吸肌麻痹。
在出现四肢抽搐症状的猫狗身上,伤口通常很小,甚至可能找不到伤口[7,11,12,14,16-18,29]。不过,之前有研究表明,与狗相比,猫的潜在伤口通常可以被识别出来[12]。在本报告中,猫的软组织感染程度很严重,但由于没有进行伤口探查和清创,当地兽医没有发现。这导致了伤口治疗的延误,并可能导致预后恶化。
虽然迄今为止还没有研究对破伤风猫的存活率进行广泛调查,但根据目前的文献,如果临床症状仍为局灶性和/或可以通过药物控制,总体预后良好[12,16]。不过,必须指出的是,一旦猫出现全身性破伤风症状,尤其是伴有自主神经受累时,预后很可能不佳[1,21]。还有人认为,潜伏期越短,临床表现和预后越差[1,19]。这与本报告中的猫是一致的,即在首次发现伤口后约5-6天开始出现肌肉僵硬。
在该病例中,尚无法确诊破伤风。事实上,只分离出了产气荚膜梭菌(Clostridium perfringens)。然而,这在破伤风病例中很常见,因为细菌培养往往会导致假阴性结果,而且阳性结果并不意味着会产生毒素[5]。
根据临床病史和病情发展,以及伤口中存在另一种梭状芽孢杆菌,破伤风仍被认为是最有可能的诊断。其他可能的诊断还有”僵人综合征”(迄今为止只在狗和马身上出现过,而且还有偶发症状,因此不太可能)[30,31]、假性肌张力障碍或肌张力障碍(由于病情恶化且没有肌肉松弛阶段,因此不太可能)、马钱子中毒(排除在外,因为临床症状是在医院开始出现的,动物无法接触到这种物质)、低钙血症(通过生化检查排除在外)和脑膜炎。遗憾的是,没有进行尸检。
总之,本病例报告描述了一例因左大腿软组织严重感染而继发全身性破伤风的罕见病例。尽管对该猫进行了重症监护、镇静和多达四种不同的肌松弛剂治疗,但它仍然出现了破伤风抽搐,并最终死亡。
目前还不清楚使用抗毒素、镁或其他药物(如苯巴比妥)是否会改变这只猫的结局。由于缺乏有关猫破伤风的信息,尤其是全身性病例,今后有必要进行研究,以评估最有效的治疗方法、结果和预后。
参考文献
1. Greene CE. Tetanus In: Greene CE, editor. Infectious diseases of the dog and cat. Philadelphia: WB Saunders; (2012). 267–73.
2. Montecucco C, Schiavo G. Mechanism of action of tetanus and botulinum neurotoxins. Mol Microbiol. (1994) 13:1–8.
3. Coleman ES. Clostridial neurotoxins: tetanus and botulism. Compend Contin Educ Pract Vet. (1998) 20:1089–96.
4. Angove MM, Matros LL. Tetanus. Compend Contin Educ Pract Vet. (1982) 4:473–8.
5. Dewey CW, Talarico LR. “Myopathies: disorders of skeletal muscle”. In: Dewey CW, Costa RC, editors. Practical guide to canine and feline neurology. Oxford (UK): Wiley Blackwell; (2016). p. 506–508.
6. Brunnberg L, Waibl H, Lehmann J. Lahmheit Beim Hund. 1st ed. Kleinmachnow: Procane Claudo Brunnberg; (2014). 57 p.
7. Burkitt JM, Sturges BK, Jandrey KE, Kass PH. Risk factors associated with outcome in dogs with tetanus: 38 cases (1987–2005). J Am Vet Med Assoc. (2007) 230:76–83.
8. Fildes P, Hore T, Wright JG. A case of tetanus in a cat. Vet Rec. (1931) 43:731.
9. Killingsworth C, Chiapella A, Veralli P, de Lahunta A. Feline tetanus. J Am Anim Hosp Assoc. (1977) 13:209–15.
10. Adeyanju JB, Garba M, Usman AS. Feline tetanus: a case report. Trop Vet. (1985) 3:34–6.
11. De Risio L, Gelati A. Tetanus in the cat-an unusual presentation. J Feline Med Surg. (2003) 5:237–40.
12. Tomek A, Kathmann I, Faissler D, Cizinauskas S, Timmann D, Reimer Y, et al.. Tetanus bei Katzen: 3 Fallbeschreibungen. Schweiz Arch Tierheilkd. (2004) 146:295–302.
13. Todorova I, Goranov N, Simeonov R, Hubenov H. A case of generalized tetanus in a cat. Bulg J Vet Med. (2009) 12:158–62.
14. Farrar B, Liebel F. Generalised tetanus in a cat. Vet Rec. (2019) 7:e000907.
15. Moretti M, Rocchi PM, Botto A, Calabria MS, Pelizzola M, Bortolami E. (2022). Generalised tetanus in a cat successfully managed with magnesium sulfate and dexmedetomidine. Abstract retrieved from Proceedings of the EVECC congress, Ghent.
16. Polizopoulou ZS, Kazakos G, Georgiadis G, Soubasis N, Koutinas C, Koutinas AF. Presumed localized tetanus in two cats. J Feline Med Surg. (2002) 4:209–12.
17. Langner KFA, Schenk HC, Leithaeuser C, Tholen H, Simon D. Localised tetanus in a cat. Vet Rec. (2011) 169:126.
18. Danciu CG, Milgram J, Ober CA, Tăbăran FA, Demény H, Chai O. Coxofemoral luxation as a complication of localized tetanus in a cat. JFMS Open Rep. (2022) 8:20551169221090889.
19. Lee EA, Jones BR. Localised tetanus in two cats after ovariohysterectomy. N Z Vet J. (1996) 44:105–8.
20. Wasay M, Khealani BA, Talati N, Shamsi R, Syed NA, Salahuddin N. Autonomic nervous system dysfunction predicts poor prognosis in patients with mild to moderate tetanus. BMC Neurol. (2005) 5:2.
21. Zitzl J, Dyckers J, Güssow A, Lehmann H, Hazuchova K. Survival in canine tetanus – retrospective analysis of 42 cases (2006–2020). Front Vet Sci. (2022) 9:1015569.
22. Veronesi R, Bizzini B, Focaccia R, Coscina AL, Mazza CC, Focaccia MT, et al.. Naturally acquired antibodies to tetanus toxin in humans and animals from the galápagos islands. J Infect Dis. (1983) 147:308–11.
23. Troia R, Buzzurra F, Ciuffoli E, Mascalzoni G, Foglia A, Magagnoli I, et al.. Classification of septic shock phenotypes based on the presence of hypotension and hyperlactatemia in cats. Front Vet Sci. (2021) 8:692528.
24. Quilling LL, Outerbridge CA, White SD, Affolter VK. Retrospective case series: Necrotising fasciitis in 23 dogs. Vet Dermatol. (2022) 33:534–44.
25. Sura R, Hinckley LS, Risatti GR, Smyth JA. Fatal necrotising fasciitis and myositis in a cat associated with Streptococcus canis. Vet Rec. (2008) 162:450–3.
26. Stevens DL, Musher DM, Watson DA, Eddy H, Hamill RJ, Gyorkey F, et al.. Spontaneous, nontraumatic gangrene due to Clostridium septicum. Rev Infect Dis. (1990) 12:286–96.
27. Bhargava A, Sen P, Swaminathan A, Ogbolu C, Chechko S, Stone F. Rapidly progressive necrotizing fasciitis and gangrene due to Clostridium difficile: case report. Clin Infect Dis. (2000) 30:954–5.
28. Ray P, Das A, Singh K, Bhansali A, Yadav TD. Clostridium tertium in necrotizing fasciitis and gangrene. Emerg Infect Dis. (2003) 9:1347–9.
29. Bandt C, Rozanski EA, Steinberg T, Shaw SP. Retrospective study of tetanus in 20 dogs: 1988–2004. J Am Anim Hosp Assoc. (2007) 43:143–8.
30. Nollet H, Vanderstraeten G, Sustronck B, Van Ham L, Ziegler M, Deprez P. Suspected case of stiff-horse syndrome. Vet Rec. (2000) 146:282–4.
31. Pancotto TE, Rossmeisl JH, Jr. A case of stiff dog syndrome associated with anti-glutamic acid decarboxylase antibodies. J Clin Mov Disord. (2017) 4:5.
32. Attygalle D, Rodrigo N. New trends in the management of tetanus. Expert Rev Anti-Infect Ther. (2004) 2:73–84.
33. Simmonds EE, Alwood AJ, Costello MF. Magnesium sulfate as an adjunct therapy in the management of severe generalized tetanus in a dog. J Vet Emerg Cri Care (San Antonio). (2011) 21:542–6.
34. Papageorgiou V, Kazakos G, Anagnostou T, Polizopoulou Z. The role of magnesium in the management of acute and long-term symptoms caused by tetanus in two dogs. Top Companion Anim Med. (2021) 44:100535.