
| 一般情况 | |
|---|---|
 | 品种:约克夏梗 |
| 年龄:7岁 | |
| 性别:未知 | |
| 是否绝育:未知 | |
| 诊断:胰腺炎、胆囊萎缩 | |
01 主诉及病史
呕吐、厌食和腹部不适已有数日。
02 检查
身体状况评分为4/9分。没有黄疸,但有轻度脱水,腹部触诊时有不适感。全血细胞计数显示白细胞中性粒细胞轻度增多。
ALT:5.46 μkat/l(0.17-1.96)
AST:1.05 μkat/l(0. 23-0.75)
GGT:0.25 μkat/l(0-0.12)
总胆红素:20.52 μmol/l(1.71-10.26)
胆固醇:13.78 mmol/l(3.24-6.99)
血尿素氮:2.14 mmol/l(2.50-8.92)
淀粉酶:33.15 μkat/l(3.34-20.04)
脂肪酶:38.43 μkat/l(3.34-30.06)
犬胰腺特异性脂肪酶:1928 μg/l(< 400)
多次腹部超声显示胆囊壁没有增厚,但发现了一个高回声不典型小结节,怀疑是胆结石(下图A)。CT检查发现总胆管扩张(下图B)和钙化灶,推测为胆石症(下图C)。与重力方向不同的钙化灶被认为是与胆囊壁粘连的结石。对比后CT图像中还观察到胰腺体呈异质对比增强(下图D)。该犬被诊断为胰腺炎,并怀疑患有胆石症和胆汁淤积症。
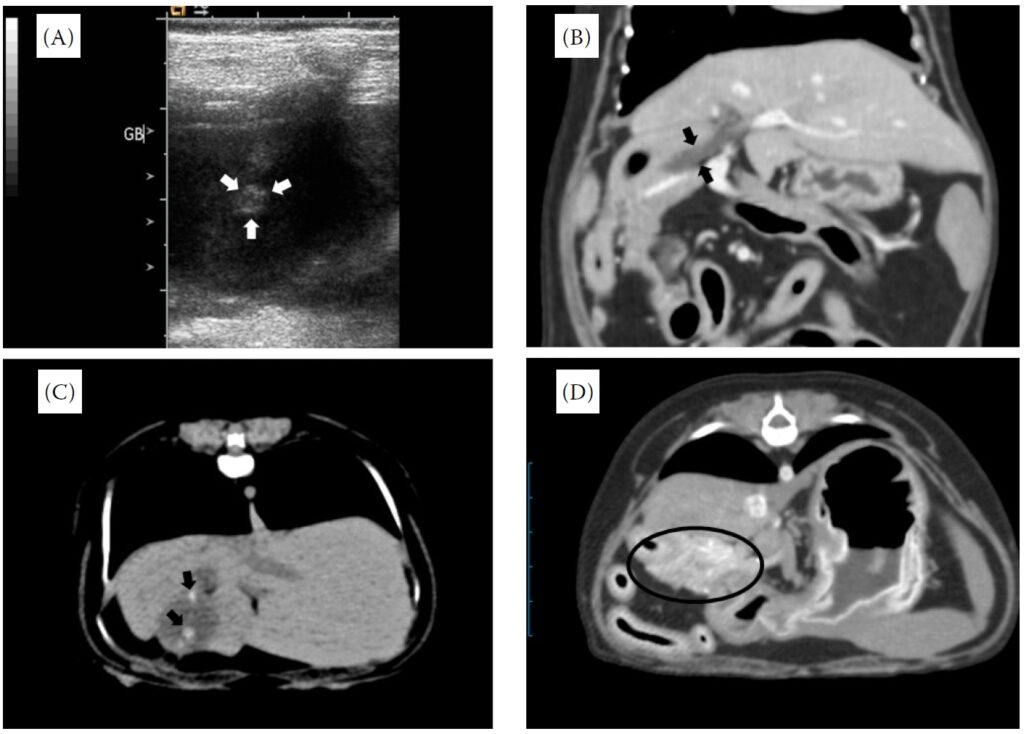
03 治疗
输液治疗并限制进食。怀疑该犬肝功能失调并伴有胆囊炎,可能是胆石症引起的。考虑进行胆囊切除术,但由于目前患者的胰腺炎是优先治疗项目,因此暂不实施手术。
甲硝唑(20 mg/kg皮下注射)治疗胆石症和胆汁淤积症引起的细菌过度生长,马罗吡坦(1 mg/kg皮下注射)止吐,甲磺酸加贝酯(1 mg/kg/h静注)降低胰腺炎死亡率。
3天后,呕吐和厌食的症状有所缓解,能主动进食和饮水。使用熊去氧胆酸(10 mg/kg口服)治疗肝功能障碍,并使用胰酶制剂治疗胰腺炎。2周后,异常指标恢复到正常范围。
04 预后
4年后又出现了类似的呕吐和厌食症状。根据主人提供的过去4年病史,证实患者曾出现间歇性轻微消化道症状。这些症状表现出短暂的自限性特征,在当地一家兽医院接受了间歇性胰腺炎治疗。
体格检查证实上腹疼痛,但牙龈粘膜未见黄疸。全血细胞计数结果显示轻度中性粒细胞增多。
淀粉酶28.79 μkat/l(3.34-20.04)和脂肪酶32.48 μkat/l(3.34-30.06)。胰腺炎特异性脂肪酶1521 μg/l(< 400),明显升高。与之前不同的是,肝脏相关指标几乎正常。
超声发现胆囊结构异常,包括一个5 mm高回声结节,其大小和外观与4年前发现的结节相似(下图A)。CT结果与超声相似,胆囊的径向大小约为5 mm(下图B)。总胆管直径为2.1 mm,正常开口于十二指肠(下图C)。胰腺体图像中还看到一个不规则的小囊性病变(下图D)。
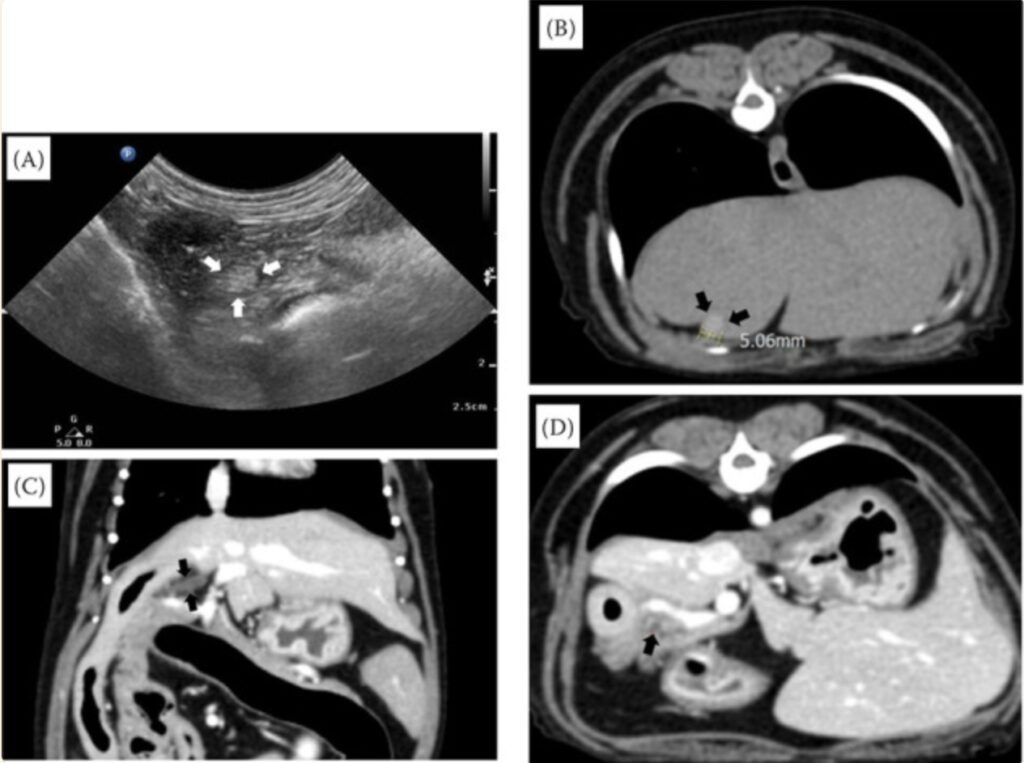
怀疑该犬患有胆囊萎缩,但未发现肝功能异常。因此在治疗胰腺炎时,与之前一样使用了液体治疗、马罗吡坦和甲磺酸加贝酯。
接受治疗后,患者的症状得到缓解,并康复出院。在随后的3年里,间歇性地出现与胰腺有关的厌食,但在其他方面保持了正常的生活质量。
05 讨论
胆囊萎缩(Gallbladder atrophy,GBA)是以胆囊体积缩小为特征的疾病。在人类中,胆囊萎缩通常与胆囊炎[1]、胆石症[1]、微小胆囊[2]、胆囊肿物[3]和胰腺炎[4]同时发生,并且经常在腹部超声检查中偶然被诊断出来[5]。此外,在患有囊性纤维化人群中也有显微镜下GBA的报道[6]。
对于患有慢性胆囊疾病(如胆囊炎或胆石症)的患者,长期的胆囊疾病会导致胰腺分泌增加,造成胰腺损伤和胰腺炎风险升高[4]。胰腺炎会对邻近的胆囊产生继发性影响。
胰腺炎引起GBA的确切机制尚不完全清楚,可能是炎症反应和胆汁流动动力学改变的结果。在胰腺炎病例中,炎症过程可延伸至胆囊,从而导致胆囊结构改变和功能受损。表现为胆囊壁变薄、收缩力下降,最终导致GBA。
本病例报告了一例独特的GBA并发胰腺炎病例,患者是一只7岁的约克夏梗,表现出胃肠道症状。最初的影像学检查发现了胰腺炎和胆囊结节的证据,4年后的随访结果也是如此。
由于肝脏负责将氨转化为尿素,尿素氮水平可能会因肝病而继发降低[7]。胆汁流动受损(胆汁淤积症)会导致碱性磷酸酶(ALP)和谷氨酰转肽酶(GGT)合成增加[8]。
ALP是犬胆汁淤积症的敏感指标[9]。胆汁淤积症患者在高胆红素血症之前会出现ALP活性升高[10]。ALT是一种主要存在于肝细胞中的肝酶,由于肝细胞受损,ALT会从肝细胞中渗出并在血液中增加[11]。AST主要与线粒体有关,但也存在于细胞质中。线粒体释放AST需要严重的损伤。因此,在肝细胞损伤时,ALT更容易释放,其活性通常高于血清AST[12]。
考虑到这些因素,推测本病例中的这只狗是由于胆石症引起胆汁淤积,从而导致肝功能异常。血液化验的异常结果被认为是胆汁淤积引起的变化。此外,胆汁淤积被认为是胰腺炎引起的继发性变化,胆道炎症和肝炎被推测为继发性。
胰腺炎和肝胆系统炎症经常同时发生在猫身上(三联症),推测是由胰腺和肝胆系统的升支感染引起的,主要是由于胃肠道系统的炎症[13]。在本病例中,该犬表现出呕吐和厌食,因此被诊断为胰腺炎。进一步的影像学检查发现疑似胆石症,但未发现梗阻迹象。该犬接受了胰腺炎和肝病治疗,最终康复。
四年后,该犬再次出现类似症状,但这次的影像学检查发现疑似萎缩。此外,其他与肝脏相关的血清化学检测指标(包括ALP)也未发现异常。本病例中的患者胆囊萎缩,导致肝脏产生的胆汁无法储存在胆囊中。可以推断胆汁淤积或胆汁通过胆总管进入肠道受阻或反流到肝脏等胆汁淤积性疾病并未发生。
GBA在人类中十分罕见。在兽医学领域,还没有关于猫狗GBA的报道,因此本病例尤其值得注意。此外,在胆囊癌中也可观察到萎缩的胆囊,这在人类中也有报道[14]。尽管该患者的治疗时间间隔较长,但通过首次治疗后4年的临床观察,在包括胆囊在内的身体任何部位都没有观察到肿瘤的迹象。因此,肿瘤并非本病例GBA的病因。
本病例报告介绍了在4年时间里观察到的自发性GBA,该犬被诊断为胰腺炎,并表现出轻微的消化道症状。值得注意的是,GBA是在未进行胆囊切除术的情况下发生的。
曾有报道称,人类的GBA与胰腺炎有关[4]。虽然对萎缩胆囊进行组织病理学检查具有最高的诊断价值,但在与主人进行详细讨论后,并没有进行活检。尽管没有进行活检,但根据临床和影像学随访证据报道了这例GBA病例。
参考文献
[1] Shirah BH, Shirah HA, Albeladi KB. Mirizzi syndrome: Necessity for safe approach in dealing with diagnostic and treatment challenges. Ann Hepatobiliary Pancreat Surg. 2017 Aug;21(3):122-30.
[2] Kramer NR, Karasick D, Karasick S. “Micro-gallbladder” – A clue to cystic fibrosis. J Can Assoc Radiol. 1983 Dec;34(4):271-2.
[3] Luo P, Wang C, Zhang G. A rare case report of chronic cholecystitis complicated with incomplete gallbladder volvulus. Int J Clin Exp Med. 2014 Oct 15;7(10):3602-4.
[4] Jiang F, Zhang J, Hu Z. Risk factors for pancreatitis occurrence after gallstone treatment using endoscopic retrograde cholangiopancreatography. Afri Health Sci. 2023;23(2):231-8.
[5] Maldonado CZ, Ruiz Lopez MJ, Gonzalez Valverde FM, Alarcon Soldevilla F, Pastor Quirante F, Garcia Medina V. Ultrasound findings associated to gallbladder carcinoma. Cir Esp. 2014 May;92(5):348-55.
[6] King LJ, Scurr ED, Murugan N, Williams SG, Westaby D, Healy JC. Hepatobiliary and pancreatic manifestations of cystic fibrosis: MR imaging appearances. Radiographics. 2000 May-Jun;20(3):767-77.
[7] Lee HW, Osis G, Handlogten ME, Guo H, Verlander JW, Weiner ID. Effect of dietary protein restriction on renal ammonia metabolism. Am J Physiol Renal Physiol. 2015 Jun 15;308(12):F1463-73.
[8] Siddique A, Kowdley KV. Approach to a patient with elevated serum alkaline phosphatase. Clin Liver Dis. 2012 May;16(2):199-229.
[9] Center SA, Slater MR, Manwarren T, Prymak K. Diagnostic efficacy of serum alkaline phosphatase and gamma-glutamyltransferase in dogs with histologically confirmed hepatobiliary disease: 270 cases (1980–1990). J Am Vet Med Assoc. 1992 Oct 15;201(8):1258-64.
[10] Taboada J, Meyer DJ. Cholestasis associated with extrahepatic bacterial infection in five dogs. J Vet Intern Med. 1989 Oct-Dec;3(4):216-21.
[11] McGill MR. The past and present of serum aminotransferases and the future of liver injury biomarkers. EXCLI J. 2016 Dec 15;15:817-28.
[12] Kim WR, Flamm SL, Di Bisceglie AM, Bodenheimer HC; Public Policy Committee of the American Association for the Study of Liver Disease. Serum activity of alanine aminotransferase (ALT) as an indicator of health and disease. Hepatology. 2008 Apr;47(4):1363-70.
[13] Simpson KW. Pancreatitis and triaditis in cats: Causes and treatment. J Small Anim Pract. 2015 Jan;56(1):40-9.
[14] Hatakeyama K, Nagakawa T, Suga T, Miyakawa H, Hirayama A, Matsunaga T, Okamura K, Suzuki H, Honma S, Okada K, Iwaguchi T, Muraoka S. [Carcinoma of the gallbladder which progress on the mucosa of choledochocolonic fistula]. Nihon Shokakibyo Gakkai Zasshi. 2009 Jul;106(7):1063-9. Japanese.