
| 一般情况 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:8岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:嗜铬细胞瘤 | |
01 主诉及病史
4个月前开始体重逐渐减轻,但食欲不变,伴有多尿/多饮和全身无力症状。
4年前作为流浪猫被领养到一个多猫家庭。除了在被收养一个月后因慢性龈口炎接受过全口拔牙手术外没有其他病史。猫白血病和猫免疫缺陷病毒检测均阴性。
02 检查
就诊时昏昏欲睡,体重偏低(3.3 kg),身体状况评分为2/9,伴有高血压(收缩压SBP为±200 mmHg)。胸部听诊有III/VI级全收缩期心脏杂音。腹部超声显示腹腔动脉和肠系膜动脉尾部有一个异质性结节。推测肿块来自左肾上腺(下图)。
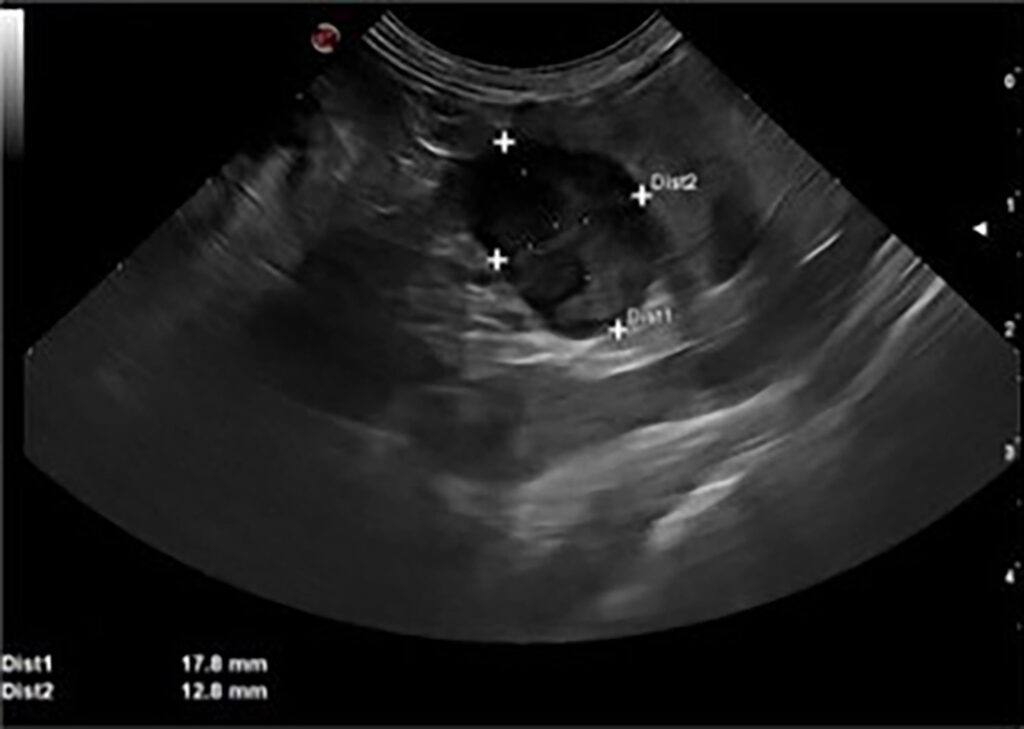
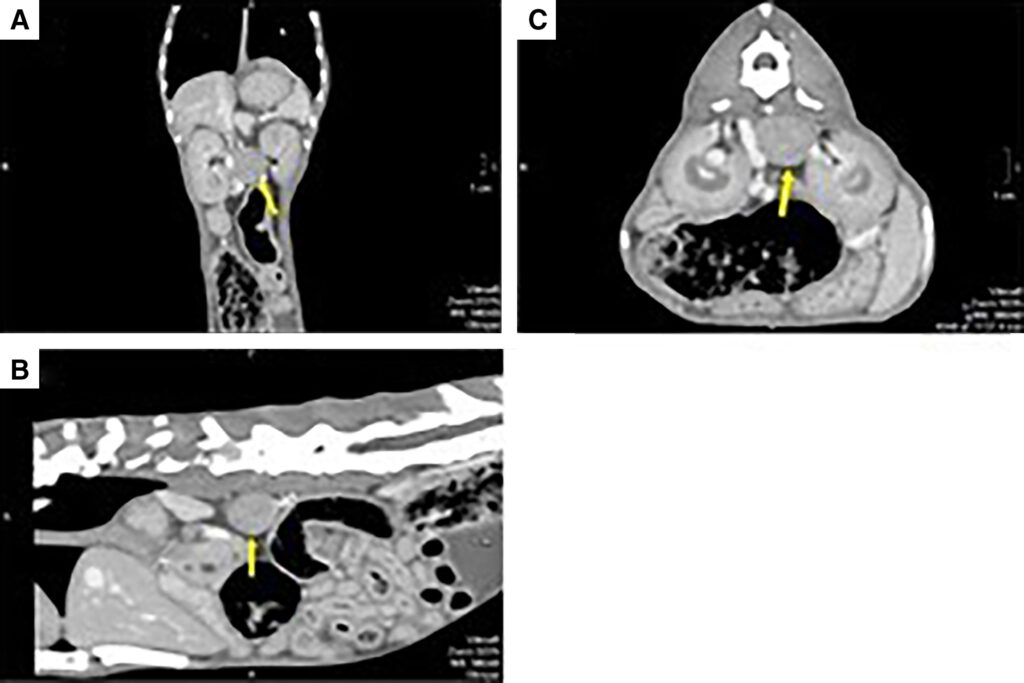
腹部CT发现左侧肾上腺有一个直径17 mm肿瘤,没有血管侵犯迹象,但肿块似乎附着在下腔静脉上,使其向腹侧偏转(下图)。对侧肾上腺大小和结构正常。胸部CT发现右肺上叶密度增高,怀疑炎症或感染,肿瘤可能性较小。建议进行细针穿刺,但被主人拒绝。
全血细胞计数和血生化显示轻度肌酐升高(2.5 mg/dL)和高钾血症(6 mmol/L)。尿液分析显示尿比重为1.021。开始服用氨氯地平(0.625 mg/盎司,q24h)来控制全身性高血压。
为了确定肾上腺肿瘤是否具有功能性,进行了内分泌检查。低剂量地塞米松抑制试验(LDDST)显示其对外源性地塞米松(0.1 mg/kg,IV)有适当的负反馈反应:皮质醇浓度在注射后4小时和8小时均低于1 μg/dL。因此皮质醇增多症被排除。
根据血浆醛固酮(151.62 pg/mL,参考:15-102)和血浆肾素活性(PRA)(0.86 ng/ml/h,参考:0.4-1.9),醛固酮/肾素比率为2.44(参考:0.3-3.8),血清钾浓度为6 mmol/L。
测量血浆甲肾上腺素(PL-MN)和去甲肾上腺素(PL-NMN),分别为4.60和54.87 nmol/L。虽然猫体内PL-MN和PL-NMN的参考值范围尚未确定,但该结果比之前报告的健康猫平均值高出4.2倍和15.6倍,正常值分别为1.1 nmol/L(0.25-3.3)和3.5 nmol/L(1.16-6.28)。
03 治疗
使用苯氧苄胺(PBZ)治疗(q12h,每次2.5 mg),每周测量体重和SBP,每两周测量血清肌酐和血钾。猫对PBZ耐受性很好,没有副作用。
开始服用PBZ两周后,尽管就诊时SBP(140-150 mmHg)正常,但在一次家中急性虚弱发作后氨氯地平被停用。8周后SBP(±150 mmHg)、血清肌酐(1.7 mg/dL)和血清钾(5.6 mmol/L)水平稳定,计划进行左肾上腺切除术。
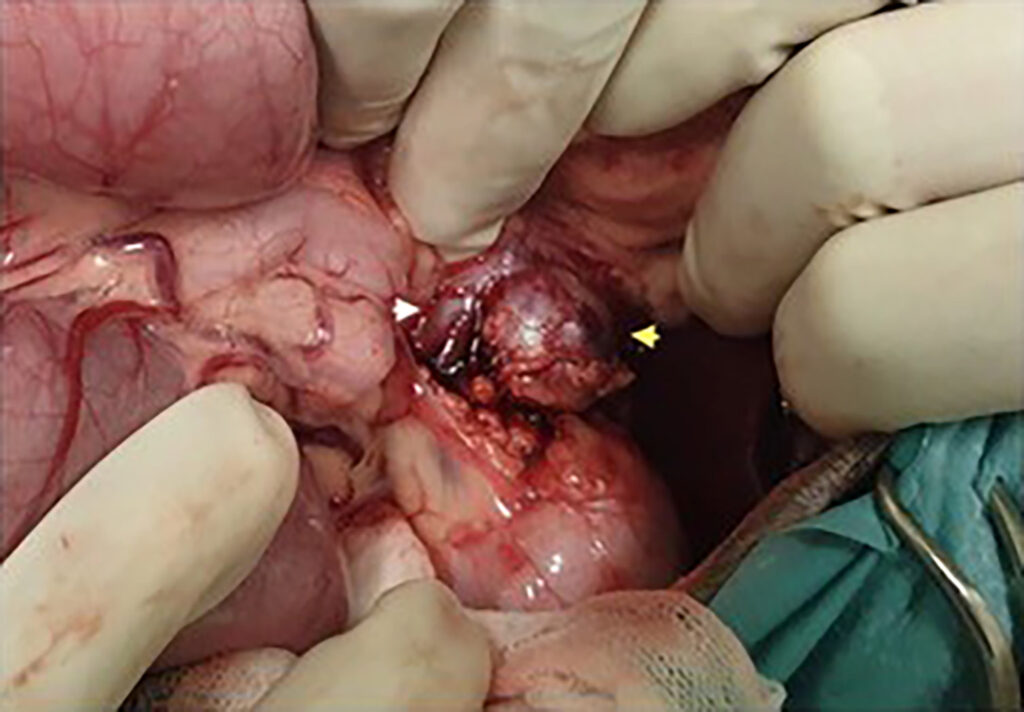
最后一剂PBZ在手术前一天晚上口服。腹腔镜手术使肾上腺肿块得以显露,由于肿块与下腔静脉壁粘连严重(下图),因此进行了肾上腺切除术和部分下腔静脉切除术。手术接近尾声时,当下腔静脉部分闭塞时,患者出现了一过性低血压。除了这次短暂的低血压外,术中没有出现其他并发症。术后恢复顺利,术后48小时出院。
术后病理显示,肾上腺肿块呈均匀的浅棕色,质地坚实,大小为1.5×1.7×1.4 cm。组织病理学分析表明,肾上腺皮质组织呈狭长带状,并伴有囊外增生灶。肾上腺主要由新生细胞小梁和含有姑息性新生细胞的纤维血管隔组成。肿瘤细胞的特征是在少量嗜两性细胞质内有多个大而长的椭圆形细胞核(下图)。有丝分裂指数较低。
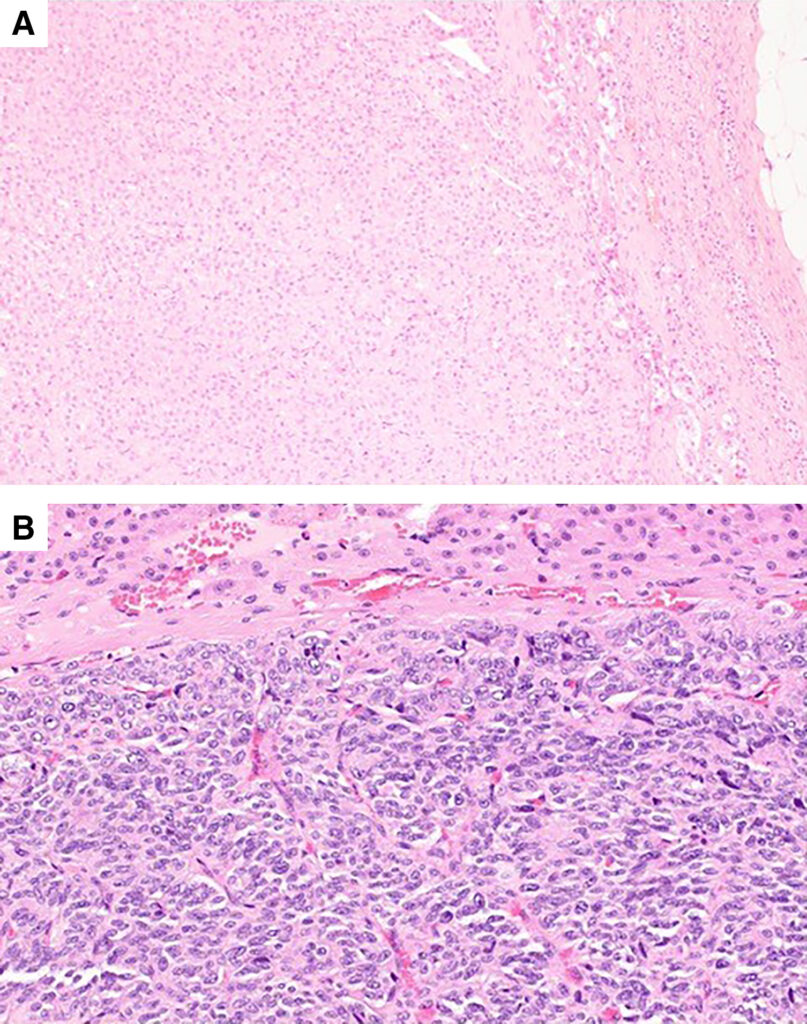
许多肿瘤细胞的突触素和嗜铬粒蛋白A染色阳性(下图)。这些结果证实了嗜铬细胞瘤(PCC)的诊断。
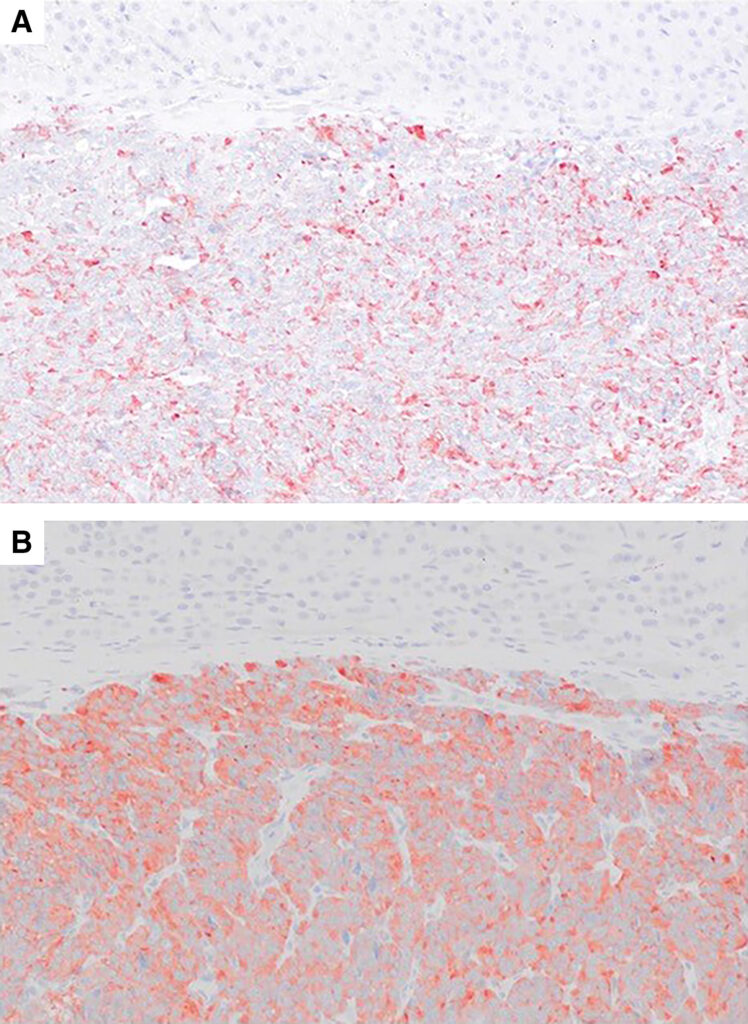
04 预后
在家中恢复良好,全身无力症状得到了缓解。主人报告说出现了短暂的厌食症,仍有一定程度的多尿。术后5周内,每周进行一次血压评估,血压值持续正常。此后评估延长到每两个月一次。
术后两个月,血清肌酐2.32 mg/dL。诊断为II期、非高血压、非蛋白尿慢性肾病。
手术7个月后,再次因急性衰竭、打喷嚏就诊。检查发现左侧瞳孔对光反射消失、左侧眼球外翻(据说已持续48小时)、口腔溃疡、恶病质,脱水率约为5%。考虑的诊断包括眼眶炎症、涎腺疾病、眼眶或其他周围组织肿瘤以及中枢神经系统的PCC转移。复查全血细胞计数和血生化指标,显示氮质血症持续存在,但病情稳定。主人拒绝头颅和胸部CT检查,并选择了安乐死。
05 讨论
肾上腺肿瘤在猫中并不常见,占猫所有肿瘤的0.2%[1]。嗜铬细胞瘤(Pheochromocytoma,PCC)是肾上腺髓质绒毛膜细胞产生儿茶酚胺的神经内分泌肿瘤[2]。在狗中诊断出PCC不常见,而在猫中PCC也很罕见,只有少数病例报告对其进行了描述[3-8]。
本病例报告描述了在一只猫体内发现肾上腺肿块并伴有严重高血压的PCC病例。根据文献综述,这是第一份包含猫科动物PCC生化诊断和组织病理学诊断的病例报告。此外,本病例报告还概述了猫肾上腺肿块的诊断方法。
不包括本病例报告在内,兽医文献中仅出现过6例经组织学确诊的PCC猫[3,4,6,7]。此外,还有两只猫被描述为疑似PCC,但未得到组织病理学证实[5,8]。
肾上腺髓质标志物嗜铬粒蛋白A和突触素的免疫组化以前仅应用于另一个病例的诊断干预,其中一个被诊断为肾上腺皮质腺瘤,而对侧腺体被诊断为PCC[6]。此前的猫PCC病例报告中,8只猫中有3只出现多尿,有两只出现全身性高血压[9]。本病例报告中的猫同时表现出这两种临床症状。
猫科动物肾上腺肿块并发高血压的主要鉴别诊断包括功能性皮质肿瘤(醛固酮瘤和皮质醇增多症)、PCC和肢端肥大症、甲状腺机能亢进和/或慢性肾脏病等非分泌性肾上腺肿瘤[2,9]。低剂量地塞米松抑制试验(LDDST)因其高灵敏度和中等特异性而被认为是诊断猫皮质醇增多症的首选试验[10,11]。
本患者对外源性糖皮质激素的负反馈反应排除了皮质醇增多症。血清醛固酮测定是猫原发性醛固酮增高症的诊断标志。它是系统性高血压低血钾症患者的首选检测方法,应结合血清钾浓度和血浆肾素活性(PRA)[12]。本病例报告中的这只猫的血清钾浓度偏高,血清醛固酮水平略有升高,PRA和醛固酮/肾素比值在参考范围内。如果肾上腺能自主分泌醛固酮,那么PRA和钾就会降低,因此醛固酮瘤的可能性不大。
肾上腺皮质肿瘤有能力合成和分泌皮质醇和醛固酮以外的类固醇激素,包括雄激素、雌激素和孕激素[9,13]。性激素分泌过多的猫可能会表现出毛发稀疏、皮肤萎缩和皮肤脆弱等临床症状,或者生殖器、尿液气味和性行为发生变化,这取决于分泌过多的性激素[14]。鉴于在该猫身上观察到的临床症状与报告的性激素分泌过多的猫的临床症状不一致,因此没有必要对其进行性激素内分泌检测[15,16,17]。
PCC的初步筛查应包括评估尿液和/或血浆中的甲氧基肾上腺素[18]。关于猫的这些生物标志物,目前仅有两项已发表的研究[5,19],其中一项研究为健康猫体内的PL-MN和PL-NMN参考范围提供了指导。
根据这项研究,本患者的PL-MN(4.60 nmol/L)和PL-NMN(54.87 nmol/L)测量值与PCC诊断相符[5]。由于没有血管侵犯的迹象,也没有远处转移性疾病的证据,因此进行了左肾上腺切除术。虽然目前还没有数据支持在猫科动物中使用PBZ来减少儿茶酚胺分泌过多的有害影响,但有研究表明,与未使用PBZ的狗相比,使用PBZ预处理的狗的围手术期死亡率明显降低[20]。因此,本病例在手术前开始使用PBZ(2.5 mg,q12h)。
由于主人拒绝接受其他诊断检查,因此猫安乐死前的诊断尚不清楚。本病例报告通过标准组织病理学和髓质标志物嗜铬粒蛋白A和突触素的免疫组化证实了猫的PCC。本病例报告强调,尽管PCC较为罕见,但应将其列入猫科动物肾上腺肿块的鉴别诊断中。由于表现出的症状通常没有特异性,因此临床认识是诊断PCC的关键第一步。
参考文献
[1] Lunn, K. F. & Boston, S. E. (2020) Chapter 26: Tumors of the endocrine system. In: Withrow & MacEwen’s Small Animal Clinical Oncology. Eds D. M. Vail, D. H. Thamm and J. M. Liptak. W.B. Saunders, St. Louis, MO, USA. pp 565-596.
[2] Galac, S. (2017) Chapter 311: Pheochromocytoma. In: Textbook of Veterinary Internal Medicine. Eds S. J. Ettinger, E. C. Feldman and E. Côté. Elsevier, St. Louis, MO, USA. pp 1838-1843.
[3] Henry, C. J., Brewer, W. G., Montgomery, R. D., et al. (1993) Clinical vignette. Journal of Veterinary Internal Medicine 7, 199-201.
[4] Chun, R., Jakovljevic, S., Morrison, W., et al. (1997) Apocrine gland adenocarcinoma and pheochromocytoma in a cat. Journal of the American Animal Hospital Association 33, 33-36.
[5] Wimpole, J. A., Adagra, C. F. M., Billson, M. F., et al. (2009) Plasma free metanephrines in healthy cats, cats with non-adrenal disease and a cat with suspected phaeochromocytoma. Journal of Feline Medicine and Surgery 12, 435-440.
[6] Calsyn, J. D. R., Green, R. A., Davis, G. J., et al. (2014) Adrenal pheochromocytoma with contralateral adrenocortical adenoma in a cat. Journal of the American Animal Hospital Association 46, 36-42.
[7] Daniel, G., Mahony, O. M., Markovich, J. E., et al. (2016) Clinical findings, diagnostics and outcome in 33 cats with adrenal neoplasia (2002–2013). Journal of Feline Medicine and Surgery 18, 77-84.
[8] Cervone, M. (2017) Concomitant multiple myeloma and probable phaeochromocytoma in a cat. Journal of Feline Medicine and Surgery Open Reports 3, 2055116917719209.
[9] Melián, C. & Pérez-López, L. (2019) Other adrenal cortical tumors and pheochromocytoma. In: Feline Endocrinology. Eds E. C. Feldman, F. Fracassi and M. E. Peterson. Edra S.p.A., Italy. pp 392-401.
[10] Chiaramonte, D. & Greco, D. S. (2007) Feline adrenal disorders. Clinical Techniques in Small Animal Practice 22, 26-31.
[11] Boland, L. A. & Barrs, V. R. (2017) Peculiarities of feline hyperadrenocorticism: update on diagnosis and treatment. Journal of Feline Medicine and Surgery 19, 933-947.
[12] Schulman, R. L. (2010) Feline primary hyperaldosteronism. Veterinary Clinics of North America: Small Animal Practice 40, 353-359.
[13] Reusch, C. (2015) Chapter 13: Pheochromocytoma and multiple endocrine neoplasia. In: Canine & Feline Endocrinology. Eds E. C. Feldman, R. W. Nelson, C. E. Reusch and J. C. R. Scott-Moncrieff. Elsevier, St. Louis, MO, USA. pp 521-554.
[14] Behrend, E. (2017) Chapter 308: Non-cortisol-secreting adrenocortical tumors and incidentalomas. In: Textbook of Veterinary Internal Medicine. Eds S. J. Ettinger, E. C. Feldman and E. Côté. Elsevier, St. Louis, MO, USA. pp 1819-1825.
[15] Rossmeisl, J., Scott-Moncrieff, J., Siems, J., et al. (2000) Hyperadrenocorticism and hyperprogesteronemia in a cat with an adrenocortical adenocarcinoma. Journal of the American Animal Hospital Association 36, 512-517.
[16] Boag, A. K., Neiger, R. & Church, D. B. (2004) Trilostane treatment of bilateral adrenal enlargement and excessive sex steroid hormone production in a cat. Journal of Small Animal Practice 45, 263-266.
[17] Millard, R. P., Pickens, E. H. & Wells, K. L. (2009) Excessive production of sex hormones in a cat with an adrenocortical tumor. Journal of the American Veterinary Medical Association 234, 505-508.
[18] Galac, S. & Korpershoek, E. (2017) Pheochromocytomas and paragangliomas in humans and dogs. Veterinary and Comparative Oncology 15, 1158-1170.
[19] Sasaki, N., Ikenaka, Y., Inoue, Y., et al. (2021) Urinary free metanephrines measurement in dogs with adrenal gland diseases using a new simple liquid chromatography tandem mass spectrometry method. Journal of Veterinary Medical Science 83, 648-655.
[20] Herrera, M. A., Mehl, M. L., Kass, P. H., et al. (2008) Predictive factors and the effect of phenoxybenzamine on outcome in dogs undergoing adrenalectomy for pheochromocytoma. Journal of Veterinary Internal Medicine 22, 1333-1339.