
| 一般情况 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:8岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:颅内黑色素瘤 | |
01 主诉及病史
服用单次剂量为20 mg/kg的加巴喷丁后三天不愿活动。
3周前开始不愿活动、睡眠习惯改变、腰部触诊疼痛,2周前出现共济失调和四肢无力。
02 检查
腰椎、骨盆和膝关节X光片显示正常。口腔检查、淋巴结触诊和皮肤表面触诊,除了肥胖外没有其他异常。患者轻度肥胖,四肢瘫痪,本体感觉减退(左侧比右侧差)。脊髓反射和颅神经检查正常。全血细胞计数和血清生化检查无异常。
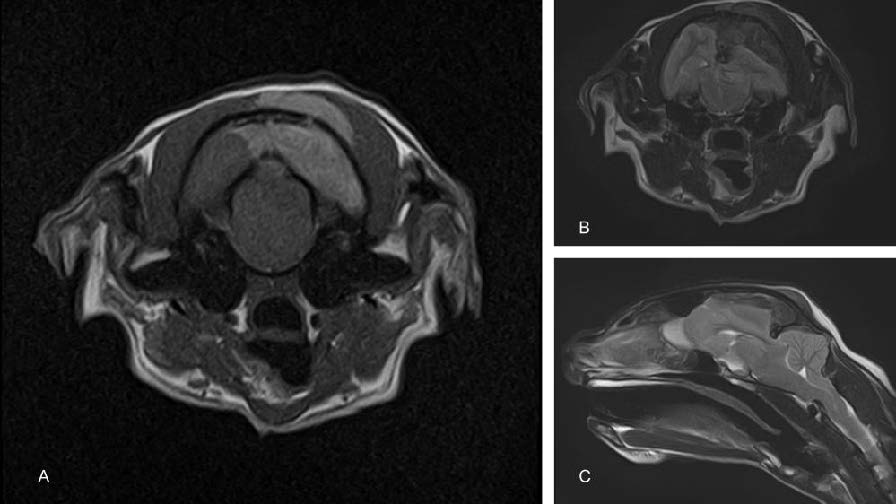
脑部MRI检查显示颅顶左侧有一个占位性病变,压迫顶叶和枕叶,导致中线移位(下图)。椎孔疝也很明显。肿块在T2W和FLAIR图像上呈低密度,在T1W图像上呈高密度。顶骨颅外一侧的肌肉内也出现了类似强度的浸润。
病灶细针穿刺显示,细胞在嗜酸性背景下含有大量蓝色/黑色不规则形状的细小颗粒,外观类似黑色素。有核细胞由圆形至多面体的多形性细胞组成,表现出明显的核异质性,细胞外间隙中还可见蓝黑色颗粒(下图)。怀疑黑色素瘤可能性大。

03 尸检
由于预后不佳,患者被实施了安乐死,并进行了尸检。
头颅内发现了一个形状不规则、柔软、易碎、结节状的深棕黑色肿块,直径约50 mm,与额骨和脑膜相连。肿块穿过大脑半球和小脑背侧的脑膜,遮盖了其背侧多达80%的区域。脑膜病变呈凝聚状、柔软、模糊不清、扁平和斑块状,遮盖了下层神经实质(下图)。
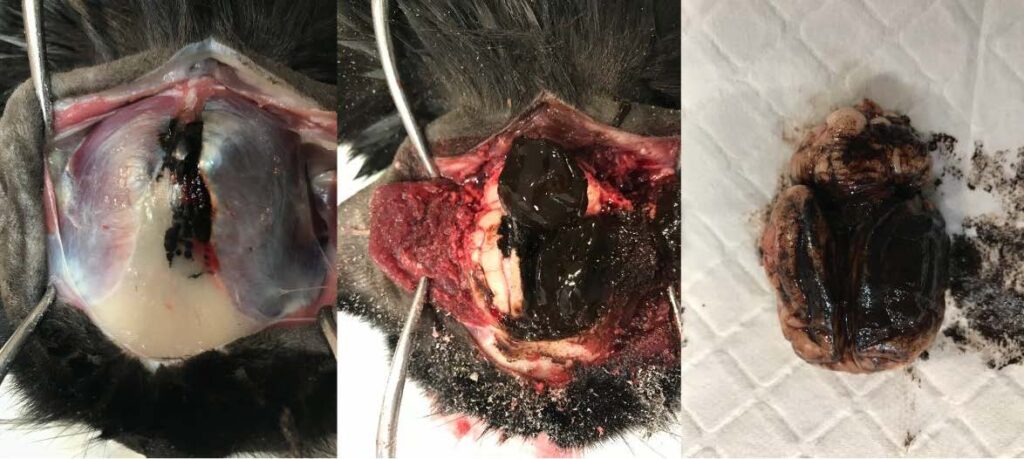
结节状至斑块状暗棕黑色肿块病变侵蚀额骨和顶骨约60%的面积,并穿过额骨和顶骨,形成较小的斑块状病灶,浸润枕骨约10%面积。结节状、柔软、大小不一(1-10 mm)的病变随机分布在肺、肾、肝和脾中。
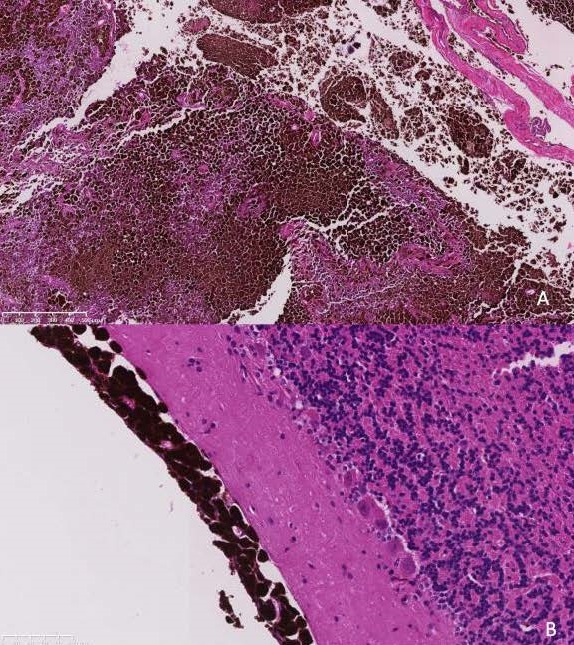
肿块组织病理学显示,这是一种分界适中、无包膜、细胞密集的肿瘤,浸润并取代了致密的纤维结缔组织基质,形成片状、条索状和巢状。单个肿瘤细胞呈多形性,主要为纺锤形,也有圆形或少见的多角形,具有大量嗜酸性细胞质,内含大量棕黑色素颗粒(黑色素)和单个细胞核。细胞核呈圆形至椭圆形,有一个突出的核仁,染色质呈条纹状。有无核分裂,在10个高倍视野中只发现不到一个有丝分裂。肿瘤浸润了硬脑膜、骨和骨骼肌。肿瘤没有超出脑膜浸润到邻近的脑实质中(下图)。
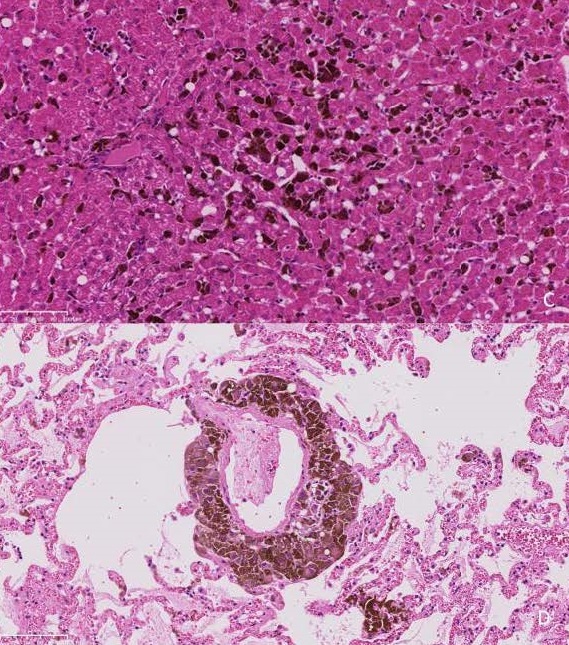
在肝脏内,肝细胞多处随机地被肿瘤细胞群分隔开(下图上)。肺间质多处随机扩张并被新生物浸润(下图下)。在脾脏,新生物广泛地取代了脾脏。肾脏中出现浸润性、界限清楚、无包膜的肿瘤,其组织学特征与之前描述的相似。最终诊断结果为原发性脑膜黑色素瘤伴广泛转移。
04 讨论
黑色素瘤是由特定组织中的黑色素细胞失控增殖引起的,具有不同的亚型:皮肤、粘膜、眼部和脑膜[1]。猫身上任何部位的黑色素瘤都不常见[1],而且与其他物种不同,猫眼部黑色素瘤比口腔或皮肤黑色素瘤更常见[2]。
中枢神经系统黑色素瘤以前也曾在猫身上出现过,但仅表现为直接侵袭性眼部病变或远处脊柱转移瘤[3]。在人类中,中枢神经系统可能会受到各种黑色素细胞病变的影响,包括良性黑色素细胞瘤和恶性转移性黑色素瘤[4]。颅内原发性脑膜黑色素瘤非常罕见,这种黑色素瘤可能是弥漫性侵入颅内并扩散到蛛网膜下腔的黑色素瘤,也可能是形成结节性肿瘤的黑色素瘤[4,5]。
MRI是诊断颅内局部病变的首选方法。大多数病变在T1加权序列上表现为低密度[5],但黑色素瘤相反。顺磁性物质,如钆对比剂和高铁血红蛋白,以及某些矿物质(钙、铜、铁和锰)、含脂肪和富含蛋白质的物质,都会在T1加权图像上出现高密度。黑色素也具有顺磁性,在T1加权图像上表现为高强度,而在T2加权图像上则表现为低强度。
本病例报告在一只出现神经系统疾病的猫的颅内和颞肌中发现了一个巨大的占位性T1高密度病变。细胞学检查证实为黑色素瘤,随后的尸检进一步确定了颅内肿块,并在脾脏、肝脏、肺部和肾脏发现了随机分布的较小病灶,符合远处转移。
该病例并不常见,因为在体格检查以及眼部和视神经MRI中均未发现皮肤、眼部或粘膜原发肿瘤,临床诊断依据是神经功能缺损、T1加权图像上高强度病变以及细胞学检查。
本研究作者认为肿瘤发生的原发部位是在脑膜下,这并不是没有道理的。因为在猫的脑膜下已经发现了来源于神经嵴的色素细胞[12],而且人类的原发性中枢神经系统黑色素瘤也是来源于脑膜下的黑色素细胞[13]。本病例中的肿瘤主要位于脑膜外,没有向邻近的脑实质浸润,这也支持了这一解释。
以前关于猫中枢神经系统黑色素瘤的描述是多发性浸润性黑色肿块[10],与本病例中观察到的病变相比,更像是转移性扩散。原发性中枢神经系统黑色素瘤在人类中并不常见[13],仅有一份关于狗的报告中提到原发性中枢神经系统黑色素瘤[9]。
最近一份关于324只猫非眼部黑色素瘤的病例系列中,没有描述一例颅内病例[7]。人们已经认识到,肿瘤细胞会通过动脉或静脉循环、与肿瘤的亲密接触或沿神经周围间隙的向心性进展扩散到脑膜[14]。因此,本病例考虑了颅内转移的可能性。但是,考虑到肿块相对较大,与肿瘤发生的原发部位一致,颅内转移的可能性较小。在脑内也没有发现转移灶。其余器官播散的随机分布模式与这些部位的转移一致。
该病例的组织病理学还有其他一些不同寻常之处。在推测的原发肿瘤部位没有出现局部神经实质浸润,这有点出乎意料,因为上覆的额骨/顶骨出现了广泛的局部浸润。也许随着时间的推移,下方的大脑可能也会出现局部播种。
根据部位的不同,分级方案[7]将10个高倍视野中有丝分裂数大于或等于4和/或瘤内坏死认定为高级别肿瘤,与中位生存时间缩短、预后不良有关。本病例中的肿瘤既没有有丝分裂数增高,也没有瘤内坏死,因此应该属于低级别。这凸显了黑色素瘤预后评估方面的挑战,犬类患者的预后评估已得到广泛讨论[18]。
总的来说,本病例很可能是原发性颅内黑色素瘤,但必须认识到区分原发性和转移性黑色素瘤的难度。因此,重要的是要认识到黑色素瘤是猫颅内肿块的一个潜在鉴别诊断,而且由于黑色素瘤在T1图像上的异常高密度,在MRI图像上很容易被识别出来,而其他肿瘤通常不会出现这种情况。
参考文献
1. van der Weyden L., Brenn T., Patton E.E., Wood G.A., Adams D.J. Spontaneously occurring melanoma in animals and their relevance to human melanoma. J. Pathol. 2020;252:4–21.
2. Patnaik A.K., Mooney S. Feline melanoma: A comparative study of ocular, oral, and dermal neoplasms. Vet. Pathol. 1988;25:105–112.
3. Fert S., River P., Bondonny L., Cauzinille L. Metastatic extradural melanoma of the lumbar spine in a cat. Vet. Med. Sci. 2023;9:2393–2398.
4. El Ouazzani H., Oudghiri M.Y., Abbas S., Regragui A., Elouahabi A., Zouaidia F., Cherradi N. Diagnostic challenge: Primary leptomeningeal melanoma with melanomatosis, illustrative case report. J. Surg. Case Rep. 2023;12:rjad323.
5. Zimny A., Zińska L., Bladowska J., Neska-Matuszewska M., Sąsiadek M. Intracranial lesions with high signal intensity on T1-weighted MR images—Review of pathologies. Pol. J. Radiol. 2013;78:36–46.
6. Chamel G., Abadie J., Albaric O., Labrut S., Ponce F., Ibisch C. Non-ocular melanomas in cats: A retrospective study of 30 cases. J. Feline Med. Surg. 2017;19:351–357.
7. Pittaway R., Dobromylskyj M.J., Erles K., Pittaway C.E., Suárez-Bonnet A., Chang Y.M., Priestnall S.L. Nonocular melanocytic neoplasia in cats: Characterization and proposal of a histologic classification scheme to more accurately predict clinical outcome. Vet. Pathol. 2019;56:868–877.
8. Luna L.D., Higginbotham M.L., Henry C.J., Turnquist S.E., Moore A.S., Graham J.C. Feline Non-Ocular Melanoma: A Retrospective Study of 23 Cases (1991–1999) J. Feline Med. Surg. 2000;2:173–181.
9. Perez Lopez P., Rasotto R., Caine A., Cherubini G.B. Malignant melanoma with central nervous system involvement in a dog treated with surgery, radiotherapy and chemotherapy. Vet. Rec. Case Rep. 2018;6:e000570.
10. Lemetayer J., Al-Dissi A., Tryon K., MacDonald-Dickinson V. Primary intranasal melanoma with brain invasion in a dog. Can. Vet. J. 2017;58:391–396.
11. Roels S., Ducatelle R. Malignant melanoma of the nictitating membrane in a cat (Felis vulgaris) J. Comp. Pathol. 1998;119:189–193.
12. Morse D.E., Cova J.L. Pigmented Cells in the Leptomeninges of the Cat. Anat. Rec. 1984;210:125–132.
13. Fujimori K., Sakai K., Higashiyama F., Oya F., Maejima T. Miyake T Primary central nervous system malignant melanoma with leptomeningeal melanomatosis: A case report and review of the literature. Neurosurg. Rev. 2018;41:333–339.
14. Taillibert S., Chamberlain M.C. Leptomeningeal metastasis. In: Schiff D., Van Den Bent M.J., editors. Handbook of Clinical Neurology Metastatic Disease of the Nervous System. Volume 149. Elsevier; Amsterdam, The Netherlands: 2018. pp. 169–204.
15. Shi Y., Bing Z., Xu X., Cui Y. Primary pulmonary malignant melanoma: Case report and literature review. Thorac. Cancer. 2018;9:1185–1189.
16. Hayward R.D. Malignant melanoma and the central nervous system. A guide for classification based on the clinical findings. J. Neurol. Neurosurg. Psychiatry. 1976;39:526–530.
17. Kelly J., Redmond H.P. Melanoma of unknown origin: A case series. Ir. J. Med. Sci. 2010;179:629–632.
18. Smedley R.C., Spangler W.L., Esplin D.G., Kitchell B.E., Bergman P.J., Ho H.Y., Bergin I.L., Kiupel M. Prognostic markers for canine melanocytic neoplasms: A comparative review of the literature and goals for future investigation. Vet. Pathol. 2011;48:54–72.