
| 一般情况 | |
|---|---|
 | 品种:古代牧羊犬 |
| 年龄:7个月 | |
| 性别:雌 | |
| 是否绝育:否 | |
| 诊断:播散性组织细胞肉瘤 | |
01 主诉及病史
持续咳嗽、食欲不振和嗜睡两周。
使用多西环素(10 mg/kg PO q24h)和泼尼松(0.7 mg/kf PO q24h)治疗10天没有效果。
02 检查
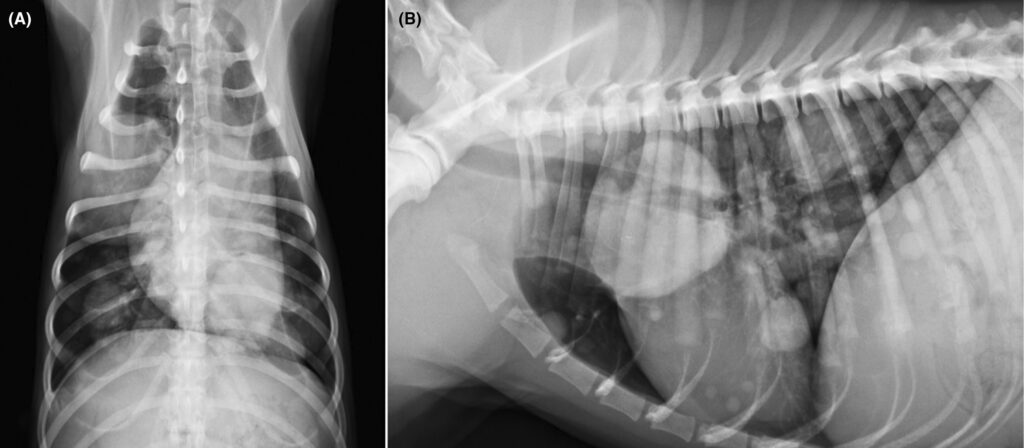
神志清楚、反应灵敏。肺部听诊显示右侧中半胸肺音轻度减弱。胸部X光发现多个分布在各个肺叶的多发、环状、大小不一的软组织不透明结节。最大的一个大约有三个椎体长,位于右肺中叶。没有明显的胸部淋巴结肿大迹象(下图)。
血液检测显示轻度正红细胞正色素性非再生性贫血,PCV为35%(37.3%-61.7%),白细胞增多,为17.76×10^3/μL(5.05-16.76),成熟中性粒细胞增多,为14.21×10^3/μL(2.95-11.64)。
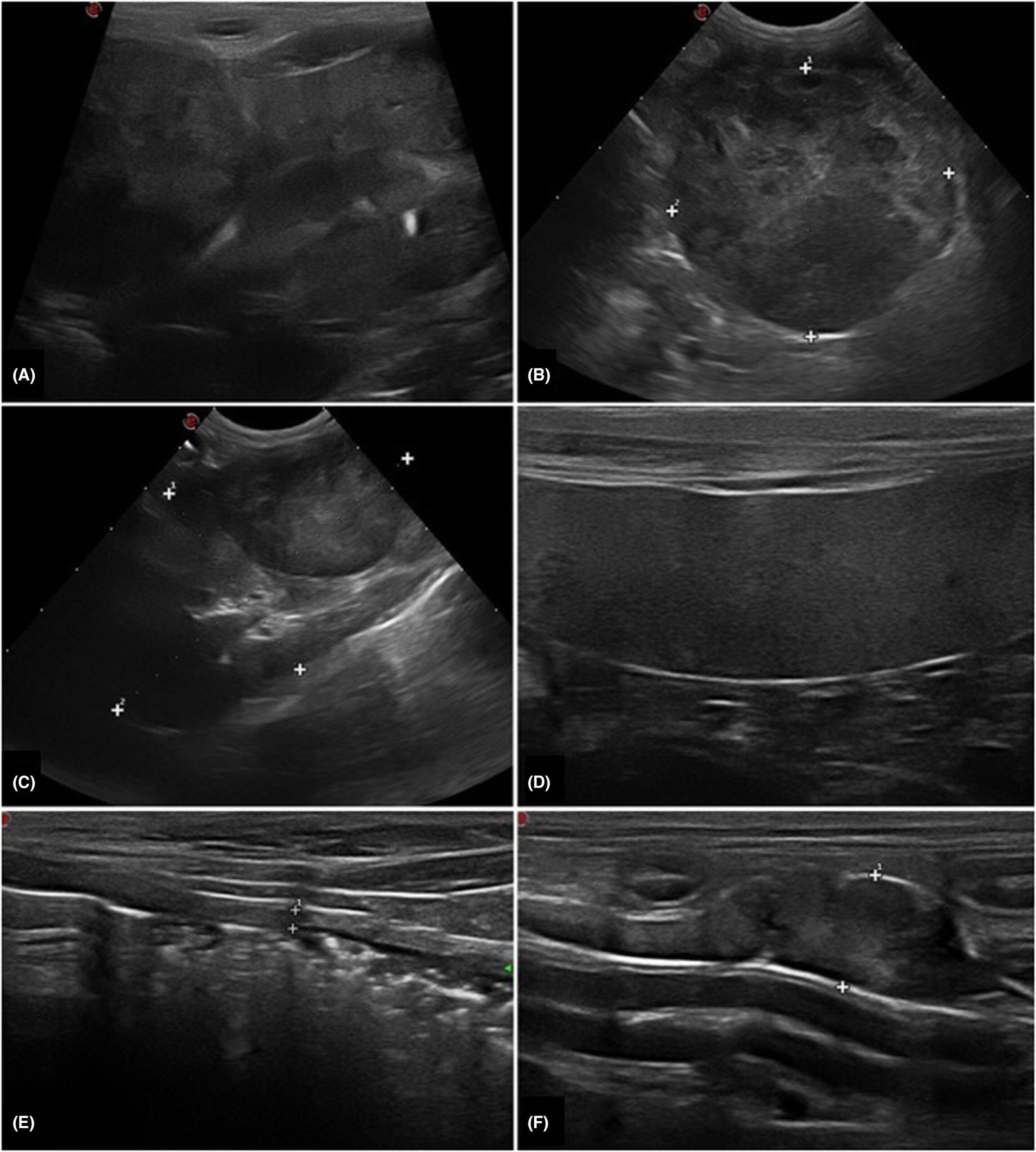
腹部超声显示双肾多个不均匀、圆形结节(直径从6 mm到4.5 cm不等),回声混杂,囊膜变形。部分病灶呈空洞状,左肾发现低回声囊下影(下图A-C)。脾脏实质呈斑驳状,有几个边界不清的低回声结节(下图D)。空肠和髂内侧淋巴结轻度肿大且不均匀。结肠壁轻度弥漫性增厚,保留了结肠壁分层,黏膜下有多个低回声小结节,提示结肠炎(下图E-F)。
对肾脏和肺部肿块进行了细针穿刺。细胞学检查显示细胞体积较大(10-50 μm),呈圆形至轻度星形,可单独脱落或呈非粘附性聚集。细胞核呈圆形或椭圆形,位于中心或中心周围,染色质呈细条纹状或花边状,有多个大小和形状不一的核小体。细胞核与细胞质的比例适中,细胞质呈中度嗜碱性,有许多小的点状透明空泡。其中少数细胞还含有少量蓝色色素(下图)。
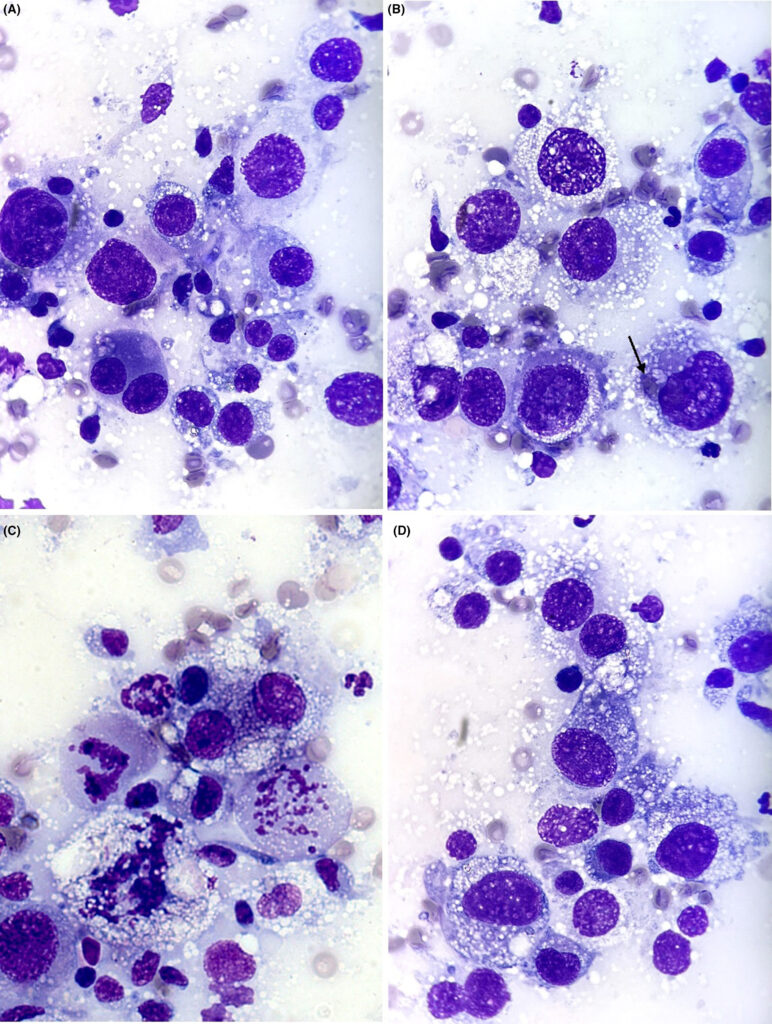
这些细胞显示出许多恶性标准,包括中度异核和无核、偶见双核、偶见大核和异常有丝分裂象。还发现了少量的小淋巴细胞、未变性的中性粒细胞和巨噬细胞,以及间质细胞,并伴有轻度异形细胞增多和无核化。细胞学表现提示为恶性间质肿瘤,也不能完全排除其他组织细胞病变,如系统性组织细胞增生症或朗格汉斯细胞组织细胞增生症。
03 预后
由于高度怀疑为预后不良的播散性恶性肿瘤,尽管使用了抗生素和类固醇治疗,其临床症状仍迅速恶化,因此进行了安乐死。
04 尸检
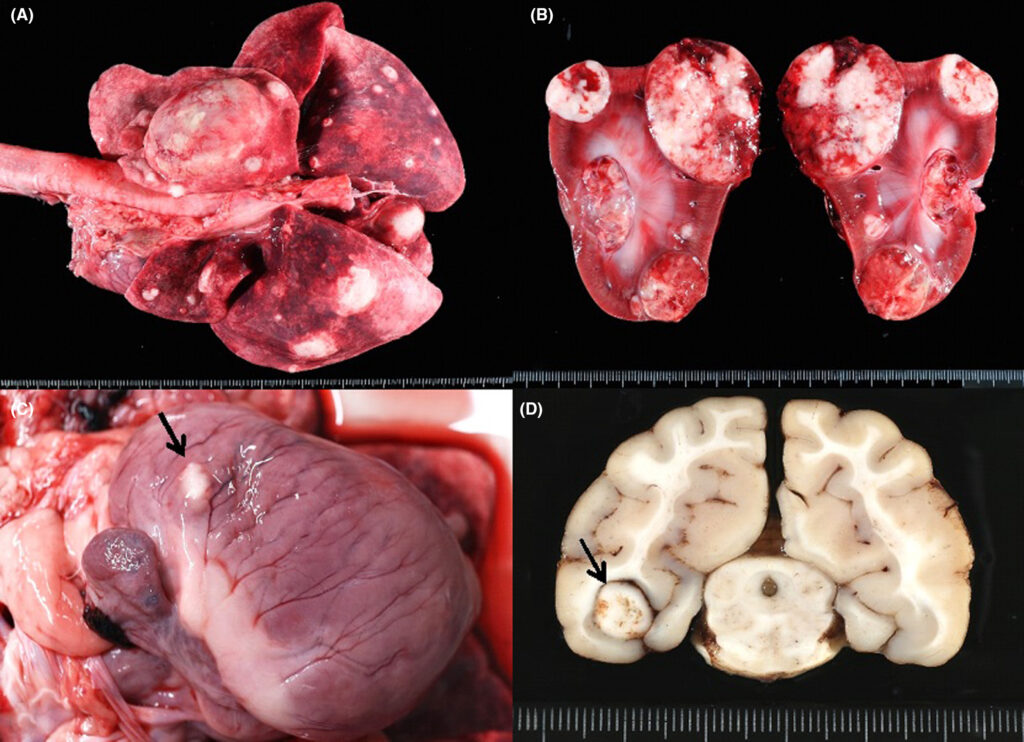
尸检发现肾皮质和髓质均有多个0.5-5 cm实性结节。切片呈现苍白和不均匀褐色。在肺实质、肝脏、心脏、大脑梨状叶和半腱肌中也发现了多个大小不一、外形相似的结节(下图)。切片显示,脾脏呈白色斑驳状,但未发现明显结节。髂淋巴结也出现了同样的宏观变化。从宏观上看,股骨骨髓呈正常的淡红色。细胞学检查观察到所有前体细胞处于不同的成熟阶段,没有发现肿瘤细胞。与超声结果相反,结肠中没有发现病变。
从组织学角度看,结节都由界限清楚、无包膜、细胞密集的肿瘤增生组成,侵犯了肾、肺、心脏、肝脏和左侧梨状叶实质。肿瘤细胞呈实性片状排列,由细小的纤维血管基质支撑,形态呈圆形,胞浆边界清晰,呈中度嗜酸性颗粒状。细胞核呈卵圆形至椭圆形,轻度偏心,染色质开放,有一个或多个突出核仁(下图)。在梨状叶结节中,异形细胞增多和异形核增多明显,在其他结节中为中度,有丝分裂计数为中度(4-5个有丝分裂数/2.37 mm2)。还可见异常的有丝分裂。在梨状叶结节、心脏和肾脏中观察到大面积的溶解性坏死。脾脏和髂淋巴结显示出中度滤泡性淋巴增生,没有肿瘤浸润。

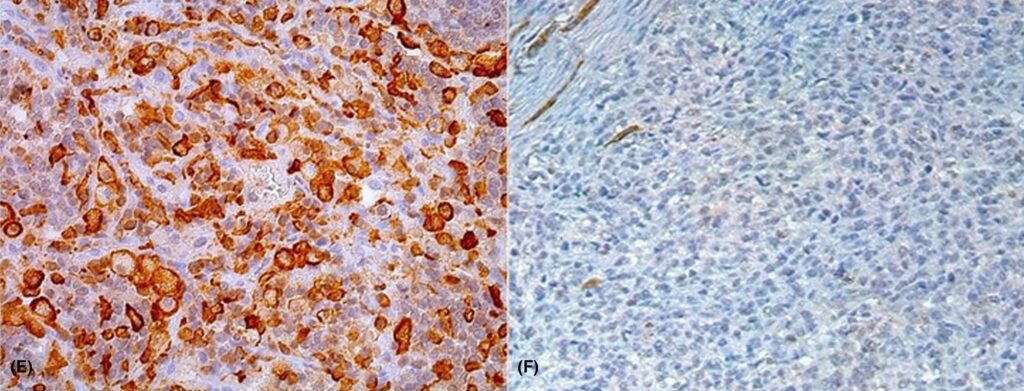
对双肾、心脏、肺、肝、脾和梨状叶的样本进行了IBA1、E-粘连蛋白免疫组化染色,以排除朗格汉斯细胞来源(下图)。根据临床演变、宏观位置、组织学结果和免疫组化结果,该肿瘤被诊断为播散性组织细胞肉瘤(HS),累及双肾、肺、心脏、肝脏和左侧梨状叶。
05 讨论
“组织细胞”是用来描述一类树突状细胞(DC)的术语,如朗格汉斯细胞(LC)和间质DC。组织细胞在免疫系统中发挥着不可或缺的作用,是强有力的抗原递呈细胞或吞噬细胞[1]。影响犬的组织细胞疾病最早出现在20世纪70年代末[2]。迄今为止,在犬身上已经发现了几种定义明确的组织细胞增生性疾病。大多数涉及LC(组织细胞瘤和皮肤LC组织细胞增生症)或间质DC[皮肤组织细胞增生症、系统性组织细胞增生症、组织细胞肉瘤(HS)]的增生。嗜血细胞组织细胞肉瘤(HHS)是目前唯一被证明起源于巨噬细胞的犬猫组织细胞疾病[1]。
本病例报告中确诊的HS最常见于间质DC[3]。它既发生在犬也发生在猫,在犬淋巴系统肿瘤中所占的比例不到1%[3],在猫中的发病率要低得多[4]。
HS最早出现在伯恩山犬身上,并被认为与家族遗传有关[5]。伯恩山犬和平毛寻回犬的品种易感性特别强[6]。虽然在普通犬类中发病率较低,但在其他犬种(包括罗威纳犬、金毛寻回猎犬、迷你雪纳瑞犬和威尔士柯基犬)中也发现了HS的易感性[1,6-8]。虽然任何犬种都有可能患病,但本文描述的病例是一只古代牧羊犬,这是该犬种首次报告的HS病例。
本病例的年龄(7个月大)也非典型,因为HS常见于中老年犬[3]。HS偶尔也见于3岁以下的犬,累及膀胱[9]、播散型[10]和皮肤型[11]。在一项研究中,恶性肿瘤的平均发病年龄为9岁,3岁以下犬的肿瘤多为良性[12]。造血肿瘤、脑肿瘤和皮肤肿瘤也是1岁以下犬最常患的恶性肿瘤[13]。根据本病例,建议将HS作为组织细胞疾病的潜在鉴别诊断,无论患者年龄大小。
间质DC几乎存在于所有组织中,因此HS几乎可以出现在任何部位。据报道,HS的解剖部位包括肺、淋巴结、肝、脾、胃、肠、胰腺、纵隔、皮肤和皮下组织、骨骼肌、中枢神经系统、骨、关节间隙、骨髓、鼻腔和眼睛[1,3]。HS可表现为局部肿瘤,也可表现为多器官受累(播散性HS)[1,3]。
播散性HS很难与恶性组织细胞增生症相鉴别。恶性组织细胞增生症的特点是同时出现在多个器官的播散性病变。由于几乎无法确定这些病变是从原发部位转移而来还是同时出现,目前公认的术语将这两种情况都称为播散性HS[3]。在本报告中,尽管与其他器官相比,肾脏和肺部的肿块最大,但仍无法确定原发部位。因此,最终诊断为播散性HS。
由于播散型HS具有高度侵袭性,有效的治疗通常需要局部(手术和/或放疗)和全身(化疗)治疗[17]。播散型HS可单用全身化疗治疗[3]。即使接受了治疗,播散型HS仍会迅速恶化,大多数犬在初次诊断后数天内即被安乐死[3]。
洛莫司汀是使用最多的药物[3,18]。尽管使用了洛莫司汀,但由于其侵袭性和快速进展,最近在临床和实验中对犬播散性HS的替代化疗方案进行了评估,如多柔比星和洛莫司汀联合用药[19]、达沙替尼[20]、达卡巴嗪[21]、表柔比星[22]或其他药物[23-25]。
总之,本病例提示,无论犬的品种、解剖位置和年龄如何,尤其是当细胞学或组织病理学发现具有组织细胞特征的圆形细胞时,均应将播散性HS作为鉴别诊断的一个因素。
参考文献
1. Moore PF. A review of histiocytic diseases of dogs and cats. Vet Pathol. 2014;51(1):167-184.
2. Glick AD, Holscher M, Campbell GR. Canine cutaneous histiocytoma: ultrastructural and cytochemical observations. Vet Pathol. 1976;13(5):374-380.
3. Mullin C, Clifford CA. Histiocytic sarcoma and hemangiosarcoma update. Vet Clin North Am Small Anim Pract. 2019;49(5):855-879.
4. Kraje AC, Patton CS, Edwards DF. Malignant histiocytosis in 3 cats. J Vet Intern Med. 2001;15(3):252-256.
5. Abadie J, Hédan B, Cadieu E, et al. Epidemiology, pathology, and genetics of histiocytic sarcoma in the Bernese Mountain dog breed. J Hered. 2009;100(1):19-27.
6. Takahashi M, Tomiyasu H, Hotta E, et al. Clinical characteristics and prognostic factors in dogs with histiocytic sarcomas in Japan. J Vet Med Sci. 2014;76(5):661-666.
7. Hedan B, Thomas R, Motsinger-Reif A, et al. Molecular cytogenetic characterization of canine histiocytic sarcoma: a spontaneous model for human histiocytic cancer identifies deletion of tumor suppressor genes and highlights influence of genetic background on tumor behavior. BMC Cancer. 2011;11:201.
8. Purzycka K, Peters LM, Elliott J, et al. Histiocytic sarcoma in miniature schnauzers: 30 cases. J Small Anim Pract. 2020;61(6):338-345.
9. Amores-Fuster I, Elliot J, Freeman A. Histiocytic sarcoma of the urinary bladder in a dog. J Small Anim Pract. 2011;52(12):665.
10. Black J, Villalba W, Dial S. Pathology in practice. JAVMA. 2015;247(7):755-757.
11. Mastrorilli C, Spangler EA, Christopherson PW, et al. Multifocal cutaneous histiocytic sarcoma in a young dog and review of histiocytic cell immunophenotyping. Vet Clin Path. 2012;41(3):412-418.
12. Brønden LB, Nielsen SS, Toft N, Kristensen AT. Data from the Danish veterinary cancer registry on the occurrence and distribution of neoplasms in dogs in Denmark. Vet Rec. 2010;166(19):586-590.
13. Kekker E, Madewell B. Locations and types of neoplasms in immature dogs: 69 cases (1964–1989). J Am Vet Med Assoc. 1992;200(10):1530-1532.
14. Sapierzyński R, Jagielski D, Dolka I, Fabisiak M. Cytopathological diagnosis of visceral histiocytic sarcoma in five dogs. Pol J Vet Sci. 2012;15(4):751-758.
15. Pierezan F, Mansell J, Ambrus A, Hoffmann AR. Immunohistochemical expression of ionized calcium binding adapter molecule 1 in cutaneous histiocytic proliferative, neoplastic and inflammatory disorders of dogs and cats. J Comparative Pathol. 2014;151(4):347-351.
16. Kato Y, Murakami M, Hoshino Y, et al. The class a macrophage scavenger receptor CD204 is a useful immunohistochemical marker of canine histiocytic sarcoma. J Comp Pathol. 2013;148(2–3):188-196.
17. Latifi M, Tuohy JL, Coutermarsh-Ott SL, Klahn SL, Leeper H, Dervisis N. Clinical outcomes in dogs with localized splenic histiocytic sarcoma treated with splenectomy with or without adjuvant chemotherapy. J Vet Intern Med. 2020;34(6):2645-2650.
18. Skorupski KA, Clifford CA, Paoloni MC, et al. CCNU for the treatment of dogs with histiocytic sarcoma. J Vet Intern Med. 2007;21(1):121-126.
19. Cannon C, Borgatti A, Henson M, Husbands B. Evaluation of a combination chemotherapy protocol including lomustine and doxorubicin in canine histiocytic sarcoma. J Small Anim Pract. 2015;56(7):425-429.
20. Takada M, Smyth LA, Hix JML, et al. Development of an orthotopic intrasplenic xenograft mouse model of canine histiocytic sarcoma and its use in evaluating the efficacy of treatment with dasatinib. Comp Med. 2019;69(1):22-28.
21. Kezer KA, Barber LG, Jennings SH. Efficacy of dacarbazine as a rescue agent for histiocytic sarcoma in dogs. Vet Comp Oncol. 2018;16(1):77-80.
22. Mason SL, Finotello R, Blackwood L. Epirubicin in the treatment of canine histiocytic sarcoma: sequential, alternating and rescue chemotherapy. Vet Comp Oncol. 2018;16(1):30-37.
23. Igase M, Shousu K, Fujiki N, et al. Anti-tumour activity of oncolytic reovirus against canine histiocyte sarcoma cells. Vet Comp Oncol. 2019;17(2):184-193.
24. Uchida M, Saeki K, Maeda S, Tamahara S, Yonezawa T, Matsuki N. Apoptosis inhibitor of macrophage (AIM) reduces cell number in canine histiocytic sarcoma cell lines. J Vet Med Sci. 2016;78(9):1515-1520.
25. Fayyad A, Lapp S, Risha E, et al. Matrix metalloproteinases expression in spontaneous canine histiocytic sarcomas and its xenograft model. Vet Immunol Immunopathol. 2018;198:54-64.