
| 一般情况 | |
|---|---|
 | 品种:腊肠犬 |
| 年龄:7岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:椎体浆细胞瘤 | |
01 主诉及病史
3周前因背痛和腹部僵硬使用泼尼松(0.6 mg/kg,口服,q24h)、加巴喷丁(5 mg/kg,口服,q8-12h,后增至10 mg/kg)和甲氧苄啶(1.5 mg/kg,口服,q12h)治疗。1天前出现偏瘫和尿潴留症状。
02 检查
身体状况评分5/9。神经系统检查显示,行走时后肢轻度瘫痪,触诊时腰椎过度紧张。后肢本体感觉反射减弱,左侧更为明显,后肢反射轻度亢进,腰部脊柱感觉亢进,触诊髂腰肌时疼痛。
尿检显示蛋白尿为3+,尿比重为1.024。尿蛋白肌酐比值(UPC)为9.34。尿液蛋白质电泳显示白蛋白是尿液中蛋白质的来源。未发现明显的单克隆峰,表明存在本-琼斯蛋白尿(Bence–Jones proteinuria)。
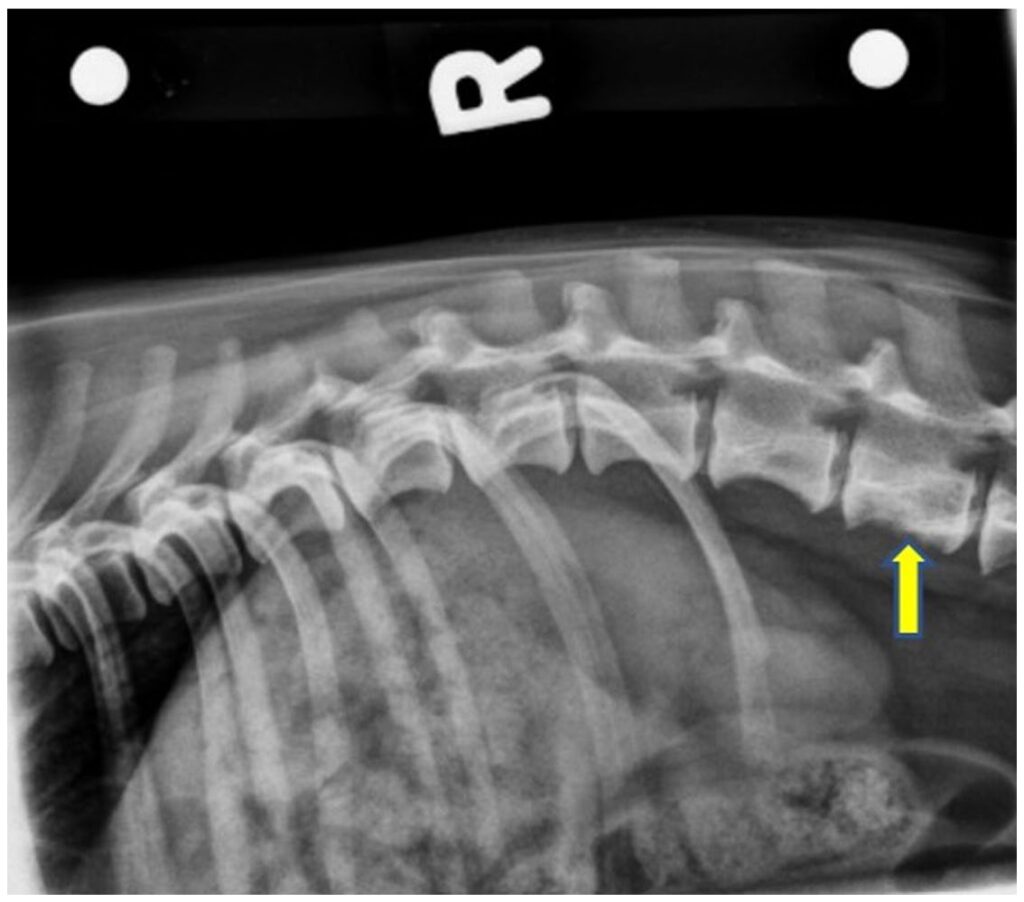
胸腰椎X光显示T11-T12椎间隙变窄。L3椎体的腹侧边缘有光滑的骨膜反应,中央有边缘不清的矿物质不透明增生。L3椎体有轻度蛀蚀性溶解,椎管外侧边缘不清。骨溶解并不影响椎体的椎板或椎弓根(下图)。
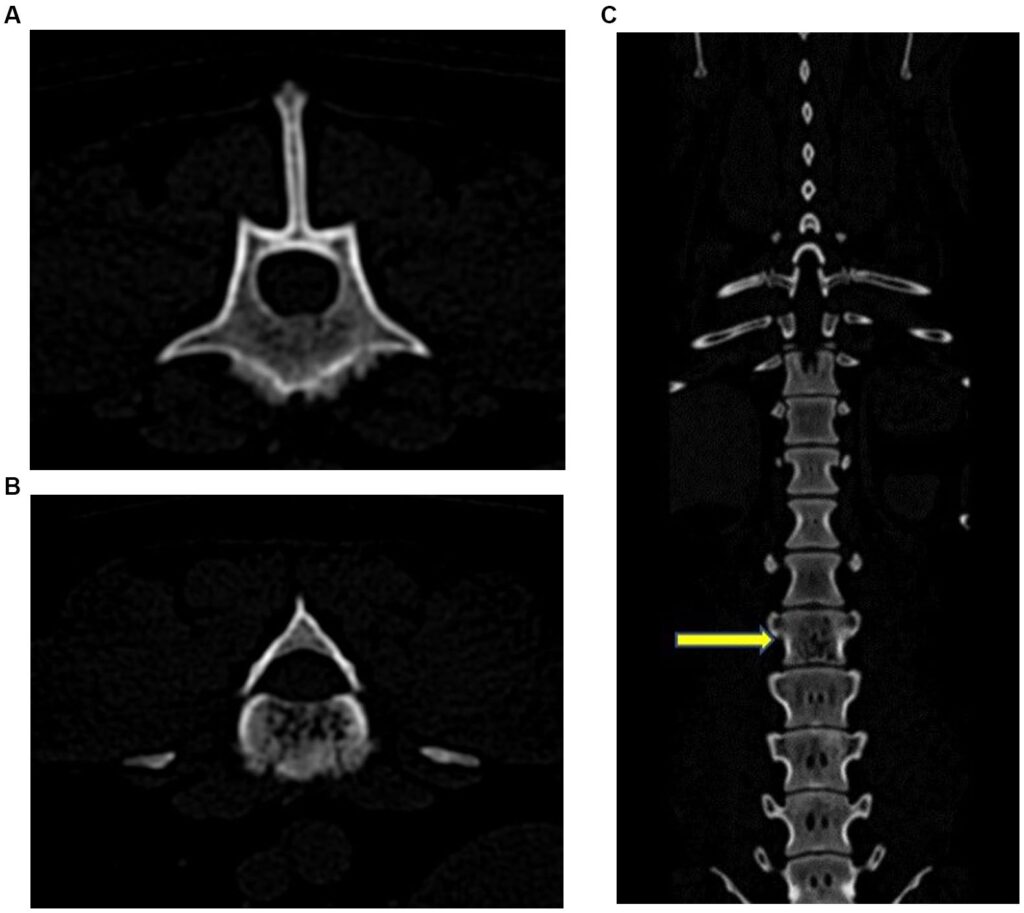
CT显示L3椎体内有多个点状低增生缺损,向尾部聚集成一个蛀蚀溶解区。腹侧有绒毛状骨膜反应,多个病灶区域骨皮质缺损。在对比后扫描中,腹侧椎管内有一个新月形的长条状对比增强区,位于L3背侧,造成脊髓轻度硬膜外压迫(下图)。
第二天全麻后对L3椎体进行了骨活检。结果显示成熟骨和反应性骨混合在一起。在组织病理学检查中,没有观察到细胞肿块,也无法确认是肿瘤。
03 手术
全麻后在左侧髂嵴上方的髂骨翼背侧做切口,钝性剥离至颅背髂棘水平,切除软组织、纤维组织和髂嵴纤维软骨。用摆动锯将髂骨翼切成5 mm条状。用骨刮刀去除髂骨轴上的松质骨。髂嵴皮质松质骨杖和松质骨移植物被保存起来,以备手术后期使用。在对侧重复这一过程。
对腰椎进行标准背侧切口。切口从T11水平开始,延伸至L6水平,长约14 cm。沿中线切开皮下组织,直至背侧棘突水平,并沿背侧棘突右侧移动。将右侧骺肌从下层骨中提升出来,以暴露椎板、关节面和椎弓根。去除该区域关节面上的附着肌肉。通过触诊第13肋骨和L1的横突来确认位置。切开左侧L3椎弓根。在L3椎体外侧和腹侧进行软组织剥离,试图在椎体肿块外保持筋膜层。用手术刀从相邻的椎间盘终板处切开L2和L4椎间盘纤维环。切除椎弓根、横突、纤维环和椎体的剩余部分。移除骨内膜并触诊脊髓。出现了轻微的静脉窦渗出,通过间歇抽吸进行了处理。
从左侧移除尽可能多的椎弓根和椎体后,使用10孔2.7 mm钢板稳定左侧椎体。一颗螺钉固定L1椎体,两颗螺钉固定L2椎体,两颗螺钉固定L4椎体,一颗螺钉固定L5椎体。在右侧重复这一过程。在右侧放置第二块钢板,螺钉位置完全相同。
将髂嵴骨切成一定长度,从左右两侧放入缺损处。总共使用了五块髂嵴骨。然后将松质骨移植物填入皮质松质骨茎突周围的缺损处。用3-0缝线以简单连续的方式缝合脊柱背侧筋膜。
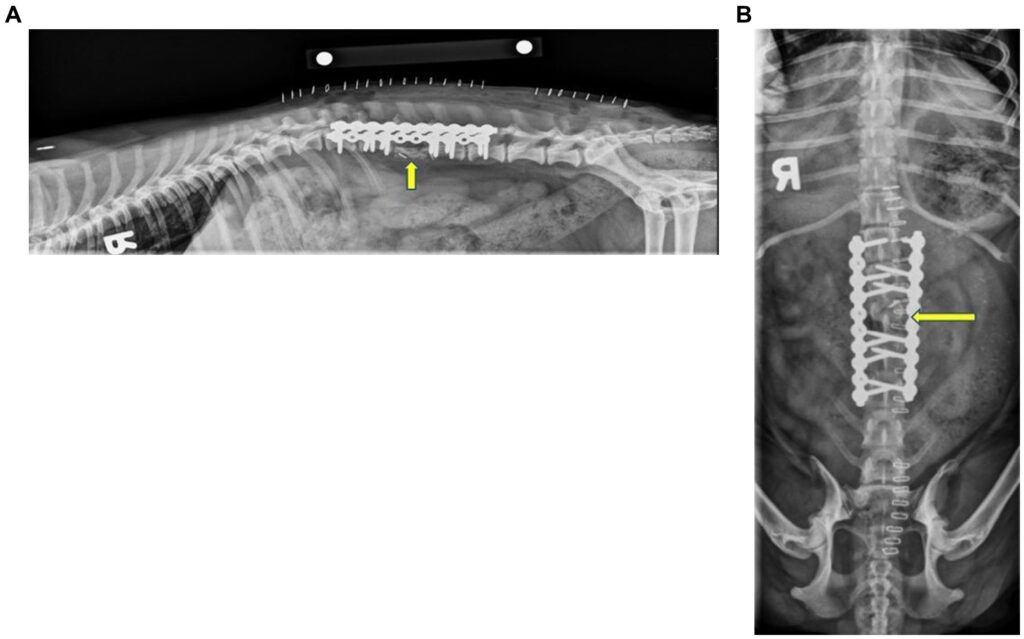
如下图所示,术后侧位和背腹位X光片显示了螺钉的位置和植骨的位置。最近端螺钉未与L1本体接触。其余螺钉均与椎体适当接合。
04 预后
术后第二天下床活动。术后6天出院时可以行走,没有明显的共济失调。出院时的神经系统检查结果在正常范围内,只有轻微的脊柱过度兴奋。曾与主人讨论过化疗问题,但由于患者没有临床症状而被拒绝。
术后1个月的随访显示,行走时后肢只有轻微的本体感觉共济失调。
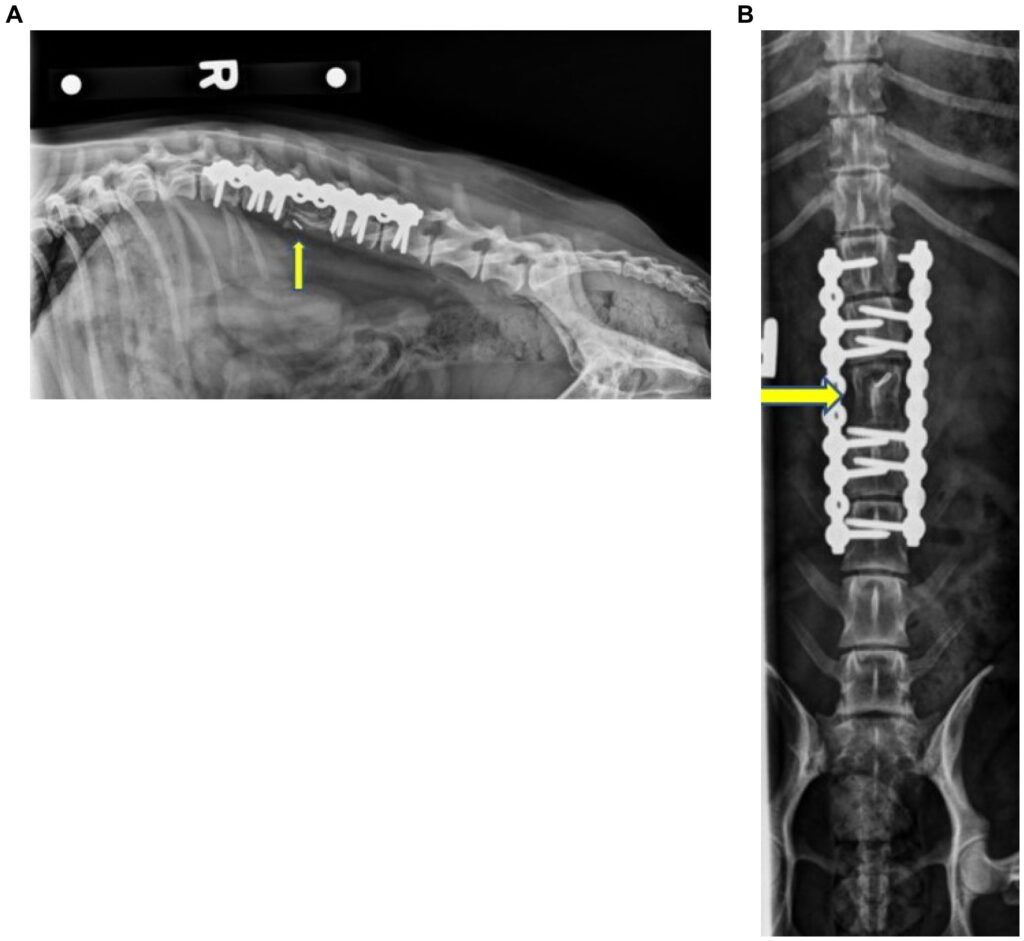
术后2个月因腹部及腰部疼痛和不适就诊,脊柱X光片显示没有植入物失败或松动的迹象,也没有发现骨溶解的迹象。此时已发现皮质冠状自体移植骨的整合(下图)。移植体或种植体均未出现异常。
使用了加巴喷丁(6.6 mg/kg,q8-12h)、美他康(0.2 mg/kg,q24 h)和芬太尼贴片(25 mg)。保守治疗后病情有所好转。
术后4个月因腹痛再次就诊。血清生化检查显示低蛋白血症、边缘性低血糖、ALP升高、氮质血症和轻度贫血。建议进行CT检查,但主人选择了安乐死。
05 讨论
椎体浆细胞瘤占犬所有椎体肿瘤的3-6%,可作为单发浆细胞瘤或播散性多发性骨髓瘤存在,据报道前者的预后较好[1,2]。在人类中,50%的单发浆细胞瘤后来发展为多发性骨髓瘤[3]。
椎体浆细胞瘤可能累及不止一个椎体,有时会因压迫脊髓和继发椎体不稳定而产生多灶性体征。这些体征可能包括脊髓感觉减退和本体感觉障碍[4,5]。椎体浆细胞瘤的诊断可通过脊柱放射线造影、CT脊髓造影和核磁共振成像来辅助[6]。影像学检查可作为椎体肿瘤的筛查工具。
典型的影像学变化包括周围骨质无硬化的离散、界限清楚的溶解性病变[7]。CT被认为是首选的成像模式,因为它在检测溶解性骨病变方面具有很高的特异性,在分期过程中非常有用,并能确定骨受累的程度[8]。血清生化指标中的高钙血症往往与影像诊断中的骨溶解同时出现[6]。
与浆细胞瘤相比,犬多发性骨髓瘤的诊断需要满足以下两个或两个以上的标准:影像学证据显示有溶骨性病变;骨髓活检中浆细胞超过5%;血清或尿液中出现单克隆丙种球蛋白升高;或轻链蛋白尿[9]。
对于一些原发性椎体肿瘤和恶性肿瘤,建议通过椎体后凸切除术进行手术切除[5]。在椎体切除术中,受影响的椎体被切除。切除的骨头可以用聚甲基丙烯酸甲酯制成的间隔物或移植物代替,然后用钢板结构固定,以稳定脊髓[2]。冻干股骨异体移植物、髂骨、肋骨和尾椎骨可以成为骨移植物来源[2,10-12]。
在人类神经外科中,髂嵴自体骨被用于颈椎前路手术,据报道,与其他移植物相比,髂嵴自体骨的融合率最高,并发症发生率最低[13]。无论椎体肿瘤的程度如何,在人类椎体肿瘤切除术后对未稳定的脊柱进行稳定都被认为是姑息性的。这归因于脊椎肿瘤的位置、不可切除性和转移潜力[14]。
本病例报告首次描述了在对狗进行椎体切除术后,使用从髂嵴提取的骨进行移植来填充切除的椎体。之前报道的病例都是使用游离脂肪移植物或纤维素膜来填充椎体切除术后的骨缺损[15-18]。
游离脂肪移植与神经功能缺损和脊髓压迫有关[19]。尽管纤维素网产品可减少硬膜外血肿的形成,但也发现这些产品会造成广泛的瘢痕组织,并与硬脑膜和神经根粘连[20]。髂骨异体移植物也有报道,但在本病例中没有使用,因为与自体移植物相比,髂骨异体移植物缺乏直接结合的特性[9,21]。
虽然自体松质骨仍被认为是最重要的移植材料,但自体移植可能会受到可收集松质骨数量的限制[22]。使用髂骨移植物的优势在于可保持结构强度并具有完全的组织相容性,同时还具有成骨愈合潜能[23]。
在这个病例中,由于没有全身或局部疾病的迹象,而且在两个月的复查中血液检查结果也在正常范围内,因此没有进行化疗。此时种植体已经稳定,皮质冠状骨的整合也已完成。
总之,本报告详细介绍了对一只患有椎体浆细胞瘤的狗进行的治疗,该狗在椎体切除术后用髂嵴自体骨移植填充缺损。髂嵴的取材相对容易,而且骨头的形状适合。术后成像证实手术一个月后,钢板和螺钉在影像学上保持稳定。
本报告的局限性包括病例的单一性和回顾性。需要对该技术进行进一步的前瞻性研究和生物力学评估,以证实该病例所证明的内容。此外,通过CT评估手术后自体移植物和缺损部位的骨界面可以提供更深入的结果。这种方法的潜在缺点包括诊断和手术过程的相关费用、对患者体型的依赖性以及对脊髓造成先天性损伤的风险。
参考文献
1. Liu SK, Dorfman HD, Hurvitz AI, Patnaik AK. Primary and secondary bone tumours in the dog. J Small Anim Pract. (1997) 18:313–26.
2. Sharp NJH, Wheeler SJ. Small Animal Spinal Disorders. London, England: Mosby-Wolfe; (1994). 249 p.
3. Rusbridge C, Wheeler SJ, Lamb CR, Page RL, Carmichael S, Brearley MJ, et al.. Vertebral plasma cell tumors in 8 dogs. J Vet Intern Med. (2008) 13:126–33.
4. McLain RF, Weinstein JN. Solitary plasmacytomas of the spine: a review of 84 cases. J Spinal Disord. (1989) 2:74–4.
5. Lorenz MD, Coates JR, Kent M. Handbook of veterinary neurology. 5th ed. St. Louis (Missouri: Saunders, an imprint of Elsevier Inc.): Elsevier Saunders; c2012. Chapter 6, Pelvic Limb Paresis, Paralysis, or Ataxia; (2012). p. 109–161.
6. Platt SR, Olby NJ. BSAVA manual of canine and feline neurology. 3rd ed. Quedgeley, England: British Small Animal Veterinary Association; (2004). 318 p.
7. Jaggy A, Platt SR. Small animal neurology: An illustrated text. Hannover, Germany: Schlutersche; (2010). 117 p.
8. Hõim S, Fitzgerald E, Mapletoft E, Purzycka K. Computed tomographic findings in dogs with multiple myeloma. Vet Med Sci. (2023) 9:660–9.
9. Hanna F. Multiple myelomas in cats. J Feline Med Surg. (2005) 7:275–87.
10. Lukash FN, Tenenbaum NS, Moskowitz G. Long-term fate of the vascularized iliac crest bone graft for mandibular reconstruction. Am J Surg. (1990) 160:399–401.
11. Daniel RK. Free rib transfer by microvascular anastomoses. Plast Reconstr Surg. (1977) 59:737–8.
12. Yeh LS, Hou SM. Repair of a mandibular defect with a free vascularized coccygeal vertebra transfer in a dog. Vet Surg. (1994) 23:281–5.
13. Epstein NE. Iliac crest autograft versus alternative constructs for anterior cervical spine surgery: pros, cons, and costs. Surg Neurol Int. (2012) 3:143–56.
14. Chauvet AE, Hogge GS, Sandin JA, Lipsitz D. Vertebrectomy, bone allograft fusion, and antitumor vaccination for the treatment of vertebral Fibrosarcoma in a dog. Vet Surg. (2004) 28:480–8.
15. O’Malley NT, Kates SL. Advances on the Masquelet technique using a cage and nail construct. Arch Orthop Trauma Surg. (2011) 132:245–8.
16. Reinisch KB, Zuk G, Raptis DA, Bueter M, Guggenheim M, Stasch T, et al.. Autologous lipotransfer for bone defects secondary to osteomyelitis: a report of a novel method and systematic review of the literature. Int Wound J. (2020) 16:916–24.
17. Elliott RC, Moon C, Zeiler G, Lobetti R. Short-term clinical outcomes of 220 dogs with thoraco-lumbar disc disease treated by mini-hemilaminectomy. J S Afr Vet Assoc. (2020) 91:e1–8.
18. Bismuth C, Ferrand FX, Millet M, Buttin P, Fau D, Cachon T, et al.. Original surgical treatment of thoracolumbar subarachnoid cysts in six chondrodystrophic dogs. Acta Vet Scand. (2014) 56:32.
19. da Costa RC, Pippi NL, Graça DL, Fialho SA, Alves A, Groff AC, et al.. The effects of free fat graft or cellulose membrane implants on laminectomy membrane formation in dogs. Vet J. (2006) 171:491–9.
20. Fingeroth JM, Thomas WB. Advances in intervertebral disc disease in dogs and cats. Iowa: American College of Veterinary Surgeons and Wiley-Blackwell; (2015). 256 p. [Google Scholar]
21. Laurencin C, Khan Y, El-Amin SF. Bone graft substitutes. Expert Rev Med Devices. (2006) 3:49–57.
22. Younger EM, Chapman MW. Morbidity at bone graft donor sites. J Orthop Trauma. (1989) 3:192–5.
23. Roberts TT, Rosenbaum AJ. Bone grafts, bone substitutes and orthobiologics: the bridge between basic science and clinical advancements in fracture healing. Organogenesis. (2012) 8:114–24.
24. Vaz K, Verma K, Protopsaltis T, Schwab F, Lonner B, Errico T. Bone grafting options for lumbar spine surgery: a review examining clinical efficacy and complications. SASJ. (2010) 4:75–86.
25. Petrovsky B, Knuth T, Aponte-Colón C, Hoefle W, Kraus K, Naiman J, et al.. Short-term outcomes of 59 dogs treated for ilial body fractures with locking or non-locking plates. Vet Surg. (2021) 50:1076–86.
26. Blakely JA, Butler JR, Priddy LB, McCabe EM, Avendaño JN, Elder SH, et al.. Ex vivo biomechanical comparison of 2.7 mm string-of-pearl plate versus screw/wire/Polymethylmethacrylate composite fixation and 2.7 mm veterinary acetabular plate for repair of simulated canine acetabular fractures. BMC Vet Res. (2019) 15:287.