
| 一般情况 | |
|---|---|
 | 品种:萨摩耶犬 |
| 年龄:1岁 | |
| 性别:雌 | |
| 是否绝育:否 | |
| 诊断:获得性重症肌无力 | |
01 主诉及病史
因咳嗽两周、骨盆四肢无力(一周内发展为不能行走的四肢瘫痪)、全身性巨食道(下图)和呼吸困难5天就诊。
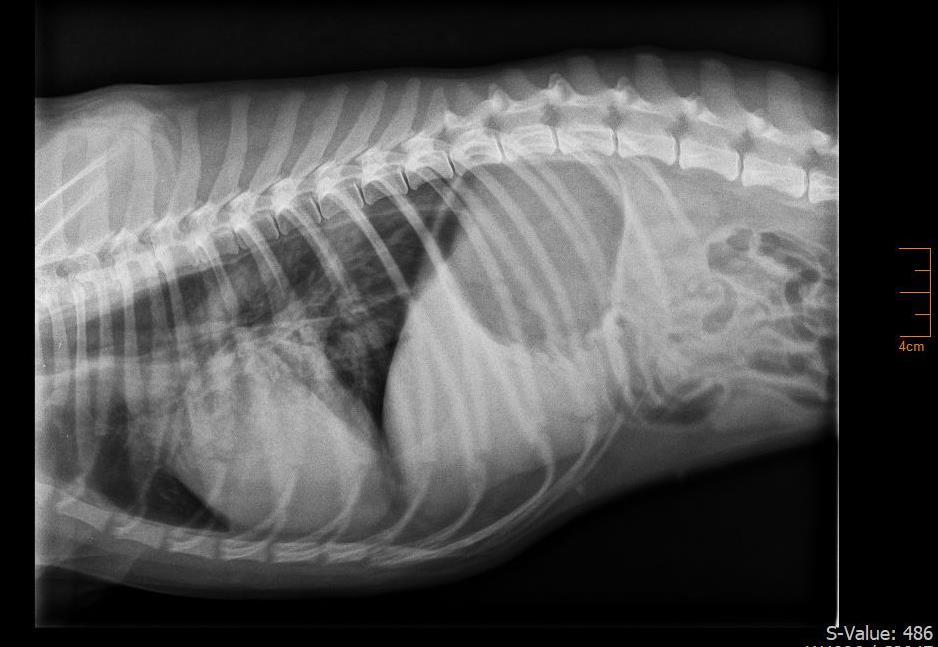
当地兽医怀疑是吸入性肺炎,并使用阿莫西林/克拉维酸和吡啶斯的明溴化物对症治疗。随后几天病情恶化,怀疑患上了获得性重症肌无力(MG),并出现了严重的呼吸困难,危及生命。
02 检查
呈卧姿,全身状况严重恶化。心率70次/分,粘膜充血,毛细血管再充盈时间小于1秒,体温高达39.5°C,呼吸频率20次/分,腹式呼吸,肋间呼吸肌无力。
呈现弛缓性不自主四肢瘫痪,仅有极少的自主运动,所有肢体的脊髓节段反射消失,与全身下运动神经元神经解剖定位一致。
实验室检查显示呼吸性酸中毒伴严重的高碳酸血症(PvCO2:90.1 mmHg),C反应蛋白升高至89.0 mg/L(小于10)。血生化、电解质、T4和皮质醇结果均无异常,排除了代谢原因。
肌电图显示四肢肌肉、背部肌肉和面部肌肉的自发活动没有异常。在运动神经传导检查中,刺激胫神经远端后测得的复合肌肉动作电位振幅较小(2 mV,参考:10.1-32.1)。运动神经传导速度在正常范围内(63米/秒)。在重复神经刺激(频率为3 Hz)时,与I和V波幅的复合肌肉动作电位相比,该犬显示出64.9%的递减反应。
血清抗乙酰胆碱受体(AChR)抗体明显升高(2.1 nmol/L,参考≤ 1.0),证实了获得性MG的诊断。影像检查未发现肿瘤迹象。
03 治疗
由于严重的呼吸困难和高碳酸血症,最初的治疗包括气管插管和机械通气。使用丙泊酚诱导麻醉,并以丙泊酚持续输注(0.1-0.3 mg/kg/min)维持麻醉。采用压力支持持续中间强制通气模式(PSIMV)。初始设置为:吸气压力 (Pinsp) 5 mmHg,呼气末正压 (PEEP) 5 mmHg,吸入氧饱和度 (FiO2) 50%。在通气过程中调整设置以维持正常血氧(SpO2:95-98%)和正常血碳酸(etCO2:35-45 mmHg)。在通气期间,FiO2可逐步降至30%。
为了快速降低循环中的AChR抗体,使用右颈静脉的中心静脉导管进行免疫吸附。首先使用管道系统进行连续离心血浆分离。分离后,血浆被转移到免疫吸附机。免疫吸附使用的是商用管道系统和葡萄球菌蛋白A柱(下图)。
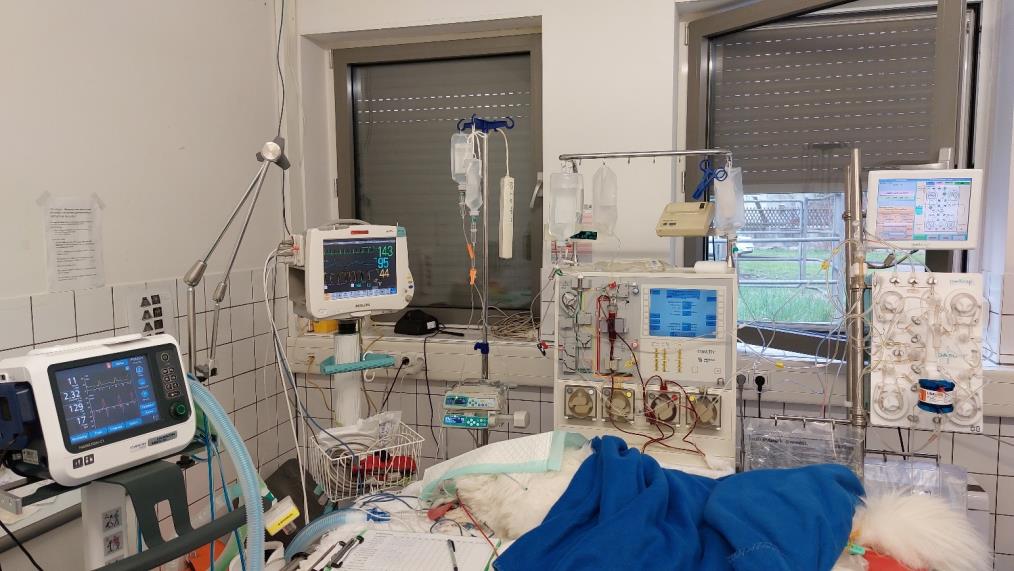
根据为犬血液透析制定的柠檬酸盐抗凝方案,使用柠檬酸盐抗凝,血液/柠檬酸盐比例为1/24。通过外周静脉导管注入10%葡萄糖酸钙以避免出现低钙血症。每隔30分钟测量一次离子钙,使体外循环中的离子钙浓度小于0.3 mmol/L,体内离子钙浓度大于0.8 mmol/L。体外循环血容量为405 mL。管道中注入等渗盐水冲洗系统后,预注200 mL血型匹配的全血,以降低因体外血容量过大而导致低血容量和血液稀释的风险。
血流量设置为50 mL/分,血浆流量为30 mL/分,在两个免疫吸附循环中处理1.2 L血浆,每个循环600 mL。过程中进行了心电图、气管插管、脉搏氧饱和度和无创血压监测。除了35.5-36.0°C的中度低体温外,生命参数一直保持稳定。最后分两次处理了2 L血液和1.2 L血浆,每次600 mL。12小时后停止机械通气。但该犬仍无法行走,需要吸氧。
进一步的药物治疗包括马洛比坦(1 mg/kg IV,q24h)、埃索美拉唑(1 mg/kg IV,q12h)、阿莫西林/克拉维酸(20 mg/kg IV,q8h)和新斯的明(0.04 mg/kg IM,q6h)。
第二天在全麻下放置了经皮内镜胃造瘘管用于肠内营养和药物治疗。
第三天,进行了第二次免疫吸附。使用了与第一次相同的设置,并处理了1.2 L血浆。第二次免疫吸附后,患者恢复了肌力,能够站立和行走。治疗改为溴吡斯的明(0.6 mg/kg PO,q8h)。第二天剂量增加到0.8 mg/kg PO,q8h。
04 预后
免疫吸附后及随后几天对血清AChR抗体进行了分析。初次治疗后抗体下降了75%(下图)。6天后出院,此时除了因吸入性肺炎引起的偶尔自发性咳嗽外,临床检查没有其他异常。该犬仍表现出全身肌肉无力的症状,即屈肌抽出力量减弱。
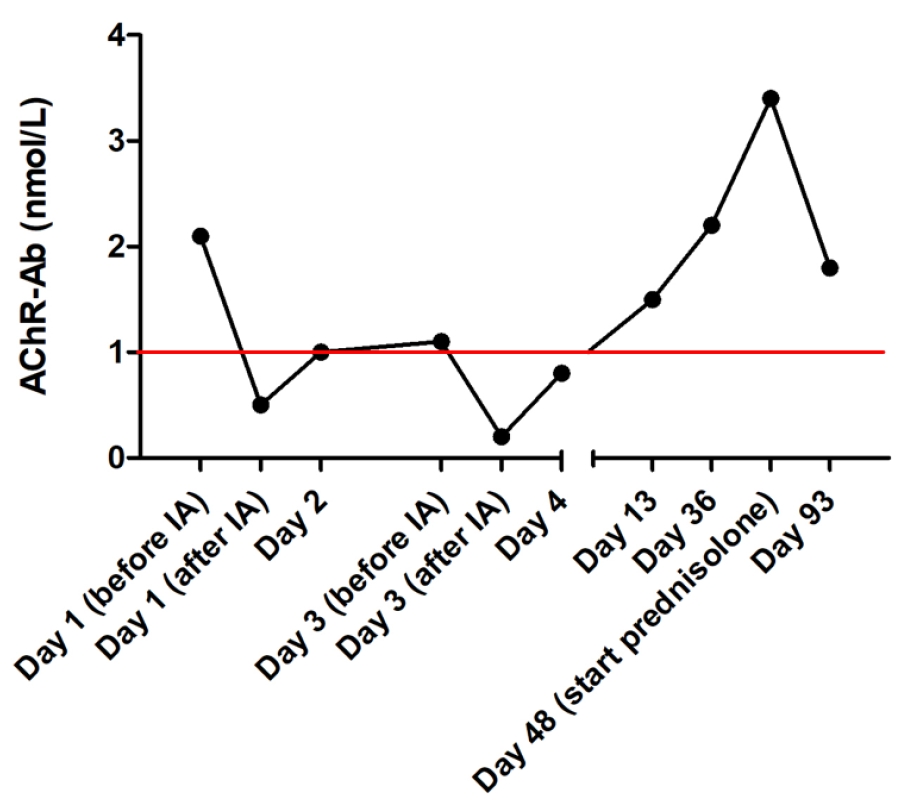
复查时发现该犬的肌力和行走能力得以维持,但巨食道的情况并未改善,而且在胃食管插管期间,该犬又发生了几次吸入性肺炎。这可能是由于主人对喂养方案的依从性较差。由于AChR抗体再次增加,建议对该犬进行另一周期的免疫吸附治疗,但遭到了主人拒绝。在首次发病3个半月后再次发生吸入性肺炎,在主人的要求下被安乐死。
05 讨论
获得性重症肌无力(myasthenia gravis,MG)是一种影响神经肌肉传递的自身免疫性疾病,也是犬最常见的神经肌肉疾病之一[1,2,3]。在这种病中,循环免疫球蛋白G自身抗体导致神经肌肉接头突触后膜上的烟碱乙酰胆碱受体(AChR)数量不断减少,导致乙酰胆碱受体阻滞或补体介导的衰变,从而损害神经肌肉传导[4,5]。
其后果是骨骼肌无力,可能是局灶性的,仅影响面部、眼部、食道、咽部或喉部肌肉。也可能是全身性的,出现肌肉疲劳和运动无力。急性暴发性MG会导致迅速进展的全身无力,并可发展为呼吸衰竭[6]。
在犬中,针对肌肉特异性酪氨酸激酶、titin和ryanodine受体的自身抗体很罕见[7,8]。巨食管伴有反流和吸入性肺炎是犬获得性MG常见的并发症。犬获得性MG的治疗目标是控制临床症状和维持生存,直到临床症状自发缓解。
吸入性肺炎和呼吸衰竭是导致获得性MG犬死亡的常见原因,在最近的一项研究中,胃食管反流与临床缓解呈负相关[3,6,9-11]。MG的常见治疗方法是应用乙酰胆碱酯酶抑制剂(可延长乙酰胆碱在突触间隙中的半衰期)和免疫抑制疗法,后者主要用于对标准治疗无效且未患吸入性肺炎的犬[3,10,12,13]。
在人类医学中,针对自身抗体的其他治疗方法是大剂量静脉注射免疫球蛋白(hIVIG)或治疗性血浆置换(TPE)[14]。在犬获得性MG中,也有使用hIVIG的描述[5,15],但仍有争议[5]。
TPE是一种可使严重抗体介导的免疫性疾病患者病情迅速好转的治疗方式。患者的血浆中除了含有免疫复合物和毒素等其他物质外,还含有自身抗体,用替代体液(通常是供体血浆)替代患者的血浆[16-21]。
兽医文献[18,22,23]报道了四只患有获得性MG的犬接受了TPE治疗。其中两只犬在TPE治疗后临床症状有所改善,另外两只则死亡[18,23]。后者的MG继发于肿瘤,存在多发性腹部和头颅纵隔肿块、血管肉瘤和胸腺瘤[22,23]。
文献中描述的另一种犬获得性MG的治疗方法是注射MG疫苗。这些疫苗含有多肽,可模仿产生抗AChR抗体的某些自身反应性T细胞和B细胞上的抗原受体[24]。使用这些疫苗可以提高MG犬的缓解率[24]。
免疫吸附(IA)是一种体外血液净化技术,用于清除血液中的自身抗体(主要是IgG)和循环免疫复合物[25]。IA机器包含一个离心机,用于分离红细胞和血浆。分离后,血浆通过吸附器转移,吸附器含有特异性配体,可选择性结合抗体和免疫复合物[25]。
在人类医学中,IA是获得性MG患者的一种替代治疗方法[26]。IA的适应症是严重的肌无力危象或胸腺瘤患者手术前[26]。在兽医领域,IA成功用于治疗一只犬的免疫介导型溶血性贫血[27]。本病例报告首次成功将IA应用于获得性MG的犬治疗。
对于患有急性获得性MG的犬来说,IA是一种潜在的紧急治疗方法,也是一种支持性治疗选择。AChR抗体的浓度可以显著降低,因此通气时间可以缩短。但仍需要使用乙酰胆碱酯酶抑制剂和免疫抑制剂进行额外的药物治疗。还需要进一步研究以评估IA对获得性MG患犬的影响。
参考文献
1. Shelton G.D. Acquired myasthenia gravis: What we have learned from experimental and spontaneous animal models. Vet. Immunol. Immunopathol. 1999;69:239–249.
2. Shelton G.D. Myasthenia gravis and congenital myasthenic syndromes in dogs and cats: A history and mini-review. Neuromuscul. Disord. 2016;26:331–334.
3. Forgash J.T., Chang Y., Mittelman N.S., Petesch S., Benedicenti L., Galban E., Hammond J.J., Glass E.N., Barker J.R., Shelton G.D., et al. Clinical features and outcome of acquired myasthenia gravis in 94 dogs. J. Vet. Intern. Med. 2021;35:2315–2326.
4. Huijbers M.G., Marx A., Plomp J.J., Le Panse R., Phillips W.D. Advances in the understanding of disease mechanisms of autoimmune neuromuscular junction disorders. Lancet Neurol. 2022;21:163–175.
5. Spurlock N., Prittie J. Use of Human Intravenous Immunoglobulin in Veterinary Clinical Practice. Vet. Clin. Small Anim. Pract. 2020;50:1371–1383.
6. Mignan T., Targett M., Lowrie M. Classification of myasthenia gravis and congenital myasthenic syndromes in dogs and cats. J. Vet. Intern. Med. 2020;34:1707–1717.
7. Shelton G.D. Routine and specialized laboratory testing for the diagnosis of neuromuscular diseases in dogs and cats. Vet. Clin. Pathol. 2010;39:278–295.
8. Shelton G.D., Skeie G.O., Kass P.H., Aarli J.A. Titin and ryanodine receptor autoantibodies in dogs with thymoma and late-onset myasthenia gravis. Vet. Immunol. Immunopathol. 2001;78:97–105.
9. Shelton G.D. Myasthenia gravis and disorders of neuromuscular transmission. Vet. Clin. Small Anim. Pract. 2002;32:189–206.
10. Khorzad R., Whelan M., Sisson A., Shelton G.D. Myasthenia gravis in dogs with an emphasis on treatment and critical care management. J. Vet. Emerg. Crit. Care. 2011;21:193–208.
11. Dickinson P.J., LeCouteur R.A. Feline neuromuscular disorders. Vet. Clin. Small Anim. Pract. 2004;34:1307–1359.
12. Dewey C.W., Cerda-Gonzalez S., Fletcher D.J., Harb-Hauser M.F., Levine J.M., Badgley B.L., Olby N.J., Shelton G.D. Mycophenolate mofetil treatment in dogs with serologically diagnosed acquired myasthenia gravis: 27 cases (1999–2008) J. Am. Vet. Med. Assoc. 2010;236:664–668.
13. Whitley N.T., Day M.J. Immunomodulatory drugs and their application to the management of canine immune-mediated disease. J. Small Anim. Pract. 2011;52:70–85.
14. Kaminski H.J., Denk J. Corticosteroid Treatment-Resistance in Myasthenia Gravis. Front. Neurol. 2022;13:886625.
15. Rutter C.R., Rozanski E.A., Sharp C.R., Powell L.L., Kent M. Outcome and medical management in dogs with lower motor neuron disease undergoing mechanical ventilation: 14 cases (2003–2009) J. Vet. Emerg. Crit. Care. 2011;21:531–541.
16. Melzer N., Ruck T., Fuhr P., Gold R., Hohlfeld R., Marx A., Melms A., Tackenberg B., Schalke B., Schneider-Gold C., et al. Clinical features, pathogenesis, and treatment of myasthenia gravis: A supplement to the Guidelines of the German Neurological Society. J. Neurol. 2016;263:1473–1494.
17. Bartges J.W. Therapeutic plasmapheresis. Semin. Vet. Med. Surg. (Small Anim.) 1997;12:170–177.
18. Allen A.E., Bandt C., Bolfer L. Concepts and clinical applications for therapeutic plasma exchange and plasmapheresis in small animal critical care medicine; Proceedings of the Emergência e Intensivismo, Encontro Ventil De Residentes Em Medicina Veterinaria, Centro de Convenções Expo Dom Pedro; Campinas, SP, Brazil. 3–5 August 2015.
19. Sinanović O., Zukić S., Burina A., Pirić N., Hodžić R., Atić M., Alečković-Halilović M., Mešić E. Plasmapheresis in neurological disorders: Six years experience from University Clinical center Tuzla. F1000Research. 2017;6:1234.
20. Dörfelt S., Fischer A., Meyer-Lindenberg A., Dörfelt R. Feline acquired thymoma-associated myasthenia gravis managed with surgery and therapeutic plasma exchange. Vet. Rec. Case Rep. 2021;9:e211.
21. Padmanabhan A., Connelly-Smith L., Aqui N., Balogun R.A., Klingel R., Meyer E., Pham H.P., Schneiderman J., Witt V., Wu Y., et al. Guidelines on the Use of Therapeutic Apheresis in Clinical Practice—Evidence-Based Approach from the Writing Committee of the American Society for Apheresis: The Eighth Special Issue. J. Clin. Apher. 2019;34:171–354.
22. Bartges J.W., Klausner J.S., Bostwick E.F., E Hakala J., A Lennon V. Clinical remission following plasmapheresis and corticosteroid treatment in a dog with acquired myasthenia gravis. J. Am. Vet. Med. Assoc. 1990;196:1276–1278.
23. Vitalo A., Buckley G., Londoño L. Concepts and clinical applications for therapeutic plasma exchange and plasmapheresis in small animal critical care medicine. J. Vet. Emerg. Crit. Care. 2021;31:106–111.
24. Galin F.S., Chrisman C.L., Cook J.R., Xu L., Jackson P.L., Noerager B.D., Weathington N.M., Blalock J.E. Possible therapeutic vaccines for canine myasthenia gravis: Implications for the human disease and associated fatigue. Brain Behav. Immun. 2007;21:323–331.
25. Braun N., Bosch T. Immunoadsorption, current status and future developments. Expert Opin. Investig. Drugs. 2000;9:2017–2038.
26. Oji S., Nomura K. Immunoadsorption in neurological disorders. Transfus. Apher. Sci. 2017;56:671–676.
27. Richter P., Fischer H., Dörfelt R. Immunoadsorption in a dog with severe immune mediated hemolytic anemia. J. Clin. Apher. 2021;36:668–672.