
| 一般情况 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:4岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:急性脾扭转 | |
01 主诉及病史
突然嗜睡,36-48小时内阵发性呕吐和腹胀。
曾患有非再生性贫血(6个月龄时确诊),在其他地方检查后推测为”骨髓增生异常”(未提供更多细节)。下表列出了发病前1年多进行的诊断摘要。
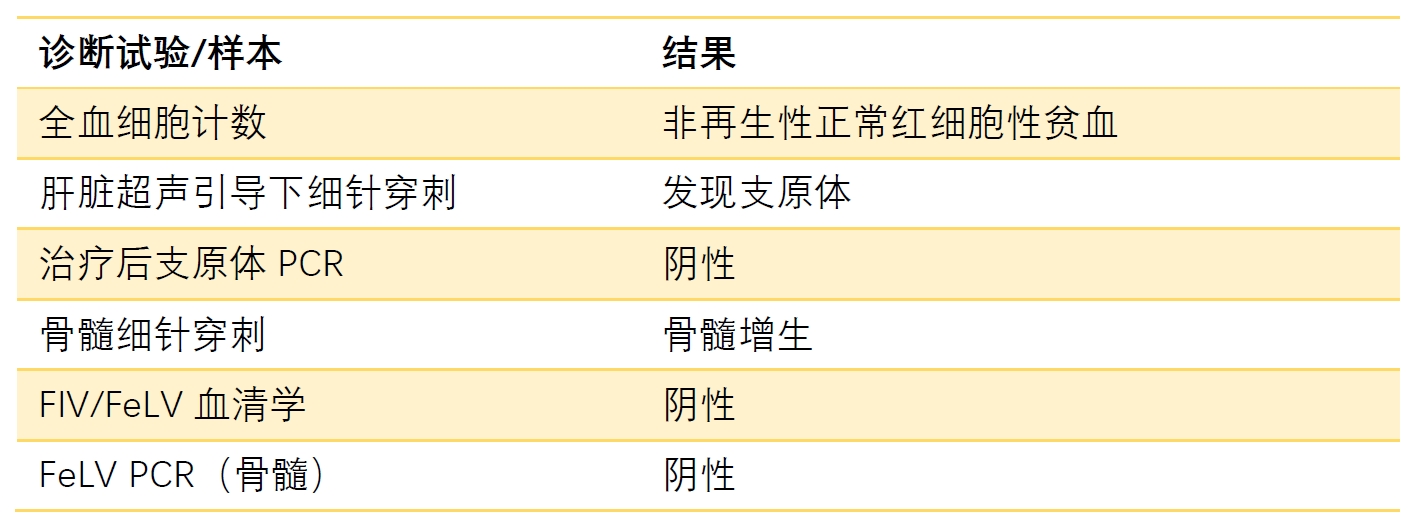
在肝脏中发现支原体感染后,接受了长期免疫抑制治疗(泼尼松龙)和一个疗程的恩诺沙星治疗。两年来充盈细胞容积(PCV)一直保持在10-12%,存在贫血。
02 检查
安静机警,股动脉搏动有力,粘膜呈淡粉色。直肠温度38.4℃,心率184 bpm。心脏旁有II/VI级杂音。肺部听诊清晰。
腹部触诊发现腹部明显胀大,有波动感。体壁两侧触及坚实的腹部结构,边缘不连续,有轻微不适感。
进行全血细胞计数、PCV、生化等检测,并通过膀胱穿刺术采集尿液进行分析和培养。还进行了其他传染病检测,结果如下表所示。

腹部超声检查显示腹腔内有大量无回声腹腔积液,并伴有类似纤维蛋白的高回声束。脾脏明显肿大,肝脏肿大伴多灶性异型肝结节和肠系膜淋巴结肿大。
脾脏回声混杂,呈不均匀的”蜂窝状”。脾脏血流异常,未发现脾脏或门静脉血栓。腹腔穿刺出250 mL深黄色混浊液体。检查结果符合高蛋白渗出和化脓性炎症。
胸片显示心脏轻度肿大,没有充血性心力衰竭迹象。超声心动图显示心肌肥厚,双心房扩大。
03 治疗
准备第二天进行腹部探查手术。前一晚的治疗包括静脉补液(复方电解质注射液40 ml/kg/day)、枸橼酸马洛比坦(1 mg/kg)、丁丙诺啡(0.01 mg/kg q24h)、美沙酮(0.2 mg/kg q4-6h)。由于存在中性粒细胞减少,使用氨苄西林舒巴坦(30 mg/kg q8h)进行抗菌治疗。
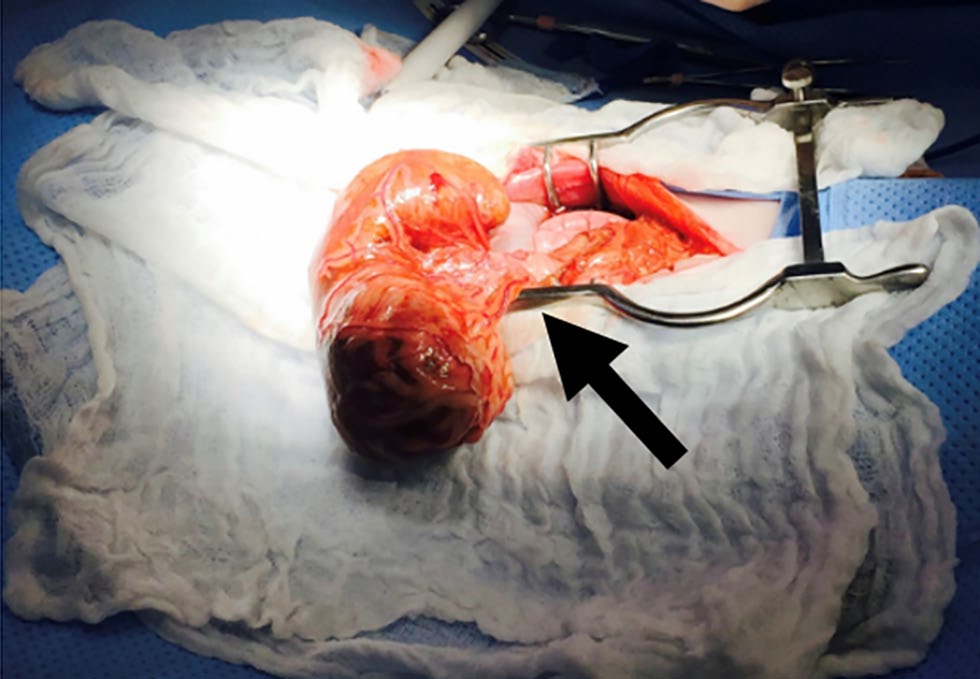
进行中线开腹手术,发现脾脏明显肿大,脾蒂周围隆起(下图)。发现多个凸起的肝脏病变,并进行了穿刺活检。穿刺了肿大的肠系膜淋巴结。使用2-0缝线结扎扭转的脾蒂,进行脾切除术,注意在切除过程中不要解开脾脏。
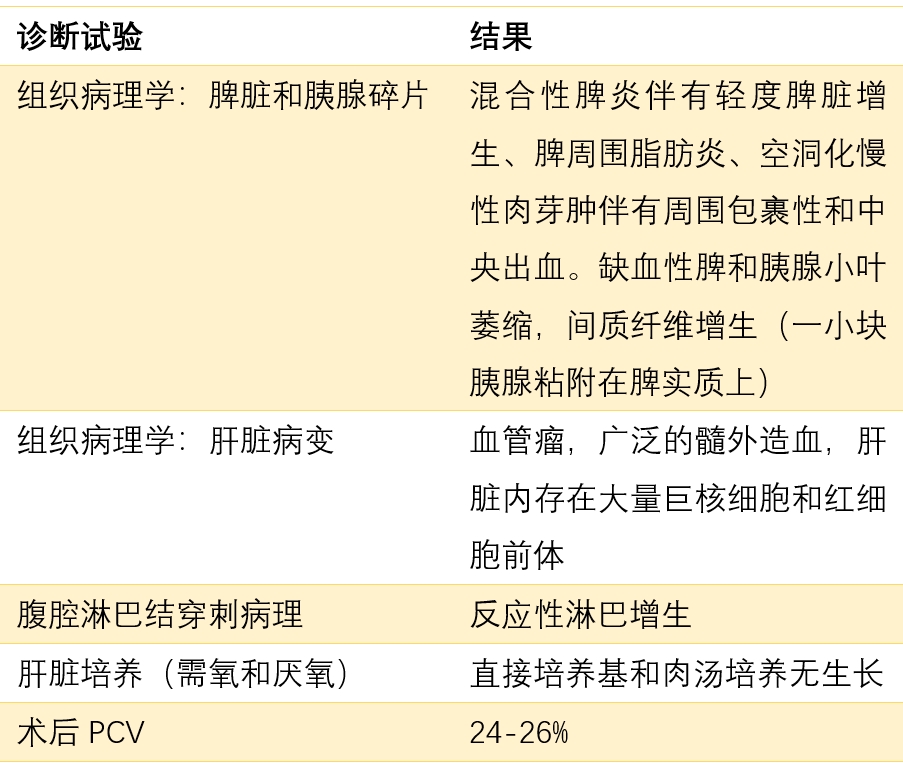
组织病理学和细胞学结果见下表。细胞学检查发现了混合淋巴细胞群,其中有中小型淋巴细胞和淋巴母细胞,混合淋巴细胞群中浆细胞较少,中性粒细胞和组织细胞增多。这些变化与伴有轻度淋巴细胞增生的混合细胞脾炎一致。肝脏病变表现为广泛的髓外造血和血管瘤。淋巴结显示有反应性淋巴增生。
04 预后
术后恢复顺利,靠静脉注射美沙酮镇痛。术后体重为4.08 kg,比术前减少了220 g。出院前PCV有所改善。
脾脏切除术后8个月,存活良好,PCV保持稳定(24%)。
两年后随访情况良好。
05 讨论
脾扭转是一种不常见但很重要的外科疾病,通常影响大型公犬[1,2]。其确切的发病机制尚不完全清楚,但最常描述的是孤立的脾脏蒂部扭转,称为原发性脾扭转(primary splenic torsion,PST)。
一项对102只犬进行评估的研究发现,这些犬均没有潜在的脾脏疾病[2]。急性脾扭转可引起腹部症状(剧痛)和低血容量性休克(虚弱、心血管衰竭)。建议对所有PST病例进行脾切除术。
人类脾扭转与”游走脾”有关,游走脾是一种先天性疾病,由于脾脏韧带薄弱或缺失,导致脾脏过度运动[3,4]。第一例非人类哺乳动物游走脾(但无扭转)病例是在一只患有胃肠道淋巴瘤的猫身上发现的[5]。
在猫中,脾脏疾病并不常见。有报告显示,猫脾脏疾病中35%为肿瘤,2%为罕见的脾炎[6]。一项评估19只猫脾切除术后效果的研究发现,肥大细胞瘤是最常见的原因,其次是血管肉瘤和淋巴瘤[7]。该研究还报告了一例髓外造血、骨髓脂肪瘤和淋巴增生病例。
这是兽医文献中首次报道的猫PST病例。腹部表现(疼痛、腹胀)与犬的急性脾扭转相似。由于组织坏死和脾脏循环改变,虚弱和心血管衰竭很常见[1,2]。犬和人的超声结果包括游离腹腔积液、脾脏肿大、实质不均质、粗大的”花边”状低回声以及脾脏血管血流缺乏[2,3,8-11]。
犬的腹部脂肪增多和胰腺炎也有高回声[9,10]。本病例的超声改变与犬的发现类似,但由于影像资料没有存档,因此对该病例的描述有限。
其他物种PST的病因包括炎症性疾病、先天性脾韧带松弛(游走脾)或后天性胃扩张(大型犬)、肿瘤或腹膜炎、附属脾组织和外伤[3,4,12,13]。
由于PST尚未在猫的临床病例中出现过,因此无法对该病例的具体病因做出结论。长期使用皮质类固醇可能是导致胃脾松弛的一个危险因素[14,15],但使用皮质类固醇在猫中很常见,而发生脾扭转的情况极为罕见。
有报告称,一只患有急性PST的犬在脾脏切除术后出现贫血和血小板减少[12]。贫血的原因被推测与脾脏切除有关。贫血似乎是患有慢性脾扭转的犬的共同特征[9,13]。脾脏病变可能会导致某些猫慢性贫血,但其机制尚未完全明了。
贫血诱发脾功能亢进的理论是人类医学的一个特征[23],可能为PST动物的贫血提供理论依据。在报告阿比西尼亚猫和索马里猫间歇性严重溶血性贫血的系列病例中,有10/13例记录到脾脏肿大[24],进一步支持了这一理论。
脾脏网状内皮通路的破坏增加与血管外免疫介导的溶血性贫血(IMHA)有关。但是本病例中没有IMHA的典型症状(黄疸),之前的贫血检查也不支持这一诊断。
总之,本病例PST的具体病因尚未确定。脾炎和慢性贫血可能会导致脾扭转,或者慢性的部分性脾扭转可能导致了贫血和脾脏炎症过程。关于无脾肿瘤猫的脾切除术适应症,目前还缺乏证据[8],但PST应被列入脾切除的适应症。无论病因如何,PST都在脾脏切除术后得到了缓解,猫的贫血也得到了改善,并且两年来一直保持稳定。
参考文献
1. Neath PJ, Brockman DJ, Saunders HM. Retrospective analysis of 19 cases of isolated torsion of the splenic pedicle in dogs. J Small Anim Pract 1997; 38: 387–392.
2. DeGroot W, Giuffrida MA, Rubin J, et al. Primary splenic torsion in dogs: 102 cases (1992–2014). J Am Vet Med Assoc 2016; 248: 661–668.
3. Imawari K, Uojima H, Hayama K, et al. Splenectomy for torsion of a wandering spleen in a patient with myeloproliferative disease. Intern Med 2022; 61: 2143–2148.
4. Ho CL. Wandering spleen with chronic torsion in a patient with thalassaemia. Singapore Med J 2014; 55: e198–e200.
5. Yuki M, Narita M. Subclinical wandering spleen in a cat with gastrointestinal lymphoma. Clin Case Rep 2021; 9.
6. Spangler WL, Culbertson MR. Prevalence and type of splenic disease in cats: 455 cases (1985–1991). J Am Vet Med Assoc 1992; 201: 773–776.
7. Gordon SSN, McClaran JK, Bergman PJ, et al. Outcome following splenectomy in cats. J Feline Med Surg 2010; 12: 256–261.
8. Weber NA. Chronic primary splenic torsion with peritoneal adhesions in a dog: case report and literature review. J Am Anim Hosp Assoc 2000; 36: 390–394.
9. Saunders HM, Neath PJ, Brockman DJ. B-mode and Doppler ultrasound imaging of the spleen with canine splenic torsion: a retrospective evaluation. Vet Radiol Ultrasound 1998; 39: 349–353.
10. Reinhart JM, Sherwood JM, KuKanich KS, et al. Chronic splenic torsion in two dogs. J Am Anim Hosp Assoc 2015; 51: 185–190.
11. Mai W. The hilar perivenous hyperechoic triangle as a sign of acute splenic torsion in dogs. Vet Radiol Ultrasound 2006; 47: 487–491.
12. Schnier LM. A case of splenic torsion with progressive anemia and thrombocytopenia. Can Vet J 2010; 51: 527–529.
13. Mergl JC, Hanselman B, Kirsch M. Chronic splenic torsion in a dog with an accessory spleen. Can Vet J 2022; 63: 147–151.
14. Engdahl K, Hanson J, Bergstrom A, et al. The epidemiology of stifle joint disease in an insured Swedish dog population. Vet Rec 2021; 189.
15. Shimada M, Wada K, Tanaka S, et al. Effects of long-term and high-dose administration of glucocorticoids on the cranial cruciate ligament in healthy beagle dogs. PLoS One 2022; 17.
16. Johns JL, Christopher MM. Extramedullary hematopoiesis: a new look at the underlying stem cell niche, theories of development, and occurrence in animals. Vet Pathol 2012; 49: 508–523.
17. Zingman BS, Viner BL. Splenic complications in malaria: case report and review. Clin Infect Dis 1993; 16: 223–232.
18. Cenariu D, Iluta S, Zimta A, et al. Extramedullary hematopoiesis of the liver and spleen. J Clin Med 2021; 10.
19. Schöniger S, Tivers MS, Baines SJ, et al. Arteriovenous haemangioma in two dogs and a cat. J Comp Pathol 2008; 139: 130–136.
20. Weiser MG, Kociba GJ. Sequential changes in erythrocyte volume distribution and microcytosis associated with iron deficiency in kittens. Vet Pathol 1983; 20: 1–12.
21. Worhunsky P, Toulza O, Rishniw R, et al. The relationship of serum cobalamin to methylmalonic acid concentrations and clinical variables in cats. J Vet Intern Med 2013; 27: 1056–1063.
22. Wilson HE, Jasani S, Wagner TB, et al. Signs of left heart volume overload in severely anemic cats. J Feline Med Surg 2010; 12: 904–909.
23. Peck-Radosavljevic M. Hypersplenism. Eur J Gastroenterol Hepatol 2001; 13: 317–323.
24. Kohn B, Goldschmidt MH, Hohenhaus AE, et al. Anemia, splenomegaly, and increased osmotic fragility of erythrocytes in Abyssinian and Somali cats. J Am Vet Med Assoc 2000; 217: 1483–1491.