
| 一般情况 | |
|---|---|
 | 品种:混种猫 |
| 年龄:7岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:胰腺神经内分泌癌 | |
01 主诉及病史
两周前开始腹胀,两天前开始厌食。
02 检查
粘膜苍白、脱水(8%)、体温过低(36.2℃)、恶病质和腹水。
全血细胞计数显示轻度正色素性贫血:
红细胞5.89×106/mm3(5.0-10.0)
血红蛋白7.6 g/dl(8.0-15.0)
血细胞比容24.9%(24.0-45.0)
血小板270000(230000-680000)
白细胞17700(5500-19500)
生化分析显示尿素增加:
尿素100 mg/dL(42-64)
肌酐1.4 mg/dL(0.8-1.8)
丙氨酸氨基转移酶16 U/l(6-83)
谷氨酰谷氨酸转移酶10 U/l(0-10)
白蛋白2.9 g/dl(2.1-3.3)
血糖122 mg/dl(73-134)
腹水符合渗出液,呈血性。
密度:1028
白蛋白:1.6 g/L
蛋白质:4.1 g/dL
白蛋白/球蛋白比值:0.73
葡萄糖:112 mg/dL
无细菌
红细胞:540000/mm3
有核细胞:5600/mm3
中性粒细胞:78%
淋巴细胞:19%
单核细胞:3%
腹部超声显示上腹部和肠系膜区域有一个膨胀性肿块,大小无法测量,呈多结节状,回声混杂,轮廓不规则,位于胰腺和右肝叶周围。肝周淋巴结肿大(1.53×2.22 cm),并有大量游离液体。
剖腹探查术在肝脏、胰腺、肠系膜、肠道、胃和腹膜壁上发现多个白色结节。由于无法进行手术切除,且预后不良,医生建议实施安乐死。
03 尸检
尸检显示轻度腹水和严重的纤维素性腹膜炎,腹腔内多发坚实结节,遍布整个浆膜(下图)。
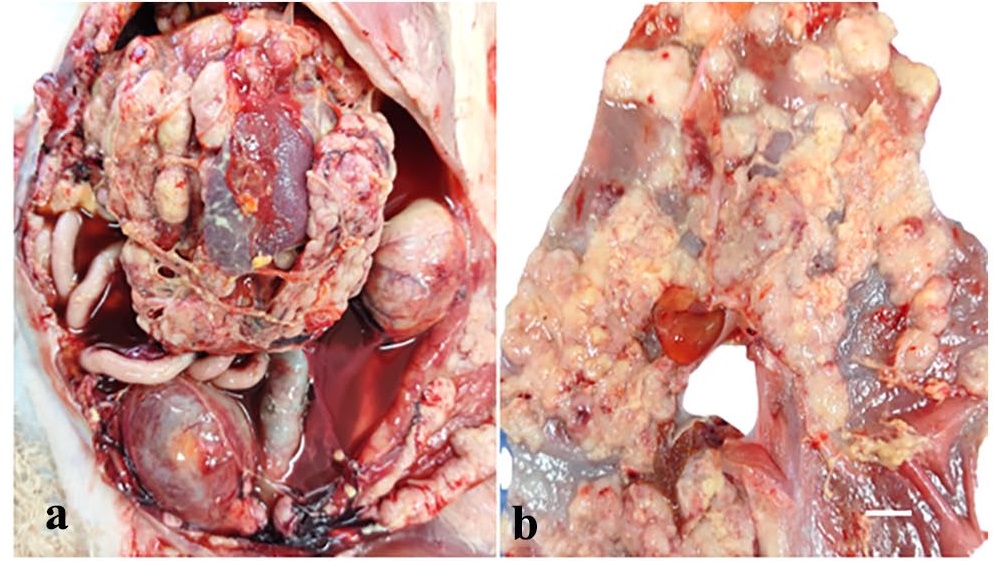
胰腺严重萎缩,在胰头和胰尾有多个大小为0.2-0.5 cm、界限清楚的白色新形成斑块(下图)。
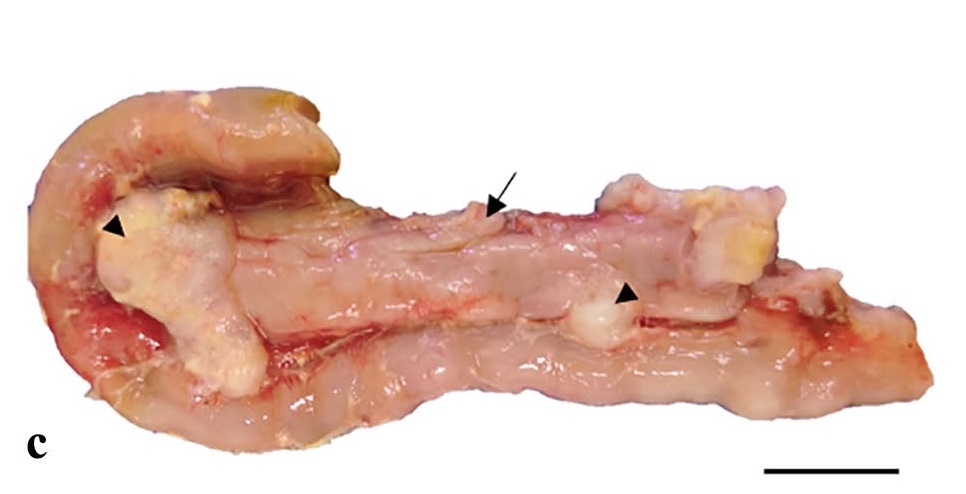
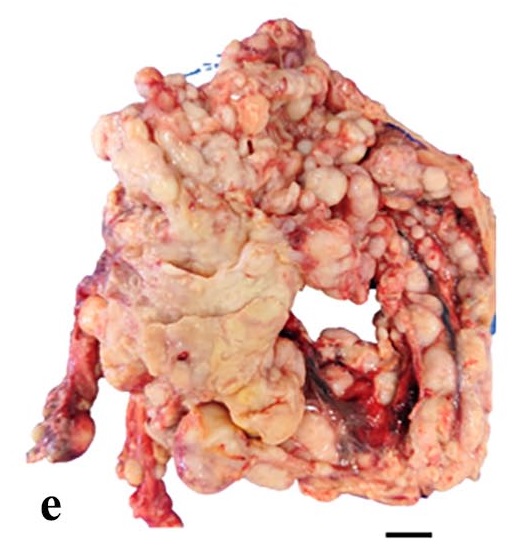
在肠系膜淋巴结、网膜、膈肌、肠系膜和腹膜浆膜上都发现了转移灶(下图)。
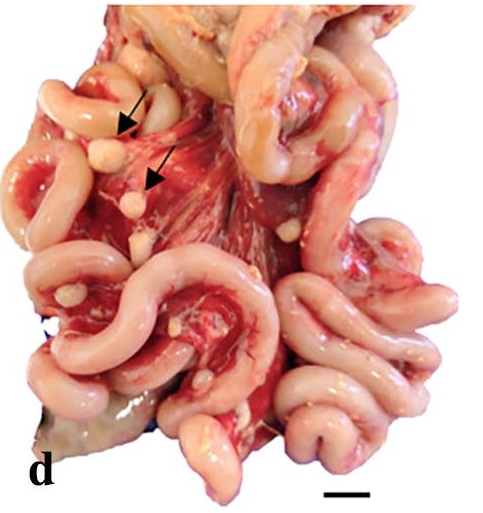
腹腔有一个不规则的实性肿块,来自肠系膜淋巴结,取代了上皮,并与脾脏粘连(下图)。膈肌浆膜上分布着许多白色实性斑块,大小为0.5-2.0 cm。
胰腺结节由扩张性增生组成,无包膜,由多角形细胞组成,主要呈腺样排列,具有大的针状结构,这些结构的中央间隙通常有不同数量的均匀嗜酸性物质填充(下图)。
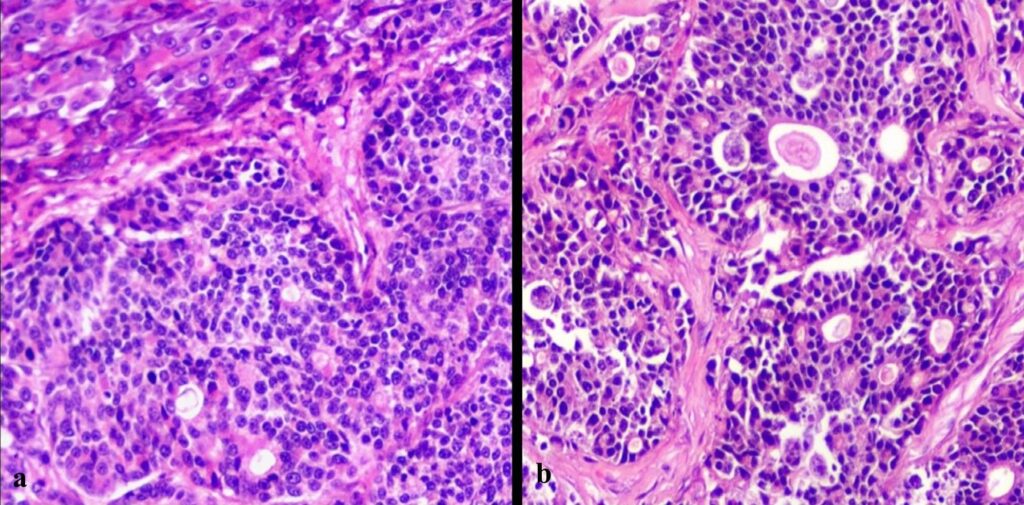
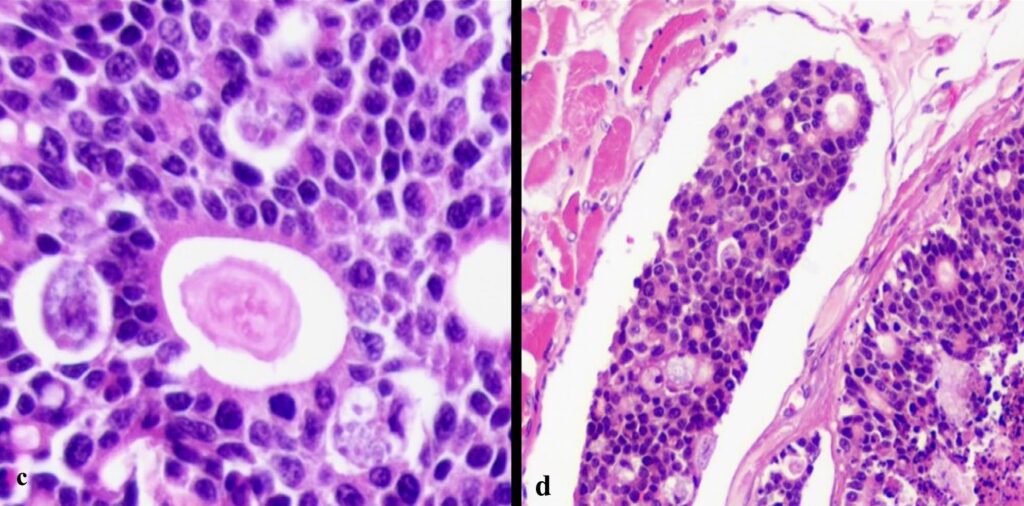
肿瘤细胞由细小的纤维血管基质支撑,压迫胰腺实质。肿瘤细胞呈多角形,界限清晰,有大量嗜酸性细胞质(下图c)。细胞核由粗糙的染色质和明显的核小体组成。观察到明显的细胞多形性、异形细胞增多和异形核增多,以及多处瘤内和外周淋巴侵袭(下图d)、瘤内坏死和41个有丝分裂像(2.37 mm2)。
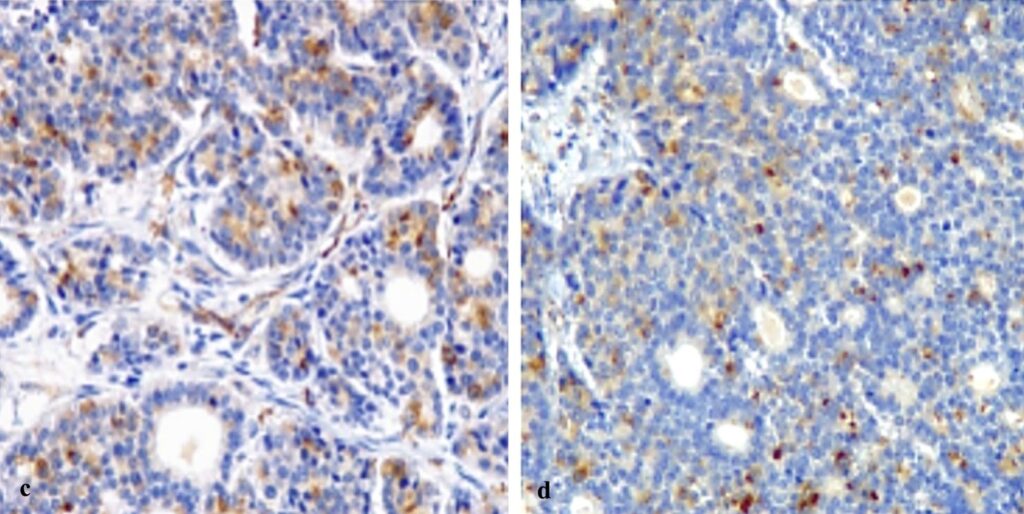
免疫组化显示肿瘤细胞对抗泛细胞角蛋白(AE1/AE3)和CK20呈强阳性(下图)。

约三分之一的细胞对嗜铬粒蛋白A (CgA)具有免疫反应(下图)。波形蛋白、CK7、突触素、WT-1、钙凝蛋白、CDX2和TTF-1均为阴性。组织病理学结果证实了胰腺神经内分泌癌的诊断。
04 讨论
神经内分泌癌是发生在人和动物身上的罕见肿瘤,起源于已知能产生激素和肽的神经内分泌系统的散在细胞[1,2]。
在人类中,神经内分泌癌多发生在胃肠道和支气管肺系统[3]。据报道,猫的神经内分泌癌发生在多个器官,包括胆囊[4]、皮肤[5]、结肠[6]、气管[7]、食道[8]和肝脏[9,10]。除本病例外,迄今为止只报道过一例猫胰腺神经内分泌癌[11]。
神经内分泌肿瘤是由表达神经内分泌分化标志物(包括CgA和突触素)以及激素和转录因子的肿瘤细胞产生的,激素和转录因子具有组织特异性,可将肿瘤细胞同化为正常的神经内分泌细胞[12]。
在人体中,发生在胰腺的神经内分泌肿瘤以神经内分泌分化型为主,根据WHO的分类,可分为不同的组织学亚型,包括分化良好的神经内分泌肿瘤、分化不良的神经内分泌癌和神经内分泌-非神经内分泌混合瘤[13]。
免疫组化是确定胰腺肿瘤类型的基础。细胞角蛋白(AE1/AE3)阳性——这是所有上皮细胞类型和癌的标记;而波形蛋白染色缺失——这是间质来源细胞和肉瘤的标记,这一特点可确认本病例为癌[14]。
以往报道的唯一一例猫胰腺神经内分泌癌病例发生在一只两岁大的混血雌猫身上,该猫曾出现与本病例类似的临床症状,如厌食、腹水、腹泻和体重减轻,而且还有多个转移性肝结节[11]。
一般来说,胰腺肿瘤在猫、狗和人类中都很罕见。其中,恶性胰腺肿瘤是猫狗最常见的肿瘤类型[16]。以前的研究表明,胰腺外分泌癌通常发生在老年猫身上,没有品种倾向[17,18]。在一项对34只患有胰腺外分泌癌的猫进行的回顾性研究中,猫的平均年龄为11岁,雄猫的发病率更高[19]。
在本病例中,没有观察到皮肤病变或癫痫发作,在整个研究期间血清葡萄糖浓度保持在正常范围内。考虑到临床症状并未显示这些激素分泌过多,本病例中的神经内分泌肿瘤可能不具有功能性。要明确区分功能性和非功能性神经内分泌肿瘤,需要检测生物活性肽的血清浓度和免疫组化。
本病例报告描述了一只被诊断为胰腺神经内分泌癌猫的临床症状和超声、组织学和免疫组化结果。虽然胰腺神经内分泌癌是一种不常见的肿瘤,但如果猫咪出现腹水、厌食和体重减轻等症状,并在腹部超声检查中发现胰腺肿块,胰腺神经内分泌癌必须作为鉴别诊断。
参考文献
1. Dala R, Shoosmith J, Lilenbaum R, et al. Primary hepatic neuroendocrine carcinoma: an underdiagnosed entity. Ann Diagn Pathol 2006; 10: 28–31.
2. American Society of Clinical Oncology (ASCO). Neuroendocrine tumors: introduction. (2018, accessed 13 December 2022).
3. Ferreira-Neves P, Lezmi S, Lejeune T, et al. Immunohistochemical characterization of a hepatic neuroendocrine carcinoma in a cat. J Vet Diagn Invest 2008; 20: 110–114.
4. Patnaik AK, Lieberman PH, Erlandson RA, et al. Hepatobiliary neuroendocrine carcinoma in cats: a clinicopathologic, immunohistochemical, and ultrastructural study of 17 cases. Vet Pathol 2005; 42: 331–337.
5. Bagnasco G, Properzi R, Porto R, et al. Feline cutaneous neuroendocrine carcinoma (Merkel cell tumour): clinical and pathological findings. Vet Dermatol 2003; 14: 111–115.
6. Slawienski MJ, Mauldin GE, Mauldin GN, et al. Malignant colonic neoplasia in cats: 46 cases (1990–1996). J Am Vet Med Assoc 1997; 211: 878–881.
7. Rossi G, Magi GE, Tarantino C, et al. Tracheobronchial neuroendocrine carcinoma in a cat. J Comp Pathol 2007; 137: 165–168.
8. Patnaik AK, Erlandson RA, Lieberman PH. Esophageal neuroendocrine carcinoma in a cat. Vet Pathol 1990; 27: 128–130.
9. Asakawa MG, Cullen JM, Linder KE. Necrolytic migratory erythema associated with a glucagon-producing primary hepatic neuroendocrine carcinoma in a cat. Vet Dermatol 2013; 24: 466–469.
10. Kita C, Yamagami T, Kinouchi S, et al. A feline case of hepatic neuroendocrine carcinoma with gastrin immunoreactivity. J Vet Med Sci 2014; 76: 887–890.
11. Michishita M, Takagi M, Kishimoto TE, et al. Pancreatic neuroendocrine carcinoma with exocrine differentiation in a young cat. J Vet Diagn Invest 2017; 29: 325–330.
12. Inzani F, Petrone G, Rindi G. The new World Health Organization classification for pancreatic neuroendocrine neoplasia. Endocrinol Metab Clin North Am 2018; 47: 463–470.
13. Rindi G, Klimstra DS, Abedi-Ardekani B, et al. A common classification framework for neuroendocrine neoplasms: an International Agency for Research on Cancer (IARC) and World Health Organization (WHO) expert consensus proposal. Mod Pathol 2018; 31: 1770–1786.
14. Santos SO, Cintra PP, Fonseca-Alves C, et al. Carcinoma indiferenciado de páncreas exocrino en perro: descripción de caso. Vet e Zootec 2017; 24: 303–310.
15. Anderson MJ, Kwong CA, Atieh M, et al. Mixed acinar-neuroendocrine-ductal carcinoma of the pancreas: a tale of three lineages. BMJ Case Rep 2016.
16. Törner K, Staudacher M, Steiger K, et al. Clinical and pathological data of 17 non-epithelial pancreatic tumors in cats. Vet Sci 2020; 7.
17. Bennett PF, Hahn KA, Toal RL, et al. Ultrasonographic and cytopathological diagnosis of exocrine pancreatic carcinoma in the dog and cat. J Am Anim Hosp Assoc 2001; 37: 466–473.
18. Seaman RL. Exocrine pancreatic neoplasia in the cat: a case series. J Am Anim Hosp Assoc 2004; 40: 238–245.
19. Linderman MJ, Brodsky EM, de Lorimier LP, et al. Feline exocrine pancreatic carcinoma: a retrospective study of 34 cases. Vet Comp Oncol 2013; 11: 208–218.
20. Toll AD, Mitchell D, Yeo CJ, et al. Acinar cell carcinoma with prominent intraductal growth pattern: case report and review of the literature. Int J Surg Pathol 2011; 19: 795–799.
21. Scott AT, Howe JR. Evaluation and management of neuroendocrine tumors of the pancreas. Surg Clin North Am 2019; 99: 793–814.
22. Nabeta R, Kanaya A, Ikeda N, et al. A case of feline primary duodenal carcinoid with intestinal hemorrhage. J Vet Med Sci 2019; 81: 1086–1089.
23. Zhang H, Shang D. Nonfunctional pancreatic neuroendocrine carcinoma with isolated retroperitoneal metastasis: a case report and literature review. Pancreas 2020; 49: e29–e31.
24. Up To Date. Classification, epidemiology, clinical presentation, localization, and staging of pancreatic neuroendocrine neoplasms. (2021, accessed 8 February 2022).
25. Diroff JS, Sanders NA, McDonough SP, et al. Gastrin-secreting neoplasia in a cat. J Vet Intern Med 2006; 20: 1245–1247.
26. Greene SN, Bright RM. Insulinoma in a cat. J Small Anim Pract 2008; 49: 38–40.