
| 一般情况 | |
|---|---|
 | 品种:混种猫 |
| 年龄:2岁 | |
| 性别:雌 | |
| 是否绝育:未知 | |
| 诊断:转移性腹膜间皮瘤 | |
01 主诉及病史
中度腹胀。
02 检查
腹部超声检查显示中度腹腔积液。对腹腔积液进行了细胞学检查,初步诊断为间皮瘤/肉瘤。随后进行了剖腹探查术,并采集了组织进行病理学检查。
03 预后
虽然术后明显恢复良好,但第二天突然死亡。
04 尸检
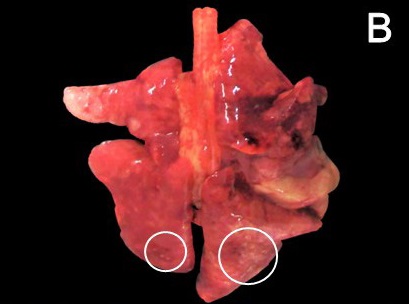
身体状况评分7/9。腹腔中收集到22 mL粘稠的暗红色液体。肝脏颜色极淡,呈淡黄色,有明显的分叶状。在腹膜、横膈膜、网膜、胃浆膜和大肠中观察到多个直径0.2-2.0 cm结节,凝聚、坚硬、发白,表面不规则(下图)。切开后,这些结节呈均匀的白色。

胸腔内有6 mL淡红色液体,肺实质有多个毫米大小、坚实、白色结节,弥漫分布于整个器官(下图)。胸腔和腹腔中的淋巴结没有变化。
显微镜下观察,腹膜、横膈膜、网膜、浆膜(胃和大肠)和肺部的结节样本的特征是圆形至椭圆形细胞增生,呈实心排列。这些细胞有中等程度的轻微嗜酸性胞质,核圆形、居中、染色质疏松、核仁明显(有时为多个),并显示出中等程度的细胞多形性,以中等程度的异形细胞增多为特征。高倍视野中平均有7-8个有丝分裂像。诊断为实性上皮样腹膜间皮瘤(下图)。

对角蛋白AE1/AE3、波形蛋白和钙凝蛋白进行了免疫组化检查。在AE1/AE3染色方面,网膜结节样本在大于75%的切片中显示出强细胞质阳性,而肺结节样本在小于25%的切片中显示出弱细胞质阳性。两个样本的抗波形蛋白抗体都没有免疫反应。在视黄醛染色方面,在网膜结节大于75%的切片中观察到强胞浆阳性(下图)。
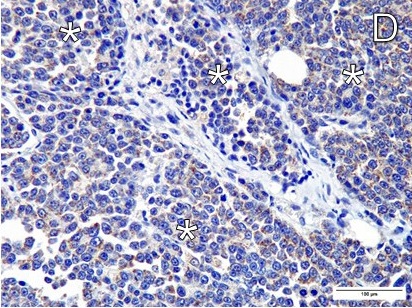
组织病理分析后发现了肺转移(下图)。

在小于25%的肺部切片中观察到了抗视黄醛染色阴性(下图)。
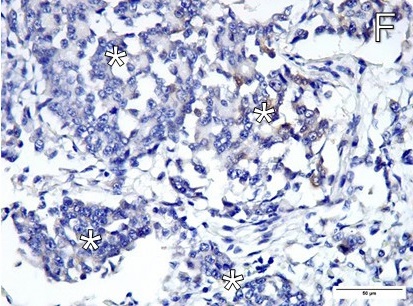
组织病理学和免疫组化检查显示,这是一例伴有肺转移的实性上皮样腹膜间皮瘤。
05 讨论
间皮瘤是构成胸腔和腹腔浆膜的间皮细胞的恶性肿瘤[1],通常累及胸膜、腹膜和心包[2]。这种疾病在猫科动物和其他物种中较为罕见,在犬和牛中的发病率较高[1]。
腹膜间皮瘤在人类中更为常见,通常与石棉和其他具有类似理化性质的颗粒有关[3,4]。在动物中,根据显微镜下发现的犬肺部铁锈质体,存在城市犬接触石棉与间皮瘤发病率相关的假说[5]。然而,在兽医学中,其病因尚未被完全阐明[4,6]。
间皮瘤的宏观表现从孤立的单个肿块到腹膜弥漫性增厚不等。不过,最常见的表现包括散布于腹膜各处的几毫米至几厘米大小的结节,并伴有浆膜增厚[1,4]。在组织学上,间皮瘤可分为三种类型:上皮样、肉瘤样(纤维状)或混合型(双相)[4,6]。
在猫中,间皮瘤更常影响胸膜,而较少在腹膜中确诊[4]。最常见的临床症状包括因胸膜积液导致的呼吸困难,或因肿瘤表面渗出或淋巴管被肿瘤阻塞导致的腹膜积液引起的腹胀[7]。由于预后不良,患者在确诊后通常会被安乐死[8]。
在本病例中,唯一的临床症状是腹胀,其特征是腹腔内有游离液体,这是在超声检查时观察到的,随后在尸体解剖时得到了证实。腹膜间皮瘤患者的临床症状包括体重减轻和嗜睡。由于腹膜间皮瘤是一种高度渗出性肿瘤,腹腔积液会导致腹胀[1,4,8-10]。然而,间皮瘤引起的腹腔积液必须与腹膜炎以及猫传腹区分开来[8]。
虽然液体细胞学分析有助于区分炎症性腹水或肿瘤性腹水[4],但在疑似间皮瘤的病例中,区分反应性间皮细胞和肿瘤性间皮细胞极具挑战性[4,8]。
在对该病例腹膜、横膈膜、网膜、浆膜(胃和大肠)和肺部的结节进行组织病理学检查时,观察到了间皮细胞的肿瘤性增生,形成了聚集体,这与肺转移的上皮样间皮瘤相符。上皮样亚型是猫中最常见的亚型[9,11,12],其特征是存在嗜酸性细胞质的圆形细胞、异形细胞、明显的核小体甚至多核细胞[1]。
在评估该病例的转移情况时,肺部结节的存在以及胸腔和腹腔淋巴结无宏观变化表明转移是通过血液途径发生的。尽管腹膜和腹膜后肿瘤的病因仍不确定[4,6],但一些纤维类型会发展成间皮瘤,这主要是由于此类元素的大小和可溶性[1]。
必须注意的是,间皮瘤的组织学成分可以从纯粹的上皮形态到纯粹的间质形态不等,甚至可以与侵入腹腔的原发癌或肉瘤相混淆[4]。转移至浆膜很常见,宏观上表现为白色斑块甚至弥漫性增厚区,这可能导致间皮瘤的错误诊断[1]。
此外,区分间皮瘤和活化或增生的间皮细胞也是一个巨大的挑战[1]。然而,在本病例中,腹部器官未观察到可导致怀疑消化道、生殖道或泌尿道原发性癌症的大肿瘤性变化。猫的结节仅限于网膜和受影响腹部器官的浆膜。
总之,本病例中一只两岁大的猫患有转移性腹膜间皮瘤,这凸显了这种疾病在兽医学中的罕见性和诊断难度。包括宏观、微观和免疫组化分析在内的综合检查不仅确诊了该病,还强调了这些详细方法在区分间皮瘤和其他肿瘤方面的重要性。这一非典型病例提醒人们在兽医实践中诊断和管理肿瘤病例的复杂性。
参考文献
[1] Uzal F. A., Plattner B. L., Hostetter J. M. In: Jubb, Kennedy, and Palmer’s pathology of domestic animals. 6nd. Maxie G., editor. Vol. 2. St. Louis: Elsevier; 2016. Alimentary system. p. 256.
[2] Bertolini G. In: Body MDCT in small animals. Bertolini G., editor. Cham: Springer; 2017. The peritoneal cavity, retroperitoneum, and abdominal wall. pp. 225–246.
[3] Gelberg H. B. In: Bases da patologia em veterinária. 6ª Zachary J. F., editor. Rio de Janeiro: Elsevier; 2018. Sistema digestório, peritônio, omento, mesentério e cavidade peritoneal. p. 1389.
[4] Munday J. S., Löhr C. V., Kiupel M. In: Tumors in domestic animals. 5nd. Meuten D. J., editor. Ames: Wiley Blackwell; 2017. Tumors of the alimentary tract. pp. 592–595.
[5] Harbison M. L., Godleski J. J. Malignant mesothelioma in urban dogs. Veterinary Pathology. 1983;20(5):531–540.
[6] Caswell J. L., Williams K. J. In: Jubb, Kennedy, and Palmer’s pathology of domestic animals. 6nd. Maxie M. G., editor. St. Louis: Elsevier; 2016. Respiratory system. pp. 518–523.
[7] Garrett L. D. In: Small animal clinical oncology. 4th. Withrow S. J., Vail D. M., editors. St. Louis: Saunders Elsevier; 2007. Mesothelioma.847.
[8] Morris J., Dobson J. In: Small animal oncology. 1st. Morris J., Dobson J., editors. Oxford: Blackwell Science; 2001. Miscellaneous tumors. pp. 270–272.
[9] Heerkens T. M.-J., Smith J. D., Fox L., Hostetter J. M. Peritoneal fibrosarcomatous mesothelioma in a cat. Journal of Veterinary Diagnostic Investigation. 2011;23(3):593–597.
[10] Morini M., Bettini G., Morandi F., Burdisso R., Marcato P. S. Deciduoid peritoneal mesothelioma in a dog. Veterinary Pathology. 2006;43(2):198–201.
[11] Bacci B., Morandi F., Meo M., Marcato P. S. Ten cases of feline mesothelioma: an immunohistochemical and ultrastructural study. Journal of Comparative Pathology. 2006;134(4):347–354.
[12] Weiss A. T. A., Costa A. B., Klopfleisch R. Predominantly fibrous malignant mesothelioma in a cat. Veterinary Medicine International. 2010;2010:396794.