
| 一般情况 | |
|---|---|
 | 品种:迷你腊肠犬 |
| 年龄:7个月 | |
| 性别:未知 | |
| 是否绝育:未知 | |
| 诊断:左心室流出道心脏粘液瘤 | |
01 主诉及病史
因心脏杂音、嗜睡和体重增加缓慢就诊。
02 检查
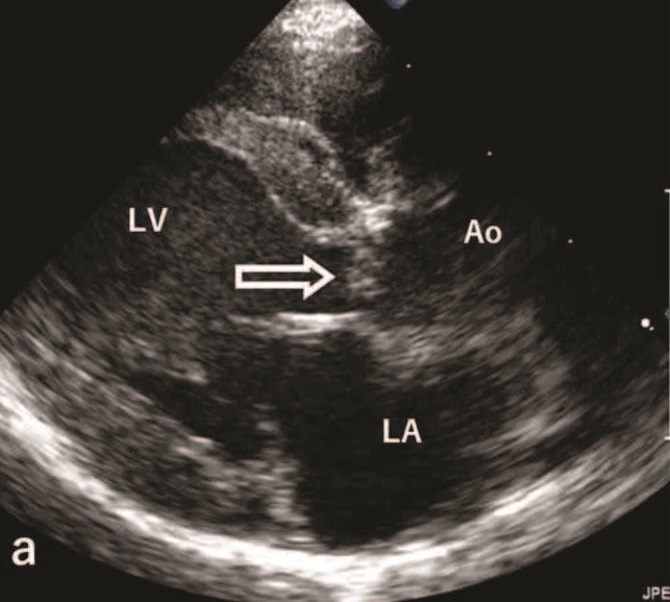
心率150次/分,胸骨附近心前区有4/6级收缩期杂音。心电图显示平均电轴为+82º,II、III和aVF导联出现二尖瓣P波。胸片显示心脏中度增大(心胸比70%),肺野混浊加重。超声心动图显示主动脉瓣下方的室间隔背侧有一个小的息肉样肿块(下图)。
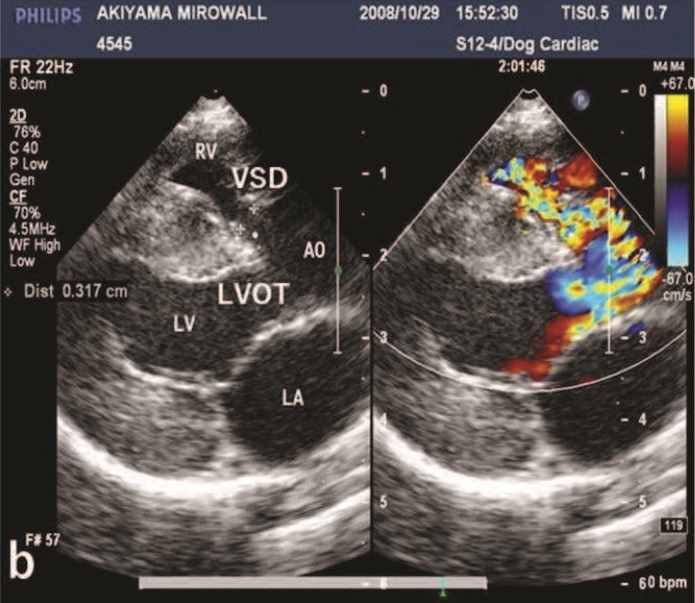
彩色超声心动图显示有两个血流加速区,形成马赛克模式:一个是直径为3.17 mm的膜状室间隔缺损(VSD),另一个是肿块造成的左心室出口梗阻(下图)。
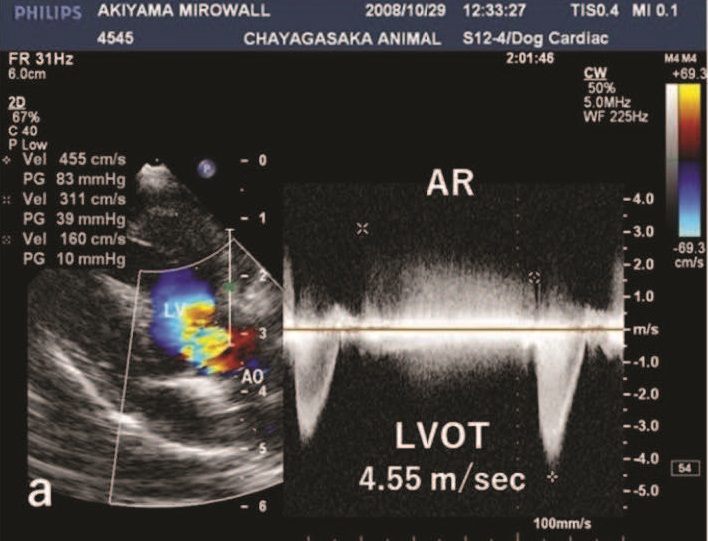
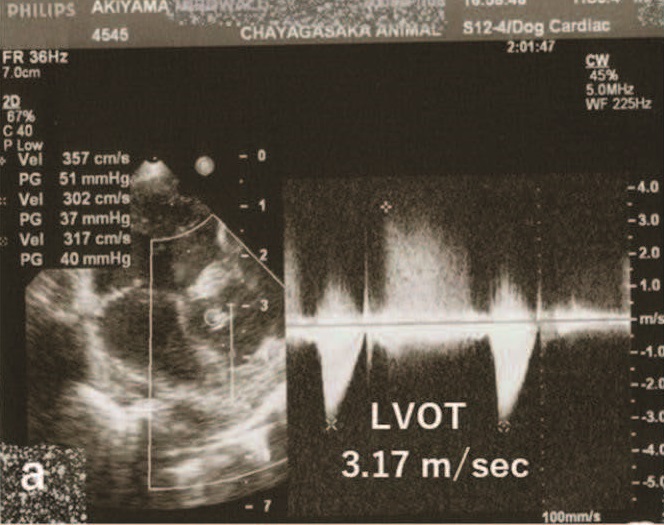
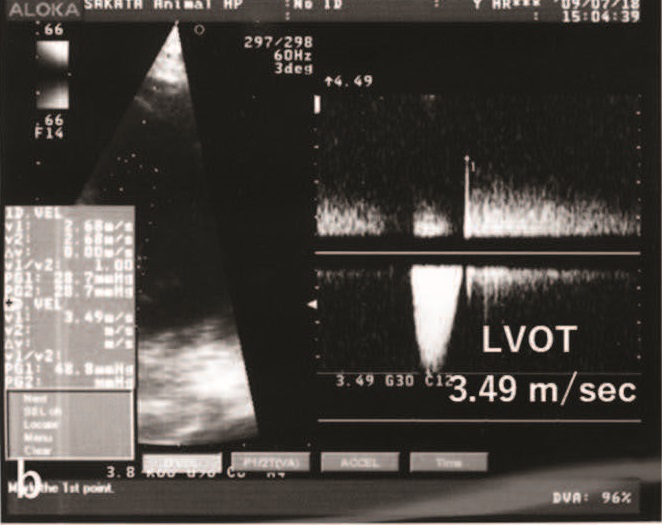
左心室出口血流速度为4.55 m/s,左心室和主动脉之间的收缩压阶差(ΔP)为83 mmHg(下图)。
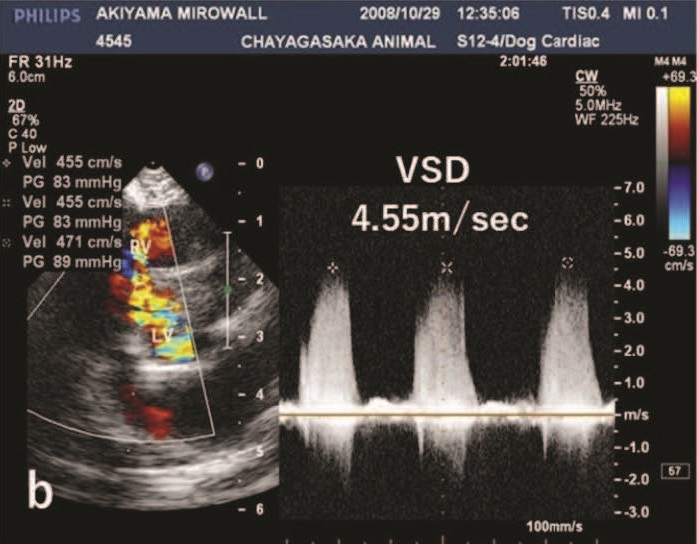
VSD血流速度为4.55 m/s,左心室和右心室之间的收缩压ΔP为83 mmHg(下图)。
还观察到主动脉瓣反流,反流的血流速度为3.11 m/s,主动脉和左心室之间的舒张压ΔP为39 mmHg。
根据这些检查结果,该犬被诊断为膜性VSD、因小息肉样肿块导致左心室流出道(LVOT)中度阻塞、轻度主动脉瓣反流。建议切除LVOT中的肿瘤并关闭VSD,该建议得到了主人的同意。
03 手术
麻醉后取左侧卧位。将静脉导管(12 Fr)和动脉导管(8 Fr)分别插入右颈静脉和右颈动脉,并将两者连接到低流量心肺旁路(CPB)系统。
在右侧第4肋间开胸后,结扎颧静脉,然后在头腔静脉和尾腔静脉周围缠上止血带,从右心耳插入经右心房至尾腔静脉的一级引流导管(12 Fr)。
固定用于心脏麻痹的主动脉根部导管后,夹住头腔静脉和尾腔静脉并启动泵。使用主动脉交叉钳(ACC),注入心脏麻痹溶液(10 mL/kg,4℃)。横向打开右心房,将球囊尖端尿道导管(6 F)插入冠状动脉窦腔(下图)。使用该导管将心脏麻痹溶液逆行注入冠状静脉(第一次注入10 mL/kg;每隔20分钟再注入一次,5 mg/kg)。
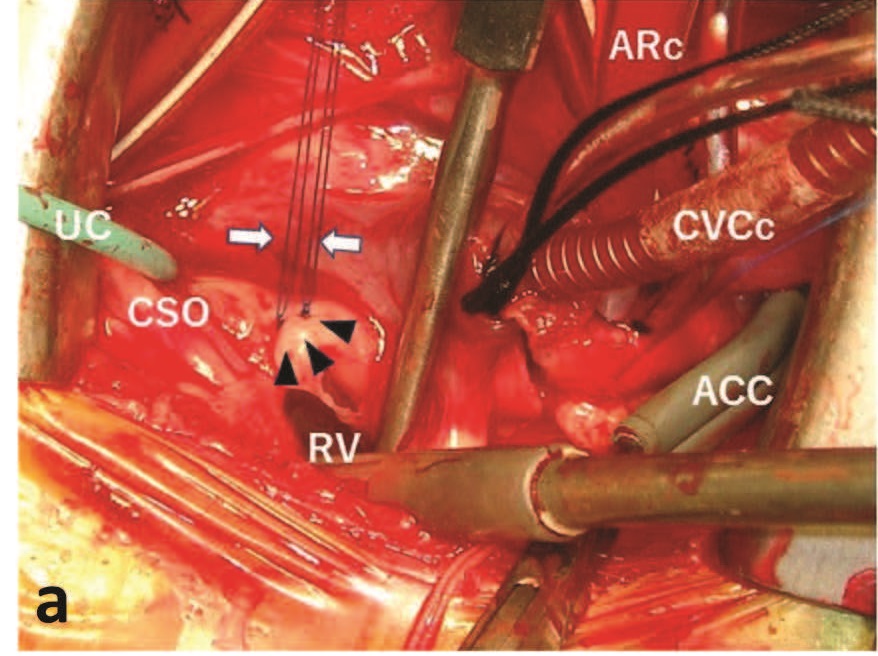
在三尖瓣室间隔瓣叶头端下方发现了一个膜性VSD,在主动脉瓣和肿块之间的左心室侧沟通。进行了主动脉斜切术,发现紧靠右冠状动脉尖下方有一个粉红色纤维瘤(10×8×4 mm)(下图)。
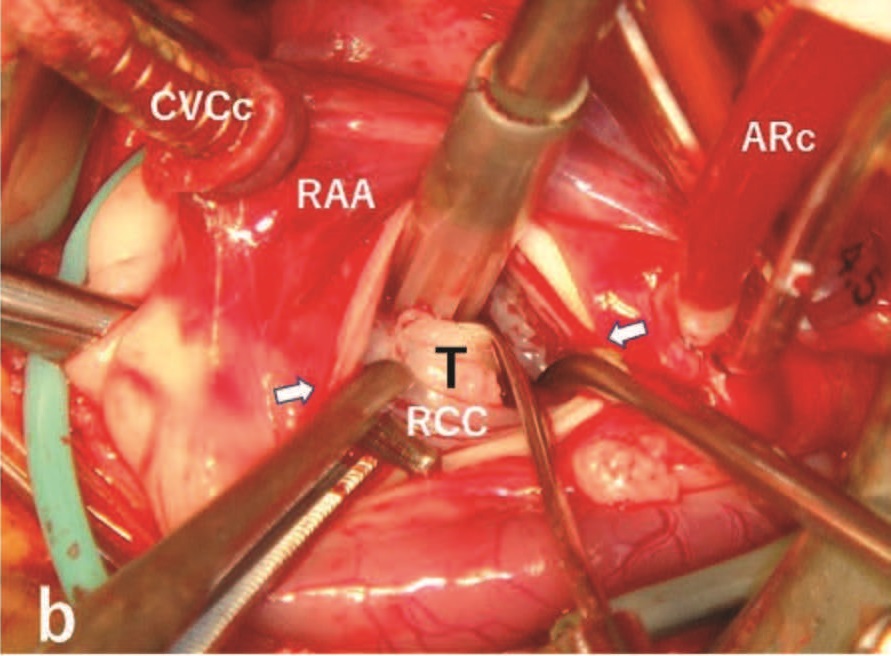
首先将缝线放入纤维瘤中,然后用眼科剪刀轻轻牵引瘤体,使其与下层的室间隔心肌分离。为了直接缝合VSD孔,在VSD孔下缘右侧和三尖瓣瓣环之间放置了两针5-0缝线并打结。最后使用双层连续5-0缝线缝合主动脉。
清除左心室的空气并松开ACC后,立即使用两次直流反电击(第一次5焦耳,第二次10焦耳)恢复自搏。关闭右心房和胸腔。ACC时间为65分钟,最低食道温度为21.1℃,泵血时间为2小时30分钟。术后3小时拔除气管插管。手术前后均静脉注射了20 mg/kg头孢唑啉钠。术后皮下注射10 mg/kg,每天两次,连续3天,口服4天。
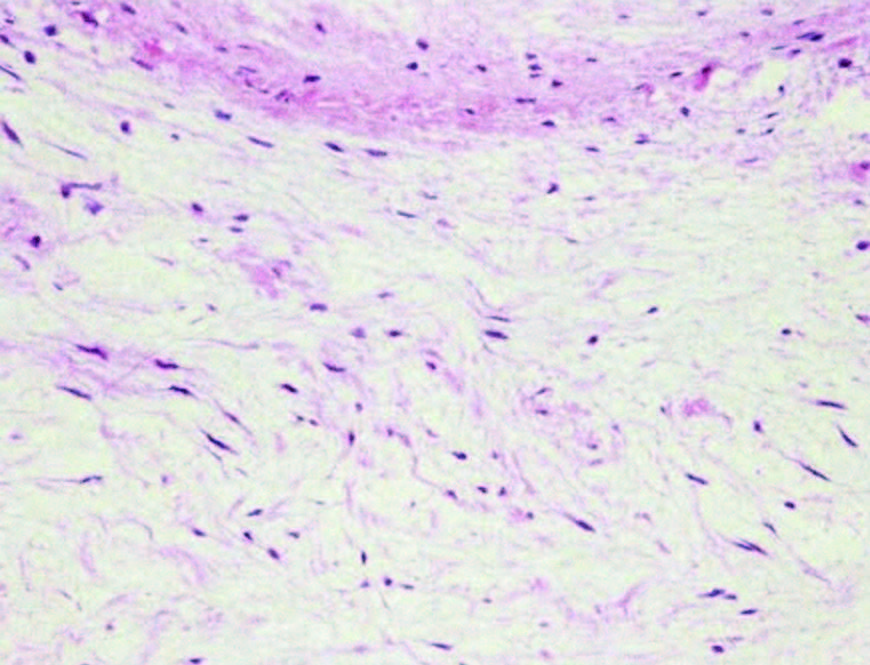
血涂片和伊红染色显示,纺锤形成纤维细胞样细胞稀疏分布在微弱的嗜酸性粘液样基质中(下图)。该肿瘤被诊断为粘液瘤(间叶良性肿瘤),组织病理学证实边缘无肿瘤。
04 预后
术后情况良好,10天后出院。术后听诊发现持续的2/6级收缩期杂音,彩色超声心动图显示VSD有轻微的残余分流血流。胸片显示术后心胸比(10天时为66%,8.5个月时为65.9%)低于术前(70%)。
左心室和主动脉之间的收缩压ΔP在术后(5天时为40 mmHg)也比术前(83 mmHg)低(下图)。
5天后基本保持不变,8个半月时为48.7 mmHg(下图)。
8个半月时,该犬没有心脏病的临床症状,体重增加到3.9 kg。
在随后的11年中没有出现心脏并发症。
05 讨论
心脏粘液瘤(cardiac myxoma)是一种良性肿瘤,可发生在任何心腔或瓣膜。右心室的三尖瓣是犬最常发生心脏粘液瘤的部位[1]。心脏粘液瘤在犬中极为罕见,在1982年至1995年的兽医数据库中,在729,265只犬中发现1,383只犬患有心脏肿瘤(发病率为0.19%)[2]。但是没有关于心脏粘液瘤发病率的报告。
正如以往文献所指出的[3],在涉及1,775只犬的三个回顾性病例系列中,没有一个心脏肿瘤是粘液瘤[2,4,5]。事实上,已发表的犬心脏粘液瘤病例只有12例,其中9例涉及心脏右侧[3,6-13],3例涉及心脏左侧[14-16]。在两份报告中,左侧心脏粘液瘤阻塞了LVOT,可能导致犬猝死[15,16]。
以往还没有关于患有VSD的犬患LVOT粘液瘤的报道。曾有报道称对一只大型犬成功进行了右心室流出道粘液瘤的手术修复[8],而对犬进行LVOT粘液瘤的手术修复尚未见报道。本报告描述了一只小型LVOT粘液瘤和VSD的诊断,以及使用CPB和表面冷却低温(sHT)同时进行的手术修复。
小型犬的开胸手术比大型犬更加困难[17]。本病例中的犬术前体重为2.88 kg,存在两个异常点,即LVOT肿瘤和膜状VSD。本病例采用的治疗方法是低流量CPB联合sHT[18]。同时进行两项手术时,预计会遇到困难;但两项手术都安全顺利地完成了。因此,在小型犬的开胸手术中,低流量CPB联合sHT似乎是一种可行的灌注技术。
在本病例中,为了最大限度地降低通过VSD或主动脉切开术发生空气栓塞的风险,心脏麻痹是必不可少的。为了进行心脏麻痹,首先将心脏麻痹溶液前行灌注到冠状动脉,然后继续逆行灌注到冠状动脉窦;这一过程非常有效。在这个病例中,由于主动脉手术视野狭窄,很难直接灌注冠状动脉造影剂。逆行心脏麻痹的灌注压力不能超过40 mmHg,否则可能会造成冠状静脉损伤、心肌出血和水肿[19]。
在本病例中,使用了两种直接结扎的褥式缝合方法来缝合小的膜状VSD。选择这种方法是因为它易于操作,而且对手术视野狭窄的小型犬的心脏传导系统损伤最小[20]。虽然贴片法已用于关闭人类的大VSD,但术后可能会出现完全性右束支传导阻滞[21]。
在以往研究中[22],使用三针褥式缝合法为一只接受CPB的小狗关闭了一个大的肺动脉瓣下型VSD。在本病例中,术后通过彩色超声心动图发现VSD有轻微的残余分流血流,但临床上并未发现问题。未发现心脏传导系统受损。
有两份关于犬心脏粘液瘤手术治疗的报告。其中一例中,粘液瘤起源于三尖瓣,使用CPB进行了切除;该犬在术后36小时死亡[10]。另一份报告包括两例粘液瘤,均位于右心室流出道[8]。其中一例犬在主人的要求下被安乐死。另一只通过肺动脉切开术和静脉流入闭塞手术切除了粘液瘤,该犬术后两年没有出现任何心脏症状。本病例中的这只犬在术后11年里一直没有出现心脏并发症,最后死于非心脏病。早期诊断和切除良性心脏肿瘤可能会使部分病例痊愈[8,15]。
这是首例对小型犬(体重<3 kg)同时手术修复心脏粘液瘤导致LVOT梗阻和膜状VSD的报道。除了描述这一复杂病例外,本报告还首次记录了在小型犬开胸手术中逆行心脏麻痹的情况。
文献来源:Mihara K, Kanemoto I, Ando T, Kawase K, Iguchi K, Yokoyama S, Asai A, Hoshi K. Simultaneous surgical repair of a cardiac myxoma causing left ventricular outflow tract obstruction and a ventricular septal defect in a small dog. Open Vet J. 2024 Feb;14(2):743-749.
参考文献
[1] Machida N, Sasaki T, Kimura Y. Pathological features of primary cardiac myxoid tumour in dogs: a review of 11 cases (2002-2020) J. Comp. Pathol. 2023;207:50–58.
[2] Walter J.H, Rudolph R. Systemic, metastatic, eu- and heterotope tumours of the heart in necropsied dogs. Zentralbl. Veterinarmed. A. 1996;43:31–45.
[3] Mellish C, Côtĕ É, Aburto E, Lichtenberger J. Mineralized, obstructive cardiac myxoma with chondroid differentiation in a cocker spaniel. Can. Vet. J. 2022;63:411–415.
[4] Walter J.H, Rudolph R. Systemic, metastatic, eu- and heterotope tumours of the heart in necropsied dogs. Zentralbl. Veterinarmed. A. 1996;43:31–45.
[5] Aupperle H, März I, Ellenberger C, Buschatz S, Reischauer A, Schoon H.A. Primary and secondary heart tumours in dogs and cats. J. Comp. Pathol. 2007;136:18–26.
[6] Roberts S.R. Myxoma of the heart in a dog. J. Am. Vet. Med. Assoc. 1959;134:185–188.
[7] Darke P.G, Gordon L.R. Cardiac myxoma in a dog. Vet. Rec. 1974;95:565–567.
[8] Bright J.M, Toal R.L, Blackford L.A.M. Right ventricular outflow obstruction caused by primary cardiac neoplasia. Clinical features in two dogs. J. Vet. Intern. Med. 1990;4:12–16.
[9] Ori J, Yamaguchi T, Sasa Y, Komiya M, Narama I. A case of canine cardiac myxoma. J. Jpn. Vet. Med. Assoc. 1994;47:499–501.
[10] Machida N, Hoshi K, Kobayashi M, Katsuda S, Yamane Y. Cardiac myxoma of the tricuspid valve in a dog. J. Comp. Pathol. 2003;129:320–324.
[11] Akkoc A, Ozyigit M.O, Cangul I.T. Valvular cardiac myxoma in a dog. J. Vet. Med. A. Physiol. Pathol. Clin. Med. 2007;54:356–358.
[12] Šimundić M, Domanjko Petrič A, Pavlin D, Zemljič T, Firm I, Gombač M, Srečnik Š, Stojov M, Šimenc L, Švara T. Cardiac myxoma in a dog. Slov. Vet. Res. 2019;56:133–138.
[13] Alfaro L, Enciso A, Enciso J. Cardiac myxoma in the pulmonary trunk of a canine: presence of mesenchymal stem-like cells. Thai J. Vet. Med. 2020;50:431–434.
[14] Fernandez-del Palacio M.J, Sanchez J, Talavera J, Martínez C. Left ventricular inflow tract obstruction secondary to a myxoma in a dog. J. Am. Anim. Hosp. Assoc. 2011;47:217–223.
[15] de Nijs M.I, Vink A, Bergmann W, Szatmári V. Left ventricular cardiac myxoma and sudden death in a dog. Acta Vet. Scand. 2016;58:41–44.
[16] Stack J.P, Fries R.C, Samuelson J.P. Subaortic cavitated myxoma causing severe left ventricular outflow tract obstruction in a young dog. Case Rep. 2021;5:340–345.
[17] Kanemoto I, Mihara K, Sato K. Open-heart techniques and mitral valve plasty for mitral regurgitation in toy- and small-breed dogs: a review. Open Vet. J. 2021;11:14–26.
[18] Kanemoto I, Taguchi D, Yokoyama S, Mizuno M, Suzuki H, Kanamoto T. Openheart surgery with deep hypothermia and cardiopulmonary bypass in small and toy dogs. Vet. Surg. 2010;39:674–679.
[19] Lolley D.M, Hewitt R.L. Myocardial distribution of asanguineous solutions retroperfused under low pressure through the coronary sinus. J. Cardiovasc. Surg. (Torino) 1980;21:287–294.
[20] Ohara K, Kanemoto I, Masumoto T, Suzuki H, Itoh T, Nakanishi A. A case of ventricular septal defect in a dog surgically repaired under surface-induced hypothermia. J. Jpn. Vet. Med. Assoc. 2001;54:380–382.
[21] Fukuda T, Suzuki T, Kashima I, Sato M, Morikawa Y. Shallow stitching close to the rim of the ventricular septal defect eliminates injury to the right bundle branch. Ann. Thorac. Surg. 2002;74:550–555.
[22] Shimizu M, Tanaka R, Hoshi K, Hirao H, Kobayashi M, Shimamura S, Yamane Y. Surgical correction of ventricular septal defect with aortic regurgitation in a dog. Aust. Vet. J. 2006;84:117–121.