
| 一般情况 | |
|---|---|
 | 品种:美国短毛猫 |
| 年龄:3.5岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:双出口右心房 | |
01 主诉及病史
3天前出现呕吐、厌食和间歇性呼吸困难。
02 检查
就诊当天接受了胸部X光检查(下图),发现心脏明显肿大,双心房增大,心脏轮廓呈球状,提示心包积液。肺动脉和肺静脉扩张明显,有少量胸腔积液,弥漫性轻度间质性病变,支气管周围充血。放射学检查结果提示充血性心力衰竭。

体格检查发现支气管肺泡音增强、呼吸急促、张口呼吸、心动过速且心律不齐、左侧胸骨旁收缩期心脏杂音为II/VI级。床旁超声检查显示左心房(LA)明显增大、胆囊壁水肿和尾腔静脉扩张。
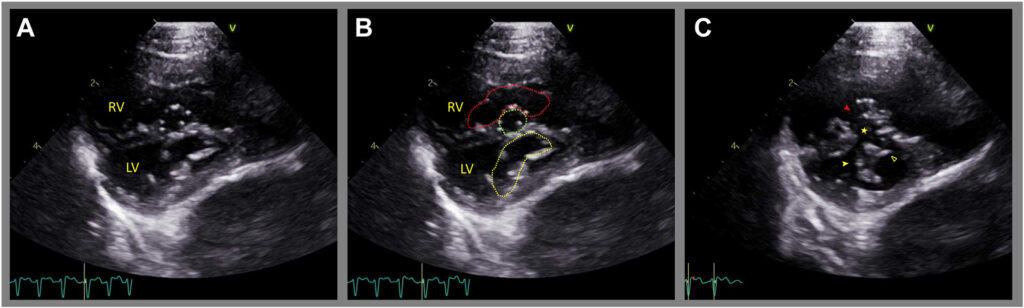
超声心动图结果证实LA和左心耳明显扩张,左心耳内可看到自发的回声。LA与主动脉根部比率为4.1(参考值1.0-1.4)。心室呈d形,左、右房室瓣位于同一水平。存在房间隔缺损(ASD),心尖间隔(IAS)明显左偏(下图及视频1)。

↑ 视频1:右侧胸骨旁四腔长轴切面显示,由于DORA形态,心尖IAS向左偏移,将明显扩张的LA分为近腔和远腔。左房室瓣和右房室瓣在同一水平插入,符合AVSD。心包和左心室游离壁与LA之间有轻度心包积液。
发现室间隔缺损(VSD)。然而,由于房室瓣组织粘附在室间隔嵴上,在该区域检测不到血流。检查发现一个房室环和两个房室口,左房室瓣前叶裂开(下图)。
偏离的IAS导致从近端到远端LA的血流明显受阻,阻塞处有持续的高速血流(峰值2.25 m/s;估计梯度20 mmHg)(下图及视频2)。
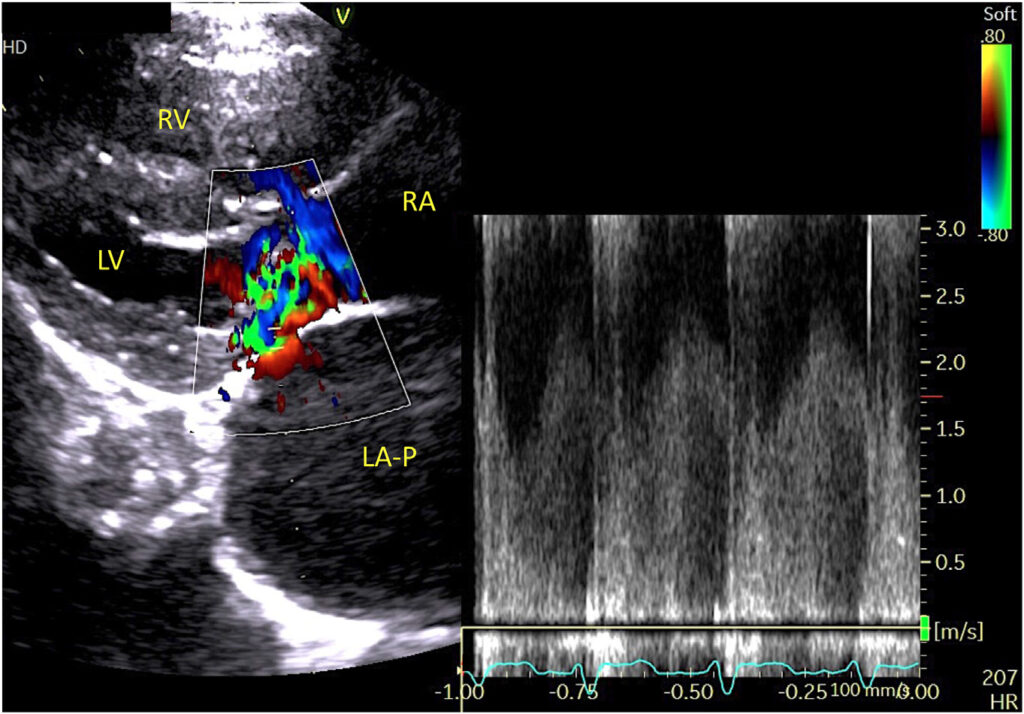
↑ 视频2:右胸骨旁四腔长轴切面,同步彩色血流多普勒,显示从LA近端到远端有连续的湍流穿过因DORA导致的心尖IAS左偏而形成的阻塞。
由于IAS的位置异常,测量右心房(RA)直径具有挑战性,主观上认为RA严重增大。根据舒张末期1.34 cm的右心室(RV)内径和舒张末期4.4 mm的右心室游离壁厚度,得出右心室腔扩张也很明显。
右房室瓣和左房室瓣均出现反流,右房室瓣反流的速度提示肺动脉高压,RV压力估计至少为45 mm Hg。在卵圆窝位置的IAS存在间歇性回声脱落。还发现轻度心包积液,怀疑继发于慢性心力衰竭。
通过向右头静脉注射2 mL生理盐水进行盐水造影检查,可见心内微泡同时进入RA和远端LA腔,然后流出进入左心室(LV)和RV(下图及视频3)。没有微泡进入近端LA。

↑ 视频3:生理盐水造影,右侧胸骨旁长轴四腔切面,显示心内微泡从RA腔到LA腔远端依次出现,然后同时进入RV和LV。在近端LA腔内没有发现微泡。
最终诊断为双出口右心房(DORA),分类为继发于房间隔错位和过渡性AVSD的DORA。
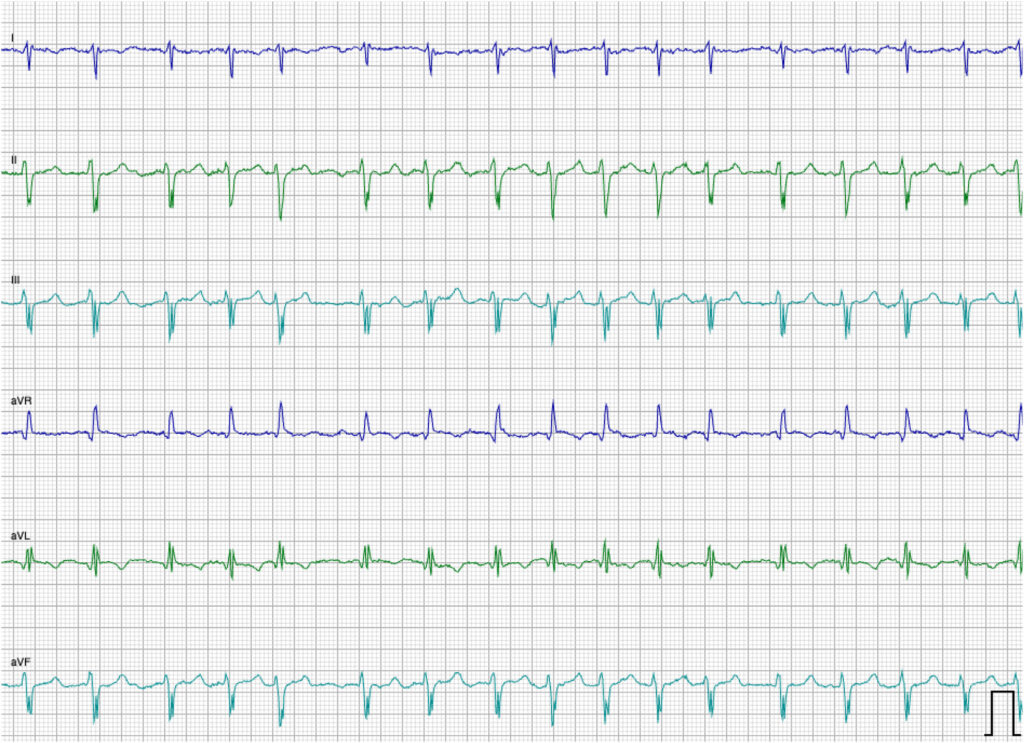
超声心动图期间的心电图提示心房颤动,心室快速反应率介于220-300次/分。六导联心电图证实了心房颤动伴右束支传导阻滞(下图)的诊断。
推测猫先天性病变的病理生理学以及由此导致的明显慢性心力衰竭的失代偿始于LA近端和远端腔室之间的血流受阻,导致LA近端压力升高和该腔室扩张。随着时间的推移,LA压力升高导致毛细血管后肺动脉高压,继而导致右侧心脏重塑,包括RV肥厚和RA扩张。明显的心房扩大使该猫容易发生心房颤动,而这种快速性心律失常的发生很可能导致临床上的慢性心力衰竭,表现为肺水肿、少量胸腔积液和心包积液。
03 预后
由于预后不良,在主人的要求下出院回家接受姑息治疗。
药物治疗包括口服呋塞米(1.1 mg/kg,每天两次)、盐酸地尔硫卓(3.2 mg/kg,每天两次)、硫酸氢氯吡格雷(4 mg/kg,每天一次)、枸橼酸马罗匹坦(1.7 mg/kg,每天一次)。在耳廓上涂抹2%米氮平外用软膏,每天一次。
患者在家中的状态不佳,3天后接受安乐死,主人拒绝进行尸检。
04 讨论
双出口右心房(Double outlet right atrium,DORA)是一种房室间隔缺损(AVSD),在家猫中很少见[1-3]。一项关于猫先天性心脏病患病率的研究报告称,在对57,418只猫的记录进行评估后发现了6例AVSD,其中没有一例具有DORA形态[1]。另一项研究描述了26只猫的AVSD自然病史,报告称其中只有4只具有DORA形态[2]。
DORA的临床表现多种多样,临床症状从呕吐、厌食到呼吸困难不等[2,3]。在急诊情况下,超声检查可指导治疗,并及时进行经胸超声心动图(TTE)检查,以诊断这种先天性心脏畸形[4]。本病例报告以TTE成像为重点,描述了一例罕见的家猫DORA的表现、诊断结果和治疗方法。
对于LA有分隔的患者,还必须考虑DORA以外的其他诊断,包括三房心综合征(CTS)和二尖瓣上环。后两种情况都会导致近端和远端LA,但是CTS的分界在左心耳的上方,而二尖瓣上环的分界在左心耳的下方。
在DORA伴有原位ASD的情况下(如本病例所示),左心耳位于分界上方。然而,分界可被识别为向左偏离的IAS。在CTS 和二尖瓣上环病例中,如果没有并发的先天性畸形,IAS的位置应该是正常的。
此外,DORA是AVSD的一种亚型,因此在DORA病例中,左、右房室隔缺失,左、右房室瓣在同一水平插入,而在仅有CTS或上膈环的病例中则不会出现这种情况。最后,使用生理盐水进行对比超声心动图检查可通过观察心内微泡从RA进入LA远端,然后同时进入两个心室来帮助确认DORA。
传导系统异常在人类AVSD患者中已得到广泛认可[13]。在数量有限的患有AVSD的猫中也有类似的传导系统异常[2,3]。更具体地说,在之前报道的5例猫DORA中,有4例同时被诊断为部分或完全右束支传导阻滞(RBBB)[2,3]。
本报告中的猫也出现了这种情况,这提示临床医生在发现猫部分或完全性RBBB时应考虑将AVSD和DORA作为可能的鉴别诊断。在本病例中,除了传导障碍外,由于明显的心房扩张,猫还出现了心房颤动。
尽管DORA会对血液动力学产生影响,但患有这种先天性缺陷的猫成年后仍可能没有症状,本报告中的猫就证明了这一点,它在确诊时已经3.5岁了。在之前报道的5个猫DORA病例中,有3个在确诊时已经成年,年龄分别为5.1岁、9.0岁和12.9岁[2,3]。另外2只报告的猫在确诊时还是幼猫(5个月大和11个月大)[2]。
与本报告中的猫一样,文献中描述的大多数患有DORA的猫都出现了慢性心力衰竭,因此需要进行TTE检查和随后的缺陷诊断。有些猫成年后仍无症状,其原因尚不完全清楚,但有些猫的LA顺应性优于其他猫。
在成年后才出现症状的人类CTS患者中,有人推测临床症状减轻可能与心房分隔膜纤维化或钙化的发生、二尖瓣反流的长期发展或心房颤动的发生有关[14]。这些因素也可能在患有DORA的猫中起作用。在本病例报告中,心房颤动的发生被认为是引发临床失代偿的原因之一。
总之,DORA是猫的一种罕见先天性心脏缺陷,可通过TTE诊断。尽管DORA会对血液动力学产生影响,但患有这种缺陷的猫直到成年也可能得不到诊断。
文献来源:Denton M, Vitt JP, Saunders AB, Wesselowski S. Double Outlet Right Atrium in an American Domestic Shorthair Cat. CASE (Phila). 2024 Mar 8;8(3Part A):241-246.
参考文献
1. Schrope D.P. Prevalence of congenital heart disease in 76,301 mixed-breed dogs and 57,025 mixed-breed cats. J Vet Cardiol. 2015;17:192–202.
2. Schrope D.P. Atrioventricular septal defects: natural history, echocardiographic, electrocardiographic, and radiographic findings in 26 cats. J Vet Cardiol. 2013;15:233–242.
3. Durham J., Maisenbacher H. Double-outlet right atrium in a 9 year-old cat. J Vet Cardiol. 2014;16:127–131.
4. Ward J.L., DeFrancesco T.C. The role of point-of-care ultrasound in managing cardiac emergencies. Vet Clin North Am Small Anim Pract. 2023;53:1429–1443.
5. Abbott J.A., MacLean H.N. Two-dimensional echocardiographic assessment of the feline left atrium. J Vet Intern Med. 2006;20:111–119.
6. Visser L.C., Sloan C.Q., Stern J.A. Echocardiographic assessment of right ventricular size and function in cats with hypertrophic cardiomyopathy. J Vet Intern Med. 2017;31:668–677.
7. Gupta S.K., Gupta A., Ramakrishnan S., Anderson R.H. Clarifying the atrioventricular junctional anatomy in the setting of double outlet right atrium. Ann Pediatr Cardiol. 2015;8:233–239.
8. Scansen B.A., Schneider M., Bonagura J.D. Sequential segmental classification of feline congenital heart disease. J Vet Cardiol. 2015;17(Suppl 1):S10–S52.
9. Brancaccio G., Amodeo A., Rinelli G., Filippelli S., Sanders S.P., Di Donato R.M. Double-outlet right atrium: anatomic and clinical considerations. Ann Thorac Surg. 2007;83:619–621.
10. Van Mierop L.H.S. Second Henry Ford Hospital International Symposium on Cardiac Surgery. Appleton-Century-Crofts; New York: 1977. Pathology and pathogenesis of endocardial cushion defects. Surgical implications; pp. 201–207.
11. Cooper R.S. Endocardial cushion defects: embryology, anatomy and pathophysiology. Adv Cardiol. 2004;41:118–126.
12. Shetkar S.S., Kothari S.S. Double-outlet left atrium: ventriculo-atrial malalignment defect. Ann Pediatr Cardiol. 2013;6:158–161.
13. Feldt R.H., DuShane J.W., Titus J.L. The atrioventricular conduction system in persistent common atrioventricular canal defect: correlations with electrocardiogram. Circulation. 1970;42:437–444.
14. Alphonso N., Nørgaard M.A., Newcomb A., d’Udekem Y., Brizard C.P., Cochrane A. Cor triatriatum: presentation, diagnosis and long-term surgical results. Ann Thorac Surg. 2005;80:1666–1671.
15. Ambra M., Nuri H.A., Giuseppe P., Marasini M., Francesco S. Double-outlet right atrium: review of a rare anomaly with an exemplary case [published correction appears in World J Pediatr Congenit Heart Surg. 2020 Jul;11(4):391] World J Pediatr Congenit Heart Surg. 2020;11:79–84.
16. Pelosi A., Anderson L.K., Paugh J., Robinson S., Eyster G.E. Challenges of cardiopulmonary bypass-a review of the veterinary literature. Vet Surg. 2013;42:119–136.
17. Brourman J.D., Schertel E.R., Holt D.W., Olshove V.A. Cardiopulmonary bypass in the cat. Vet Surg. 2002;31:412–417.
18. Uechi M., Harada K., Mizukoshi T., Mizuno T., Mizuno M., Ebisawa T., et al. Surgical closure of an atrial septal defect using cardiopulmonary bypass in a cat. Vet Surg. 2011;40:413–417.
19. Côté E. Feline congestive heart failure: current diagnosis and management. Vet Clin North Am Small Anim Pract. 2017;47:1055–1064.
20. Hogan D.F., Fox P.R., Jacob K., Keene B., Laste N.J., Rosenthal S., et al. Secondary prevention of cardiogenic arterial thromboembolism in the cat: the double-blind, randomized, positive-controlled feline arterial thromboembolism; clopidogrel versus aspirin trial (FAT CAT) J Vet Cardiol. 2015;17(Suppl 1):S306–S317.
21. Allen J.W., Phipps K.L., Llamas A.A., Barrett K.A. Left atrial decompression as a palliative minimally invasive treatment for congestive heart failure caused by myxomatous mitral valve disease in dogs: 17 cases (2018-2019) J Am Vet Med Assoc. 2021;258:638–647.
22. Santilli R., Moïse S.N., Pariaut R., Perego M. Edra S.p.A.; 2018. Electrocardiography of the Dog and Cat: Diagnosis of Arrhythmias.