
| 一般情况 | |
|---|---|
 | 品种:可卡犬 |
| 年龄:10岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:副脾血管肉瘤 | |
01 主诉及病史
嗜睡。
02 检查
体温38.8℃,心率150次/分,呼吸42次/分,血压130 mmHg。
全血细胞计数显示贫血(Hct 14.4%;参考值37.3-61.7)、白细胞增多(26.15 K/µL;参考值5.05-16.76)和血小板减少(60 K/µL;参考值148-484)。血生化和尿液分析结果无异常。
胸片正常。腹部X光检查显示腹部膨胀。
在超声引导下进行腹腔穿刺术,引流出1500 mL腹水。腹水为出血性渗出物(血细胞比容14.6%)。细胞学检查发现腹水背景中有一些红细胞,未发现肿瘤细胞或细菌。
腹部超声显示,除了剩余少量腹水外,主要病变有以下三个:
(1)脾脏结节;
(2)右侧尾腹部巨大肿块;
(3)大量肠系膜结节。
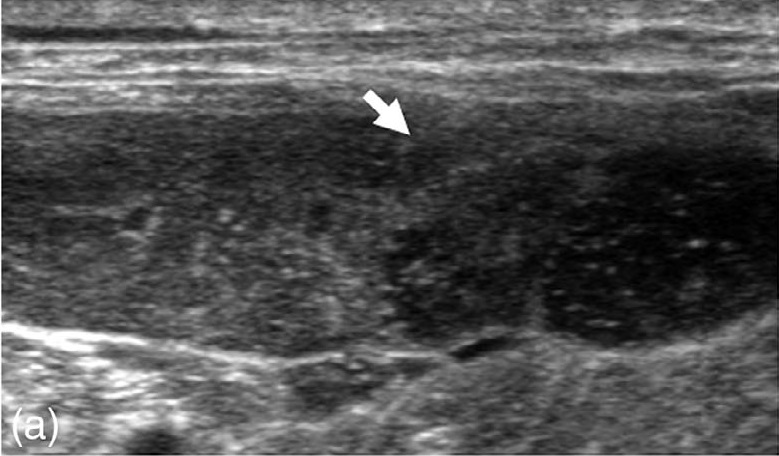
脾实质中观察到异质性低回声结节(最大2.0×1.4 cm),扭曲了脾脏边界(下图)。脾脏结节未显示血流信号。
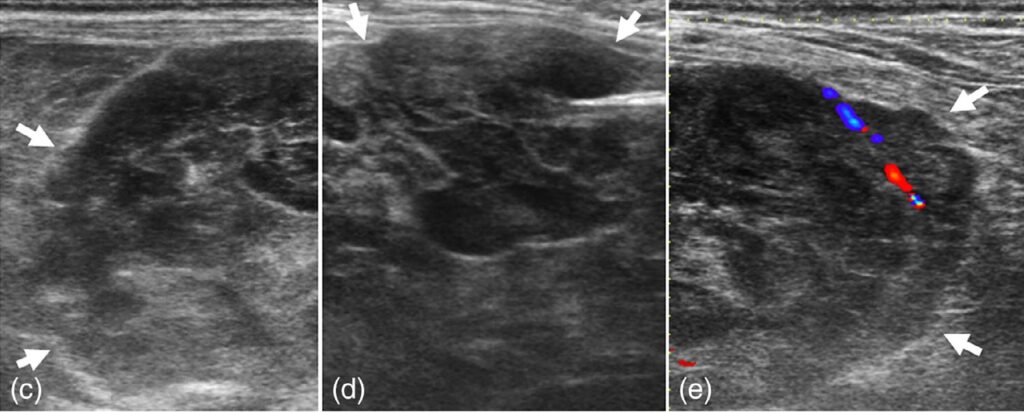
在膀胱前方的右侧尾腹部观察到一个巨大的异型不等回声肿块,部分边缘模糊不清(下图)。肿块非常大,很难通过超声评估其大小。肿块边缘有血流信号。肿块中有几个模糊的低回声区,但没有血流信号,很难区分是腔隙性病变还是低回声组织实质。肿块与其他邻近器官之间没有明显的联系。
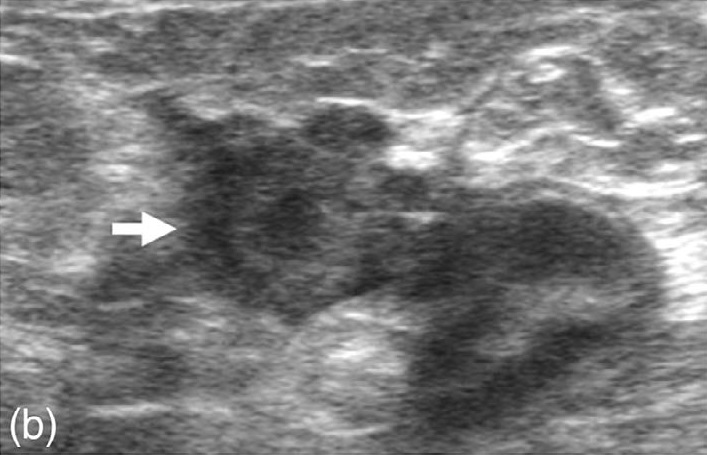
在整个肠系膜上观察到不同大小(最大1.4×1.4 cm)、圆形或分叶形的异质性低回声结节,周围有轻度脂肪水肿(下图)。
根据超声检查结果,巨大肿块被怀疑来自肠系膜或由脾脏结节转移而来;脾脏结节被认为是原发性脾脏病变或尾腹部肿块的转移灶。多个肠系膜结节怀疑为淋巴结转移。
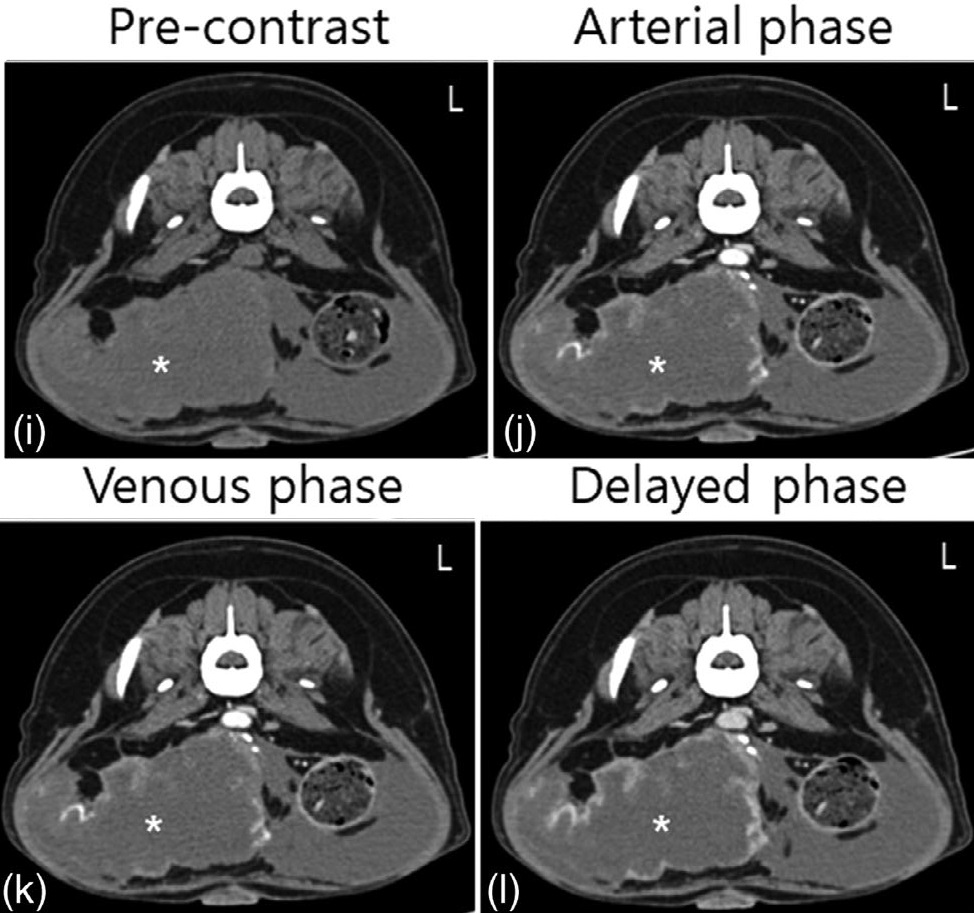
胸部CT中除胸骨淋巴结肿大外,没有其他明显发现。整个腹部增强CT观察到边缘光滑的软组织衰减(59 HU)多发结节(最大直径13 mm)(下图)。
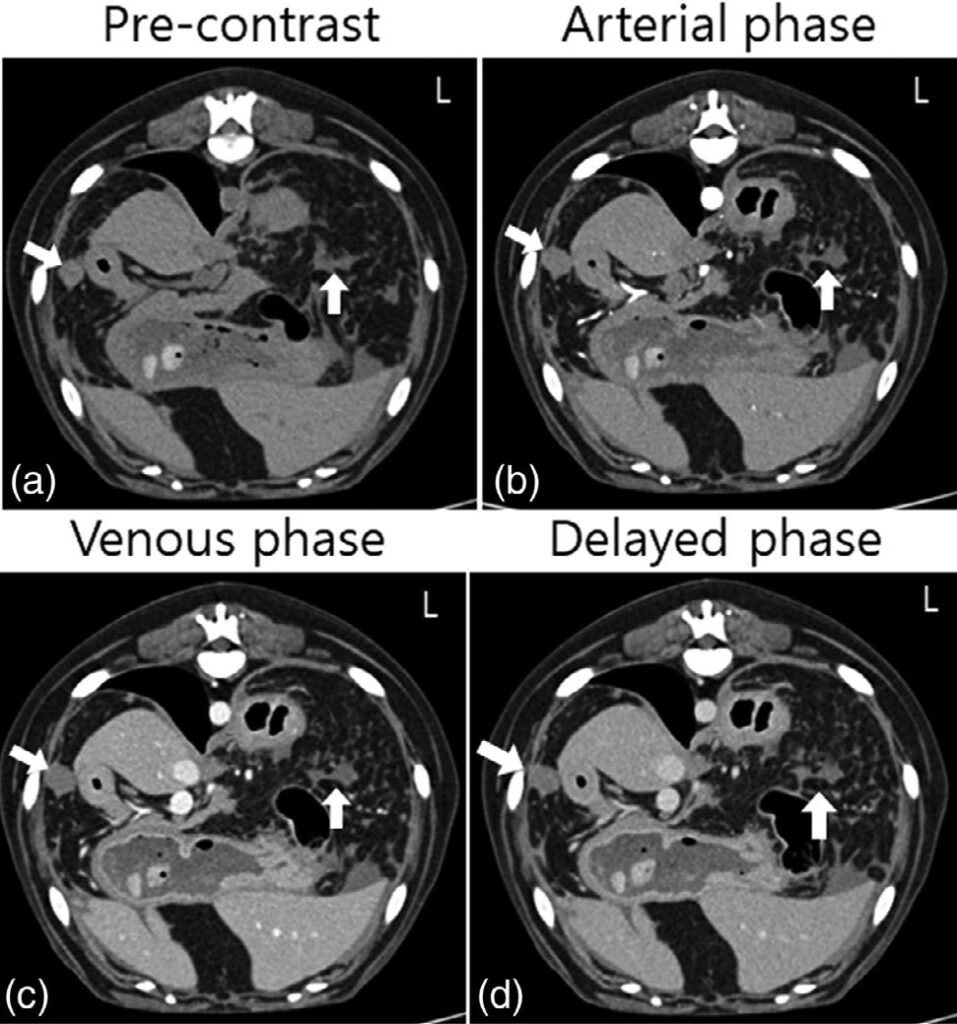
这些结节在动脉期、门脉期和延迟期(60-63 HU)均未显示明显的对比度增强。此外,在整个脾实质中观察到多个小囊性结节(最大直径19 mm),无对比增强(对比前后均为30 HU)(下图)。
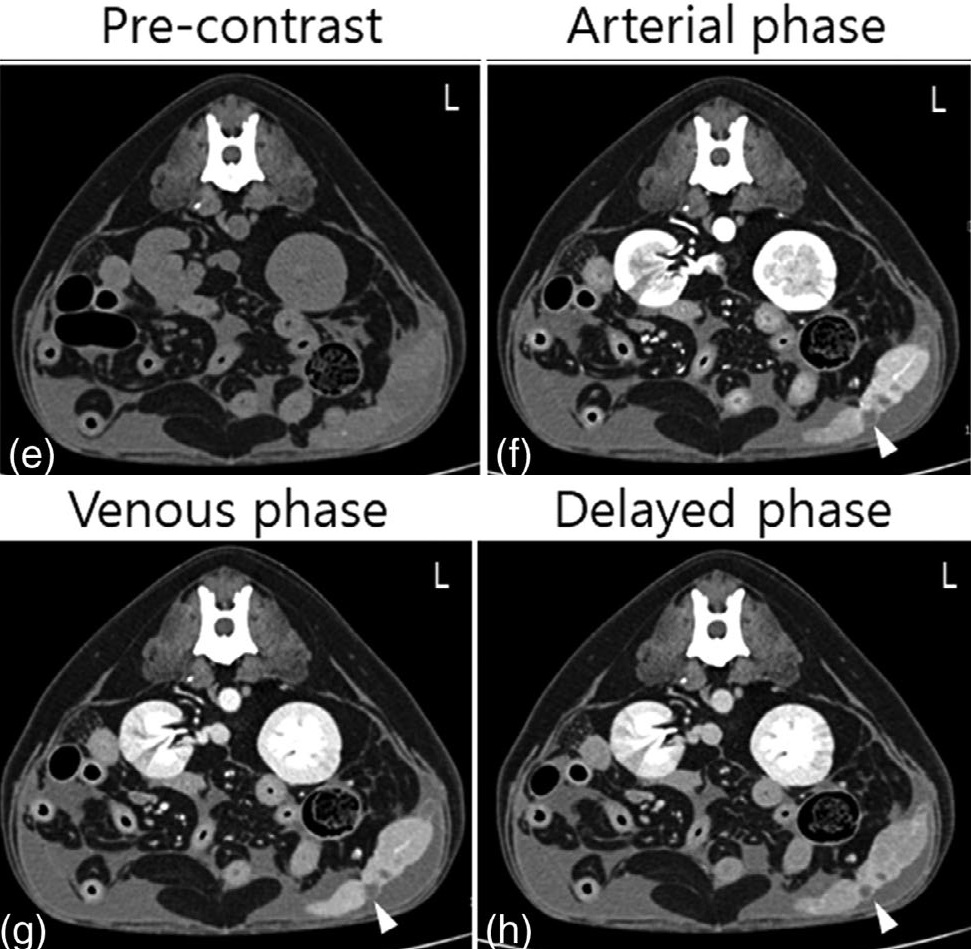
在右侧尾腹部观察到一个巨大(88.3×46.7×76.4 mm)、无定形和轻度不均匀的软组织肿块(下图)。肿块位于膀胱和肠道之间,膀胱受压并向左侧移位。观察到周围造影剂增强,但肿块实质未见任何增强(造影前后均为25 HU)。
肿块与其他器官之间未发现任何联系。在动脉和静脉相位图像上观察到连接脾门和右侧尾腹肿块的线性结构,该结构被认为是肿块的供血血管。然而,由于对比度增强不明显,很难对该结构进行评估(下图)。
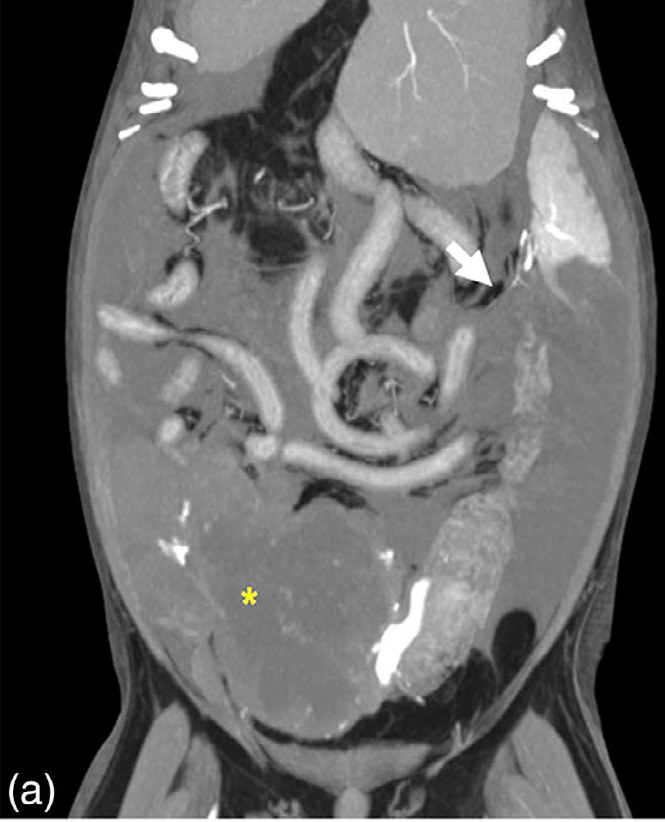
第一次CT扫描3天后进行了第二次CT扫描,以评估被认为是肿块供血血管的线性结构。在腹腔动脉处进行了试验性栓塞扫描,以显示脾动脉。使用与第一次CT扫描相同的设置进行动脉期CT扫描,并获得重建图像。第二次动脉期CT显示,供血动脉源于脾动脉,并延伸至右侧尾腹部的肿块(下图)。因此,肿块疑似来自副脾,但不排除脾脏破裂或肠系膜新生血管肿块移位的可能。

03 预后
主人拒绝了进一步的检查和治疗,CT检查后一周因持续嗜睡和贫血死亡。
04 尸检
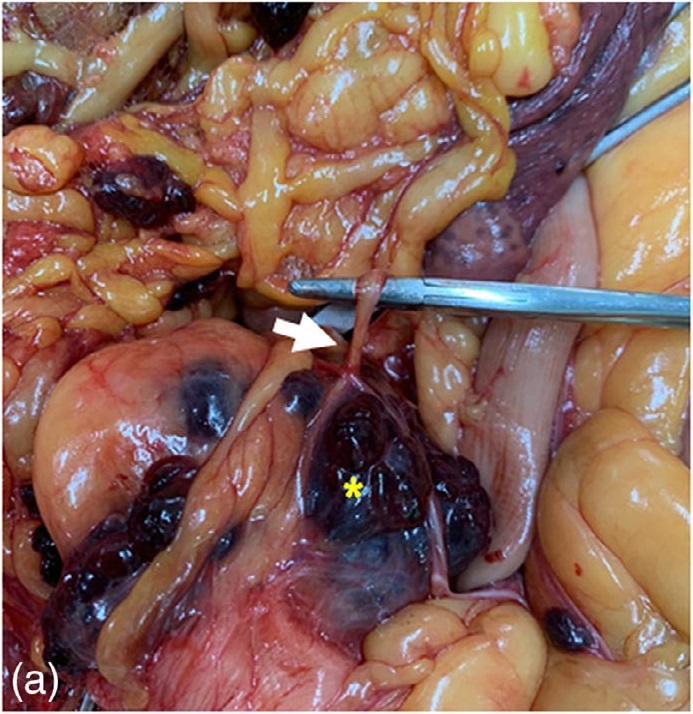
征得主人同意后对患者进行了尸检。大体上看,脾脏表面有多个肿块,但没有明显破裂。在右侧尾腹部发现一个充血肿块,通过血管与脾门相连(下图)。肿块位于膀胱前方,周围有肠系膜脂肪。整个腹壁、网膜和肠系膜都有多个结节。
血栓素和伊红染色显示,充血的肿块含有正常脾脏成分,即小梁、白髓和红髓,表明这是一个由脾脏滋养的副脾。然而由于严重充血和出血,总体结构明显扭曲,并被肿瘤病灶完全取代(下图)。
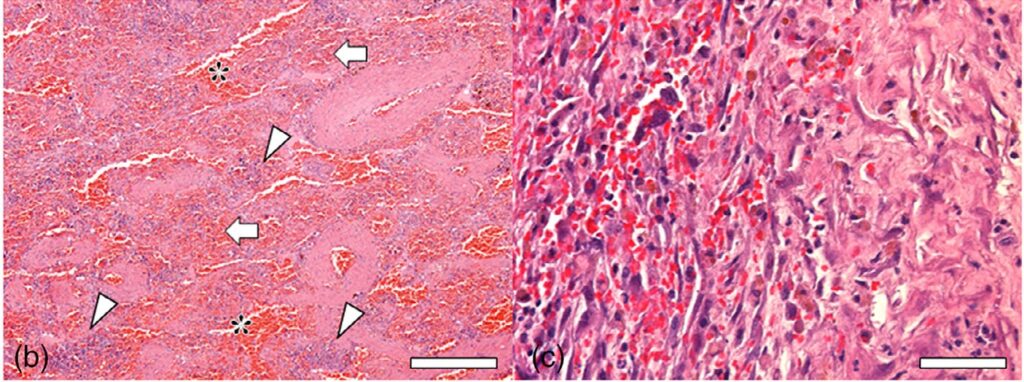
新形成的血管呈毛细血管状生长,腔内有红细胞。一些肿瘤细胞形成小的针状或吻合腔。肿瘤性内皮细胞具有高度侵袭性和多形性,细胞呈圆形至多面体,具有中度嗜酸性胞质和空泡核,通常没有明显的核仁。表现出严重的异形细胞增多和异形核分裂,整个病灶中发现大量有丝分裂图形。在脾脏和腹壁结节中也发现了相同类型的肿瘤细胞,因此诊断为脾脏和副脾血管肉瘤伴腹腔转移。
05 讨论
鉴于副脾主要位于脾门,该位置出现的肿块可能就是副脾[1]。但副脾可位于腹部的任何位置。例如,人类的副脾可能位于胰腺、盆腔、胃、肠系膜和大网膜[2-4]。
因此,即使肿块远离脾脏,也可能是副脾,所以确定肿块的来源非常重要。本病例报告描述了一只犬右侧尾腹部副脾肉瘤的CT血管造影特征,以及CT血管造影在确定副脾起源方面的作用。
如果肿块与其他腹部器官之间没有联系,就很难确定肿瘤的来源,本病例就是如此。因此,确定肿块的供血血管对评估肿瘤来源非常重要。在本病例中,使用试验性栓塞三相CT扫描两次对血管进行评估。在第二次CT扫描时,在腹腔动脉水平进行了试验性栓塞扫描,从而对肿块的脾动脉分支供血血管进行了造影剂增强。这些结果表明,动态CT的扫描延迟应根据需要评估的血管进行调整。应在感兴趣的血管处进行试验性栓塞扫描或跟踪[5,6]。
人类的大多数副脾都由脾动脉供血。因此,使用三相CT识别供血血管是副脾的诊断标准[3]。然而,正如之前的一项研究通过三相CT证实的那样[7],人类的一些副脾是由左胃十二指肠动脉供应的。以往还没有关于犬副脾由左胃十二指肠动脉供血的报道,但如果肿块由该动脉供血,且与其他腹部器官没有联系,则可将副脾作为一个鉴别诊断。
在本病例中,通过CT确定的脾脏供血血管有助于确定副脾的来源。然而,与脾动脉相连并不总是意味着副脾,因为除了副脾以外,脾动脉也可能与肿瘤一起发生侧支血管[8]。
在之前的人类研究中,发现脾动脉可供应肝脏和胰腺肿瘤[9]。然而在犬身上,还没有肠系膜肿瘤由脾动脉供应的报道,因此,本病例中与脾脏相连的右侧尾腹肿块主要被认为是副脾肿瘤。鉴于肠系膜肿瘤一般受肠系膜血管的供应[10],如果肠系膜内的肿瘤接受脾动脉的供应,则可怀疑是副脾。
异位脾组织可能来自于脾肿大,这通常与外伤或手术有关。副脾包含组织学上正常的脾脏组织,并由脾动脉供血,与之相比,脾肿大具有不同的显微结构,并由邻近组织供血[11,12]。这些特点使得可通过CT血管造影对脾脏病变进行一定程度的鉴别。在本病例中,由于尾腹部肿块有脾组织,且CT证实血流由脾动脉供应,因此认为非典型副脾的可能性大于脾肿大。
总之,这是一个罕见病例,因为血管肉瘤发生在位于尾腹部的副脾,而不是典型的脾门位置。使用三相CT识别源自脾动脉的供血动脉可能是诊断位置不典型的副脾肿瘤的关键。
参考文献
[1] Rossi, F., Rabba, S., Vignoli, M., Haers, H., Terragni, R., & Saunders, J. H. (2010). B-mode and contrast-enhanced sonographic assessment of accessory spleen in the dog. Veterinary Radiology & Ultrasound: The Official Journal of the American College of Veterinary Radiology and the International Veterinary Radiology Association, 51(2), 173–177.
[2] Bertolini, G. (2017). The peritoneal cavity, retroperitoneum, and abdominal wall. In Bertolini G. (Ed.), Body MDCT in small animals (1st ed., pp. 237–241). Springer International Publishing.
[3] Cowles, R. A., & Lazar, E. L. (2007). Symptomatic pelvic accessory spleen. American Journal of Surgery, 194(2), 225–226.
[4] Yang, B., Valluru, B., Guo, Y. R., Cui, C., Zhang, P., & Duan, W. (2017). Significance of imaging findings in the diagnosis of heterotopic spleen‐an intrapancreatic accessory spleen (IPAS): Case report. Medicine, 96(52), e9040.
[5] Cassel, N., Carstens, A., & Becker, P. (2013). The comparison of bolus tracking and test bolus techniques for computed tomography thoracic angiography in healthy beagles. Journal of the South African Veterinary Association, 84(1), E1–E9.
[6] Lee, S. K., Yoon, S., Kim, C., & Choi, J. (2019). Triple-phased mesenteric CT angiography using a test bolus technique for evaluation of the mesenteric vasculature and small intestinal wall contrast enhancement in dogs. Veterinary Radiology & Ultrasound: The Official Journal of the American College of Veterinary Radiology and the International Veterinary Radiology Association, 60(5), 493–501.
[7] Ota, H., Ojima, Y., Sumitani, D., & Okajima, M. (2016). Dynamic computed tomography findings of an accessory spleen in the pelvis: A case report. Surgical Case Reports, 2(1), 23.
[8] Kim, H. C., Chung, J. W., Lee, W., Jae, H. J., & Park, J. H. (2005). Recognizing extrahepatic collateral vessels that supply hepatocellular carcinoma to avoid complications of transcatheter arterial chemoembolization. Radiographics: A Review Publication of the Radiological Society of North America, Inc, 25(Suppl 1), S25–S39.
[9] Moon, J. H., Kim, E. K., Khang, A. R., Kim, H. C., Jang, J. Y., & Cho, Y. M. (2015). An insulinoma with an aberrant feeder from the splenic artery detected by super‐selective arterial calcium stimulation with venous sampling. The Korean Journal of Internal Medicine, 30(1), 118–121.
[10] Ichikawa, Y., Maeda, T., Mizojiri, G., Ishikawa, S., Hagi, T., Hattori, K., & Oka, H. (2017). A mesenteric solid tumor with unusual features in a young male: A case report. Molecular and Clinical Oncology, 7(3), 355–358.
[11] Mohammadi, S., Hedjazi, A., Sajjadian, M., Ghrobi, N., Moghadam, M. D., & Mohammadi, M. (2016). Accessory spleen in the splenic hilum: A cadaveric study with clinical significance. Medical Archives (Sarajevo, Bosnia and Herzegovina), 70(5), 389–391.
[12] Yildiz, A. E., Ariyurek, M. O., & Karcaaltincaba, M. (2013). Splenic anomalies of shape, size, and location: Pictorial essay. The Scientific World Journal, 2013, 321810.