
| 一般情况 | |
|---|---|
 | 品种:拉布拉多犬 |
| 年龄:3个月 | |
| 性别:雄 | |
| 是否绝育:否 | |
| 诊断:神经源性肺水肿 | |
01 主诉及病史
咬断一根家用电线(低压交流电110 V)后瞬间失去知觉。自行恢复后仍然情绪激动,事故发生后30分钟内就医。
02 检查
呈正位,对刺激反应小。瞳孔散大、唾液分泌过多、口腔有灰色伤口且周围有红斑(疑似电击所致)。
中度呼吸困难,表现为呼吸急促(49 bpm)、外周血氧饱和度降低(SpO2 92%)和潮气末二氧化碳增加(EtCO2 48 mmHg)。其余参数均正常(心率 132次/分,平均动脉压120/80 mmHg,毛细血管再充盈时间< 2秒,直肠温度38.5°C)。
站立姿势进行超声检查,腹部及胸部超声均无异常,但肺部超声显示“湿肺”弱阳性(≤3条B线)(下图)。
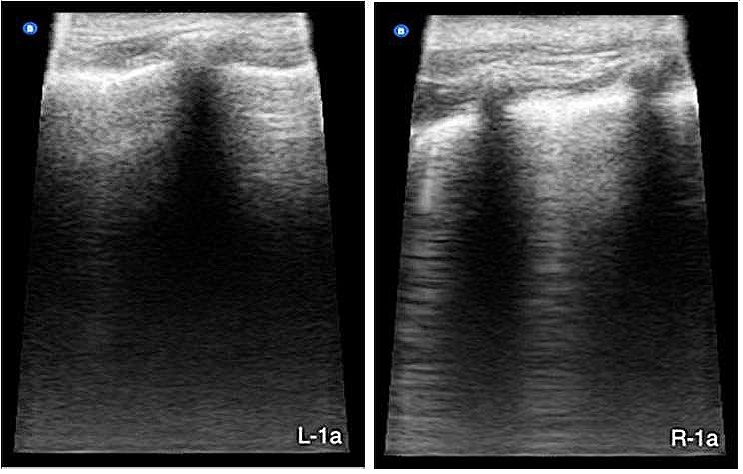
通过鼻导管补充氧气(2.5 L/min),但30分钟后病情恶化,出现紫绀、呼吸频率加快(84 bpm)、严重低氧血症(SpO2 80%)和高碳酸血症(EtCO2 51 mmHg)。
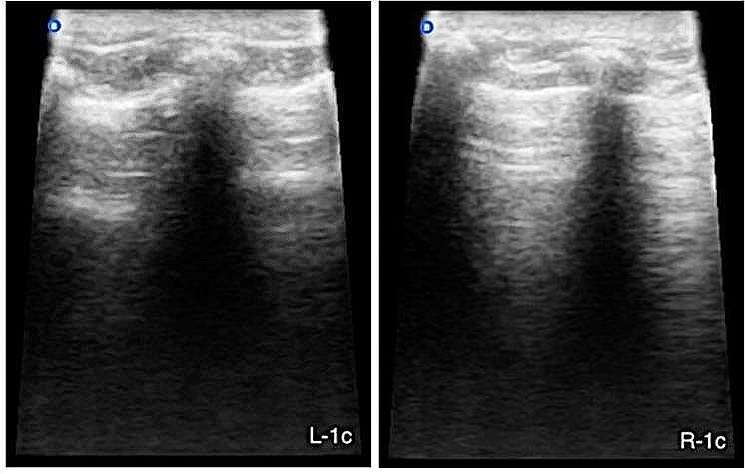
第二次站立超声检查显示“湿肺”强阳性(>3条B线)(下图),无心脏异常,符合非心源性肺水肿。由于患者呼吸状况急剧恶化,建议患者进行机械通气。
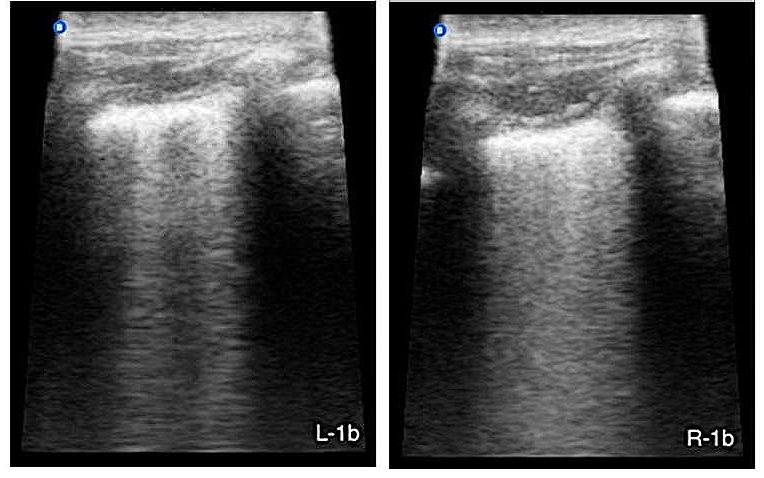
03 治疗
用丙泊酚(1 mg/kg/min)静脉注射诱导麻醉,并用丙泊酚(0.1 mg/kg/min)、氯胺酮(0.3 mg/kg/min)和罗库洛铵(0.2 mg/kg/小时)静脉注射维持麻醉。
将患者置于仰卧位,以容量控制通气模式启动保护性机械通气方案,直至 EtCO2≤40 mmHg(下表)。
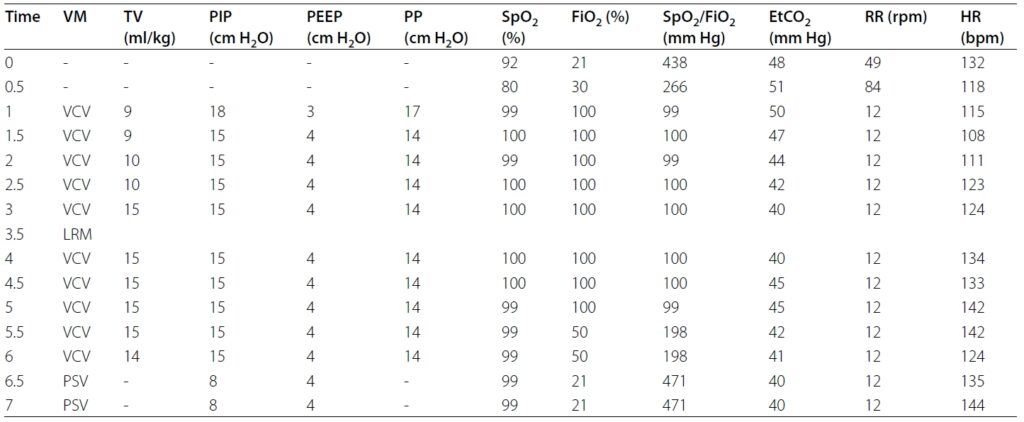
然后在压力控制通气模式下进行了30分钟的逐步肺复张操作,吸气峰压(PIP)和呼气末正压(PEEP)分别从15和3 cmH2O逐步增加到20和10 cmH2O(下表)。
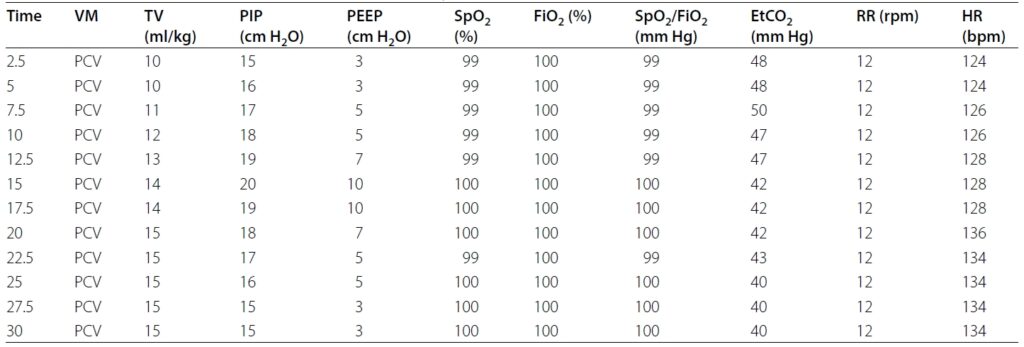
随后通气模式恢复为容积控制通气,直到吸入氧分数(FiO2)为50%、SpO2保持≥96%。之后,停止神经肌肉阻滞药(罗库洛铵)以恢复自主呼吸,并切换到压力支持通气模式,直到实现充分的气体交换(SpO2/FiO2≥300 mmHg)。
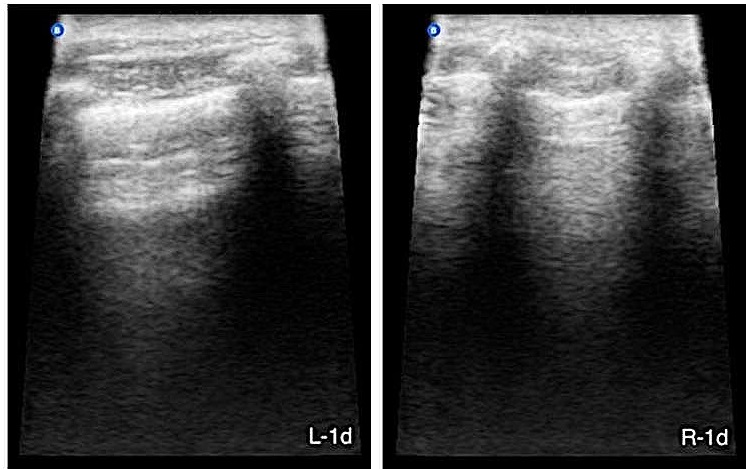
此时,新的超声评估显示肺部情况明显好转,“湿肺”为阴性(0条B线),机械通气6小时后成功解除(下图)。患者从麻醉中顺利恢复,没有出现呼吸系统并发症。
04 预后
在接下来的48小时里,患者被送入重症监护室住院治疗,并通过鼻导管补充氧气(2.5 L/min),同时接受呋塞米(2 mg/kg q8h)、美洛昔康(第一天0.2 mg/kg q24h,后一天0.1 mg/kg q24h)、奥美拉唑(0.7 mg/kg q24h)、N-乙酰半胱氨酸(30 mg/kg q8h)和氨苄西林/舒巴坦(22 mg/kg q8h)。
病情逐渐好转,72小时后出院。家庭护理包括休息和监测神经或呼吸系统症状,口服N-乙酰半胱氨酸(30 mg/kg q12h)及阿莫西林/克拉维酸(22 mg/kg q12h)连续五天。
复查超声没有发现明显的肺部病变(下图),主人报告已完全康复,没有留下后遗症。
05 讨论
电击伤是一种复杂的外伤形式,在兽医学中通常具有较高的发病率和死亡率[1]。很多文献描述了农场和野生动物因高压电线或雷击事故而死后的现场发现[2-5]。伴侣动物的低压触电事故鲜有报道,尽管家庭环境中充满了电气设备,意外伤害的可能性始终存在。这一点对幼犬尤为重要,因为它们具有探索的天性,更容易啃咬电线[6]。
人类的记录更为广泛,大多数儿童触电发生在家中,原因是口腔接触低压电线[7-9]。由于湿润的粘膜电阻减小和体内含水量高,电流更容易通过,因此低电压会对咀嚼电线的婴儿造成严重伤害[10]。
神经源性肺水肿(NPE)是一种未被充分认识和诊断的肺部损害形式,可发生在中枢神经系统损伤之后[11]。NPE相关死亡率很高,但如果处理得当,通常可以迅速恢复[12]。继发于电击的NPE是一种在严重到需要机械通气的儿童中出现的综合征[13,14]。肺保护性机械通气可降低急性呼吸窘迫患儿的死亡率[15]。
在兽医领域,尽管急救和重症监护技术不断进步,但接受机械通气的患者的总死亡率仍然很高,从61%到78%不等[16-18]。文献将触电列为NPE的可能病因之一[19-21],但既往还没有关于小动物意外触电后通过机械通气成功治疗NPE的病例报告。
由于继发于触电的肺水肿可导致严重的并发症,甚至导致幼犬死亡[22,23],因此兽医必须更好地描述这种病症的临床特征。本研究描述了对一只因意外触电而患上NPE的幼犬的治疗,采用了超声检查进行诊断,并结合逐步肺复张手法进行了肺保护性机械通气,使患者获得了成功的治疗。
虽然NPE在伴侣动物中被描述为危及生命的疾病,但目前还没有针对这种疾病的特效疗法,治疗的主要方法是去除诱因和支持性护理[20,21]。更具体的人类治疗方案包括肺保护性机械通气,以改善NPE继发的低氧血症,同时避免额外的肺损伤。
然而,保护性机械通气可能具有挑战性,因为需要低潮气量通气和可能导致的高碳酸血症,这可能会加重临床症状[11]。由于肺部病变而需要进行肺保护性机械通气的犬,传统上接受的潮气量比健康犬低,但潮气量可能比一般推荐的肺保护策略更宽泛,从10.15到14.96 mL/kg不等。
人类和犬之间的差异可能是由于犬的基础代谢和生理死腔更大,这可能解释了更大的CO2代谢产生,并证明了使用更大潮气量以避免CO2过度积累的合理性[29,30]。
总之,肺水肿是犬意外触电的一种不常见但可能危及生命的并发症。病史、临床症状和影像学诊断结果都表明肺水肿是由神经系统介导的。电击诱发中枢神经系统损伤后呼吸状况迅速恶化的患者应考虑NPE。
重症监护兽医必须熟悉这种情况的处理方法,以便在急诊服务中更好地做出决策。此外,在兽医的日常巡诊中,应告知宠物主人在家庭环境中预防触电事故的重要性,尤其是幼犬和幼猫。
文献来源:Díaz EA, Sáenz C, Torres D, Silva A, Segnini G. Successful management of pulmonary edema secondary to accidental electrocution in a young dog. BMC Vet Res. 2024 Apr 19;20(1):145.
参考文献
1. Schulze C, Peters M, Baumgärtner W, Wohlsein P. Electrical injuries in animals: causes, pathogenesis, and morphological findings. Vet Pathol. 2016;53(5):1018–29.
2. Gomes C. Lightning safety of animals. Int J Biometeorol. 2012;56(6):1011–23.
3. Vanneste E, Weyens P, Poelman DR, Chiers K, Deprez P, Pardon B. Lightning related fatalities in livestock: veterinary expertise and the added value of lightning location data. Vet J. 2015;203(1):103–8.
4. Kagan RA. Electrocution of raptors on power lines: a review of necropsy methods and findings. Vet Pathol. 2016;53(5):1030–6.
5. Pereira AA, Dias B, Castro SI, Landi MF, Melo CB, Wilson TM, Costa GR, Passos PH, Romano AP, Szabó MP, Castro MB. Electrocutions in free-living black-tufted marmosets (Callithrix penicillata) in anthropogenic environments in the Federal District and surrounding areas. Brazil Primates. 2020;61(2):321–9.
6. Mann FA. Electrical and lightning injuries. In: Drobatz KJ, Hopper K, Rozanski EA, Silverstein DC, editors. Textbook of small animal emergency medicine. 1. River Street: Hoboken NJ; 2018. pp. 956–61.
7. Waldmann V, Narayanan K, Combes N, Marijon E. Electrical injury. BMJ. 2017;357:1418.
8. Yeroshalmi F, Sidoti EJ Jr, Adamo AK, Lieberman BL, Badner VM. 2011. Oral electrical burns in children—a model of multidisciplinary care. J Burn Care Res. 2011;32(2):e25-e30.
9. Pontini A, Reho F, Giatsidis G, Bacci C, Azzena B, Tiengo C. Multidisciplinary care in severe pediatric electrical oral burn. Burns. 2015;41(3):e41–6.
10. Koumbourlis AC. Electrical injuries. Crit Care Med. 2002;30(11):424–30.
11. Busl KM, Bleck TP. Neurogenic pulmonary edema. Crit Care Med. 2015;43(8):1710–5.
12. Baumann A, Audibert G, McDonnell J, Mertes PM. (2007). Neurogenic pulmonary edema. Acta Anaesthesiol Scand. 2007;51(4):447–455.
13. Singh S, Sankar J, Dubey N. Non-cardiogenic pulmonary oedema following accidental electrocution in a toddler. Case Rep. 2011;bcr0120113749.
14. Chawla G, Dutt N, Niwas R, Chauhan NK, Sharma V. A rare case of neurogenic pulmonary edema following high-voltage electrical injury. Indian J Crit Care Med. 2019;23(10):486.
15. Wong JJM, Lee SW, Tan HL, Ma YJ, Sultana R, Mok YH, Lee JH. Lung-protective mechanical ventilation strategies in pediatric acute respiratory distress syndrome. Pediat Crit Care Med. 2020;21(8):720–8.
16. Bruchim Y, Aroch I, Sisso A, Kushnir Y, Epstein A, Kelmer E, Segev G. A retrospective study of positive pressure ventilation in 58 dogs: indications, prognostic factors and outcome. J Small Anim Pract. 2014;55(6):314–9.
17. Lemieux E, Rozanski E, Buckley G, Chalifoux N, Kennedy C, Lynch A, Rutter C, Tracy A, Silverstein DC. Indications and outcomes for puppies undergoing mechanical ventilation: 59 cases (2006 to 2020) Can Vet J. 2021;62(8):839.
18. Cagle LA, Hopper K, Epstein SE. Indications and outcome associated with positive-pressure ventilation in dogs and cats: 127 cases. J Vet Emerg Crit Care. 2022;32(3):365–75.
19. Drobatz KJ, Saunders HM, Pugh CR, Hendricks JC. Noncardiogenic pulmonary edema in dogs and cats: 26 cases (1987–1993) J Am Vet Med Assoc. 1995;206(11):1732–6.
20. Drobatz KJ. Neurogenic pulmonary edema. In: Drobatz KJ, Hopper K, Rozanski EA, Silverstein DC, editors. Textbook of Small Animal Emergency Medicine. 1. River Street: Hoboken NJ; 2018. pp. 247–52.
21. Unger K, Martin LG. Noncardiogenic pulmonary edema in small animals. J Vet Emerg Crit Care. 2023;33(2):1–17.
22. Yamamoto EY, Lavans L, Chaves RN, Fragata FS, Marcondes Santos M. 34th Congress of the World Small Animal Veterinary Association. Brazil: Sao Paulo; 2009. Pulmonary edema secondary to Electrocution in Dogs – Case Report.
23. Singh R. Electrocution in a pup: a case report. Indian J Vet Med. 2020;40(2):53–6.
24. Lisciandro GR. POCUS: global FAST–Patient monitoring and staging. In: Lisciandro GR, editor. Point-of‐Care Ultrasound techniques for the Small Animal Practitioner. 1. River Street: Hoboken NJ; 2021. pp. 683–727.
25. Oliva LR, Santos MFL, Leal GCG. Neurogenic pulmonary Edema after Electroconvulsive Therapy in 2 young patients. J ECT. 2022;38(2):20–1.
26. Lisciandro GR. Cageside ultrasonography in the emergency room and intensive care unit. Vet Clin Small Anim Pract. 2020;50(6):1445–67.
27. Lisciandro GR, Lisciandro SC. Global FAST for patient monitoring and staging in dogs and cats. Vet Clin Small Anim Pract. 2021;51(6):1315–33.
28. Lisciandro GR, Lisciandro SC. POCUS: vet BLUE–Clinical integration. In: Lisciandro GR, editor. Point-of‐Care Ultrasound techniques for the Small Animal Practitioner. 1. River Street: Hoboken NJ; 2021. pp. 459–507.
29. De Monte V, Bufalari A, Grasso S, Ferrulli F, Crovace AM, Lacitignola L, Staffieri F. Respiratory effects of low versus high tidal volume with or without positive end-expiratory pressure in anesthetized dogs with healthy lungs. Am J Vet Res. 2018;79(5):496–504.
30. Donati PA, Plotnikow G, Benavides G, Belerenian G, Jensen M, Londoño L. Tidal volume in mechanically ventilated dogs: can human strategies be extrapolated to veterinary patients? J Vet Sci. 2019;20(3):e21.