
| 一般情况 | |
|---|---|
 | 品种:混种犬 |
| 年龄:11岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:肠扭转及室性心率失常 | |
01 主诉及病史
1天前出现呕吐、腹泻、食欲不振和嗜睡。
2个月前曾在另一家医院进行胃扩张的术后护理以及术中出现的膈疝导致的右侧气胸治疗。除了患有骨关节炎并接受卡洛芬治疗外,没有其他疾病。
02 检查
患者安静、警觉、反应灵敏,心率升高至140-180次/分。听诊心律不齐,怀疑有心律失常。未发现心脏杂音。股动脉搏动有力,但有间歇性脉搏减弱。
触诊腹部柔软,不适症状轻微。粘膜呈粉红色,湿润,毛细血管再充盈时间小于2秒。呼吸频率升高至60次/分,听诊所有肺野均清晰,无喘息。直肠温度为38.7°C。
三导联心电图(ECG)显示频发的室性期前收缩,并伴有心肌缺血。血压为130 mmHg。
血液学分析显示,乳酸2.5 mmol/L(0.9-4.2),血细胞比容30%(37.5-55.6),白细胞18100/μl(4200-13200),中性粒细胞13300/μl(2500-8600)。血小板24,000/μl(136000-429000),人工计数估计血小板为13万。除了轻度低氯代谢性碱中毒和轻度离子性低镁血症外,其余血液分析结果均无异常。
腹部X光片证实结肠扭转,脾脏轻度弥漫性肿大。主人选择了急诊剖腹探查术。
03 手术
麻醉前静脉注射马洛比坦(1 mg/kg)和5 mL/kg/h乳酸林格氏液(LRS)。在右前肢掌动脉上方放置了多普勒血压监测仪和单导联(II)视图的三导联ECG监测仪。心率在115-160次/分之间波动,伴随着室性期前收缩的发生(下图)。检查时发现的股动脉搏动减弱也与心律失常相吻合。
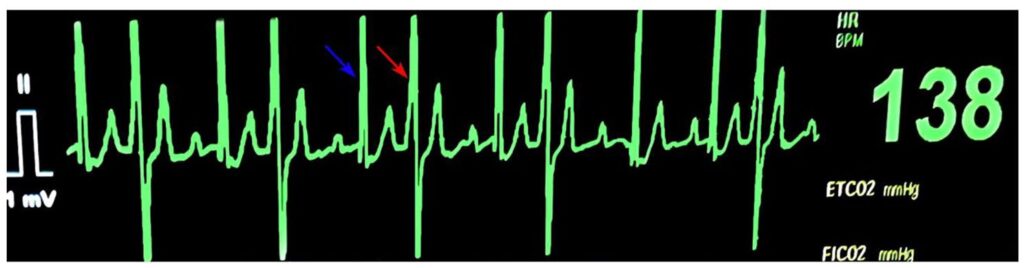
接受芬太尼(5 μg/kg)和利多卡因(2 mg/kg)静脉注射的预处理。尽管芬太尼具有拟迷走神经作用,而利多卡因是一种具有抗心律失常特性的钠通道阻滞剂,但在使用预处理药物后,心律失常没有得到改善。用氯胺酮(2 mg/kg)和丙泊酚(4 mg/kg)静脉注射进行全身麻醉,并用57 French带袖带的气管导管固定气道。
通过直接观察和潮气末二氧化碳(PECO2)的存在确认气管插管的位置。对气管导管进行检漏,使其保持在20 cmH2O的气道压力,然后将其绑扎到位。使用七氟醚在100%氧气中以1L/min(FiO2)的速度维持全身麻醉。
在左脚背动脉放置一根22号导管,用于连续测量血压。手术过程中使用多参数监护仪监测直接收缩压、舒张压和平均动脉血压、呼吸频率、心率和节律(通过第二导联心电图)、脉搏氧饱和度、食管温度、通过侧流毛细血管造影检测的PECO2和潮气末七氟醚分数。手术开始前静脉注射了5-10 μg/kg/h的恒速芬太尼、50 μg/kg/min的利多卡因和1 mg/kg/h的氯胺酮。
气管插管后,通过在20 cmH2O条件下进行人工屏气,确认血管内液体容量不足,此时胸透波幅减弱,多普勒声音变弱,脉搏更明显。此时,在10-15分钟内注射了10 ml/kg LRS静脉注射液。在对患者进行手术准备期间,对其胸部进行了超声检查,结果显示左心室和右心室主观充盈不足。胸膜或心包腔内无游离液体。
患者被送往手术室,进行术前的无菌准备,并在10-15分钟内接受了3 mL/kg的7.2%高渗盐水和3 mL/kg的6% hetastarch静脉注射,随后又接受了10 mL/kg的LRS静脉注射。
在接受了额外的液体治疗后,患者的心率降至110-120次/分,室性心率失常缓解为以窦性心律为主,偶有/罕见的单次室性期前收缩,脉搏质量也得到了改善。液体复苏后,平均动脉压从105 mmHg降至60-70 mmHg,这可能是由于代偿性休克的血流动力学改善所致,并在麻醉过程的剩余时间内维持在这一范围。
人工通气期间,在20 cmH2O的吸气压力峰值下,动脉血压或胸透波形的振幅均无明显变化。患者在剩余的手术过程中一直保持稳定,在手术结束时,随着吸入麻醉剂量的减少,患者出现了轻微的窦性心动过速。
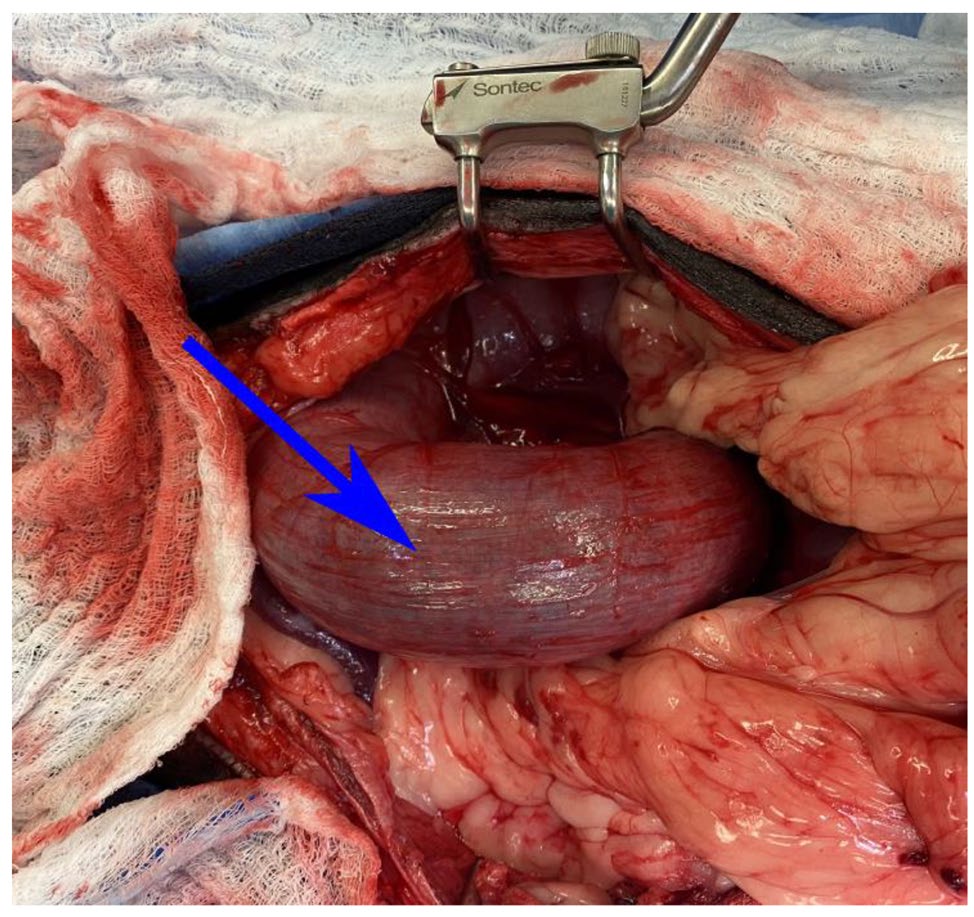
手术中进行了腹正中开腹,发现了一个膨胀的结肠(下图),顺时针方向将结肠旋转,改善了结肠的外观。在右侧胃体上发现了一个2.5×2 cm的网膜肿块和一个1.5 cm的胃钉。在进行左侧结肠切除术的同时,还进行了胃结肠切除术,并在无并发症的情况下横断了之前的右侧胃切除术。
04 预后
患者未出现并发症,继续静脉输液,每24小时静脉注射1 mg/kg马罗匹坦,每6小时静脉注射一次美沙酮(0.1 mg/kg),并持续使用监测约18小时,以监测可能出现的心律失常。
第二天早上,患者开始接受昂丹司琼(0.5 mg/kg)静脉注射,每8小时一次,并口服甲氧氯普胺(2 mg/kg/天)治疗恶心和腹泻。除了偶尔出现窦性心律失常和房性早搏外,术后未再发现心律失常。经心脏科会诊,发现有1/6级间歇性左心尖收缩期杂音。超声心动图结果显示二尖瓣微量反流,收缩功能低但正常,可能是由于最近的阻塞性休克所致。
网膜肿块的组织病理学检查显示,脂肪坏死伴有纤维化和脂肪肉芽肿性脂肪炎。
患者5天后出院。医生建议对患者进行Holter监测和随访,但主人拒绝。
05 讨论
室性心率失常是一种不常见的心律失常,在人和犬中均有发生。在人类中,室性期外收缩已被证明是心肌缺血的标志[1],在患有胃肠道梗阻性外科急症,如急性胃扩张和心肌缺血的犬中也有报道[2,3]。本病例是第一例因可能的一过性心肌缺血而导致结肠扭转犬的室性心律失常的病例。
犬的室性心律失常(如室性期前收缩)可见于原发性心脏病,如扩张型心肌病或致律性右室心肌病。然而,室性期前收缩也可能与心肌缺血、电解质紊乱、服药(巴比妥类药物)或外伤等一系列非心脏疾病有关。
特发性室性期前收缩也很常见,健康人中也会出现。室性期前收缩可有几种模式,如大颤动或三颤动,即每隔2次或3次搏动就有一次室性期前收缩[5]。大颤动的一种可能机制是缺血导致的再入室。当电脉冲因缺血损伤而分裂成两个独立的脉冲时,就会发生再入路。
由于一个脉冲因阻滞而无法传播,第二个脉冲将从相反的方向到达阻滞点。如果这种情况发生在心脏细胞的折返期之后,就会形成再入路,引发室性期前收缩[6]。有记录显示,患有潜在心肌病[7]或近期经历过急性心肌梗死[8]的人,以及患有遗传性疾病(如儿茶酚胺能多形性室性心动过速)的人都会出现室性心动过速[9]。
医生怀疑本患者出现心室大颤动的原因是血容量不足导致舒张期充盈减少、心输出量降低、冠状动脉灌注减少和急性心肌缺血。在对患者进行20 cmH2O人工屏气时,患者的胸廓测量有明显变化,同时还伴有听诊和触诊脉搏障碍,这证实了患者存在低血容量。
在人类文献中,机械通气患者的动脉血压和胸透波形变化已被证明是低血容量的敏感指标[10-12]。脉压变异是一个依赖于前负荷的动态变量,它来自于机械通气过程中胸内压变化引起的动脉压波形变化[13]。脉搏血氧饱和度变异指数是从脉搏血氧饱和度波形波动中获得的一种无创前负荷依赖变量,可用于识别液体反应性[13,14]。
一项对使用七氟醚麻醉并进行机械通气的健康犬进行的研究发现,与脉压变异相比,变异指数预测输液反应性的准确性适中[13]。恢复血管内容量可能会改善冠状动脉灌注,从而恢复正常窦性心律。
术后进行的超声心动图检查证实,该患者没有严重的基础心脏病,而且在室性心律失常发生之前也没有服用致心律失常药物。术前血检发现轻度低镁血症,这是导致室性心律失常的一个危险因素。
低镁血症可导致动作电位振幅和持续时间缩短以及静息膜电位降低,最终易导致自发性心率失常[15]。然而,根据患者对液体复苏的快速反应,医生怀疑导致代偿性休克和随后心肌缺血的低血容量是此次心律失常的根本原因。
犬结肠扭转是一种罕见的危及生命的外科急症[16,17]。据报道,结肠扭转和胃扩张的病例多发生在中大型犬种的幼犬和中年犬身上[16-18]。临床症状包括呕吐、嗜睡和腹痛[17,19],这与本患者的发现一致。诱发因素包括胃肠道疾病史和曾为治疗胃扩张进行过胃切除术。在一个回顾性系列研究中,6只犬中有4只曾患过胃扩张,并且在发生结肠扭转之前都接受过右侧胃切除术[17]。
总之,本病例报告强调急性心肌缺血可导致室性心律失常,而室性心律失常对液体复苏和改善冠状动脉灌注有反应。确诊为结肠扭转的患者应接受静脉输液治疗,以维持血管内和冠状动脉灌注,并在全身麻醉前、麻醉期间和麻醉后监测心电活动。
文献来源:Rubini S, Rubini R, Bertocchi S, Zordan S, Magri A, Barsi F, Sampieri M, Locatelli CA, Baldini E, Manfredini S, Vertuani S. A case of severe benzalkonium chloride intoxication in a cat. Acta Vet Scand. 2024 Apr 15;66(1):18.
参考文献
1. Channer K, Morris F. ABC of clinical electrocardiography myocardial ischaemia. Br Med J. 2002;324:1023–6.
2. Schwartz PJ, Stone HL. Left stellectomy in the prevention of ventricular fibrillation caused by acute myocardial ischemia in conscious dogs with anterior myocardial infarction. Circulation. 1980;62(6 I):1256–65.
3. Manev I. Cardiac arrhythmias in gastric dilatation-volvulus. Tradit Mod Vet Med. 2021;6(1):40–3.
4. Atlee JL, Roberts FL. Thiopental and epinephrine-induced dysrhythmias in dogs anesthetized with enflurane or isoflurane. Anesth Analg. 1986;65(5):437–43.
5. Estrada A, Pariaut R. Clinical small animal internal medicine. In: Bruyette D, editor. Clinical small animal Internal Medicine. First. Wiley-Blackwell; 2020. pp. 199–200.
6. Langendorf R, Pick A, Winternitz M. Mechanisms of intermittent ventricular bigeminy. I. Appearance of ectopic beats dependent upon length of the ventricular cycle, the rule of bigeminy. Circulation. 1955;11(3):422–30.
7. O’Shaughnessy SM, Leonard I. Peri-operative ventricular bigeminy and cardiomyopathy in elective surgery. Anesth Rep. 2019;7(1):53–6.
8. Moss AJ, Schnitzler R, Green R, Decamilla J. Ventricular arrhythmias 3 weeks after acute myocardial infarction. Ann Intern Med. 1971;75(6):837–41.
9. Matsumura T, Hosokawa S, Hanaoka M, Abe Y, Iwamoto T, Maeda S. Transient ventricular bigeminy during emergence from general anesthesia in a pediatric patient with catecholaminergic polymorphic ventricular tachycardia. J Electrocardiol. 2022;73(May):38–41.
10. Pizov R, Eden A, Bystritski D, Kalina E, Tamir A, Gelman S. Arterial and plethysmographic waveform analysis in anesthetized patients with hypovolemia. Anesthesiology. 2010;113(1):83–91.
11. Shamir M, Eidelman LA, Floman Y, Kaplan L, Pizov R. Pulse oximetry plethysmographic waveform during changes in blood volume. Br J Anaesth. 1999;82(2):178–81.
12. Ornstein E, Eidelman LA, Drenger B, Elami A, Pizov R. Systolic pressure variation predicts the response to acute blood loss. J Clin Anesth. 1998;10(97):137–40.
13. Endo Y, Kawase K, Miyasho T, Sano T, Yamashita K, Muir WW. Plethysmography variability index for prediction of fluid responsiveness during graded haemorrhage and transfusion in sevoflurane-anaesthetized mechanically ventilated dogs. Vet Anaesth Analg. 2017;44(6):1303–12.
14. Cannesson M, Desebbe O, Rosamel P, Delannoy B, Robin J, Bastien O et al. Pleth variability index to monitor the respiratory variations in the pulse oximeter plethysmographic waveform amplitude and predict fluid responsiveness in the operating theatre. Br J Anaesth. 2008;101(2):200–6.
15. da Silva JF. In: Willis R, Oliveira P, Mavropoulou A, editors. Guide to canine and feline electrocardiography. First. Volume 252. Wiley; 2018. p. 324.
16. Gremillion CL, Savage M, Cohen EB. Radiographic findings and clinical factors in dogs with surgically confirmed or presumed colonic torsion. Vet Radiol Ultrasound. 2018;59(3):272–8.
17. Gagnon D, Brisson B. Predisposing factors for colonic torsion/volvulus in dogs: a retrospective study of six cases (1992–2010) J Am Anim Hosp Assoc. 2013;49(3):169–74.
18. Halfacree ZJ, Beck AL, Lee KCL, Lipscomb VJ. Torsion and volvulus of the transverse and descending colon in a German shepherd dog. J Small Anim Pract. 2006;47(8):468–70.
19. Bentley AM, O’Toole TE, Kowaleski MP, Casale SA, McCarthy RJ. Volvulus of the colon in four dogs. J Am Vet Med Assoc. 2005;227(2):2–5.