
| 一般情况 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:9岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:肥厚型心肌病 | |
01 主诉及病史
1年前被诊断患有肥厚型心肌病。1个月前由于左心室流出道梗阻恶化,开始每日口服阿替洛尔(6.25 mg/次,q12h)。1日前因呼吸困难就诊,根据胸片检查结果怀疑出现肺水肿,皮下注射了呋塞米(2 mg/kg)。
02 检查
入院时呼吸急促,呼吸频率60次/分,心率176次/分,收缩压110 mmHg。心脏听诊显示左胸骨旁收缩期杂音III/VI级。
胸部侧位和背腹位X光片显示心脏肿大,椎心评分10分。发现轻微的肺间质形态,比前一天有所减轻。
超声显示左心房增大,伴有自发性回声对比和心房压力升高,左心室同心性肥大,收缩功能保留。
03 治疗
接受了呋塞米(第1天1 mg/kg,IV q8h,之后减至1 mg/kg,IV q12h)、氯吡格雷(18.75 mg,PO q24h)、阿替洛尔(6.25 mg,PO q12h)、马罗匹坦(1 mg/kg,IV q24h)和米氮平(2 mg,透皮 q24h)治疗。
第2天症状有所改善,并进行了全面的超声心动图和心电图检查。超声心动图显示左心室对称性增厚,收缩功能保留,左心房严重扩张,回声对比呈阳性。透射道血流显示舒张早期波和舒张晚期波融合,由于二尖瓣收缩期前移,左室流出道血流呈匕首状。超声心动图诊断为肥厚型心肌病伴左室流出道梗阻。
心电图显示窦性心律,QRS形态正常,PQ间期正常,心率170 bpm(下图)。
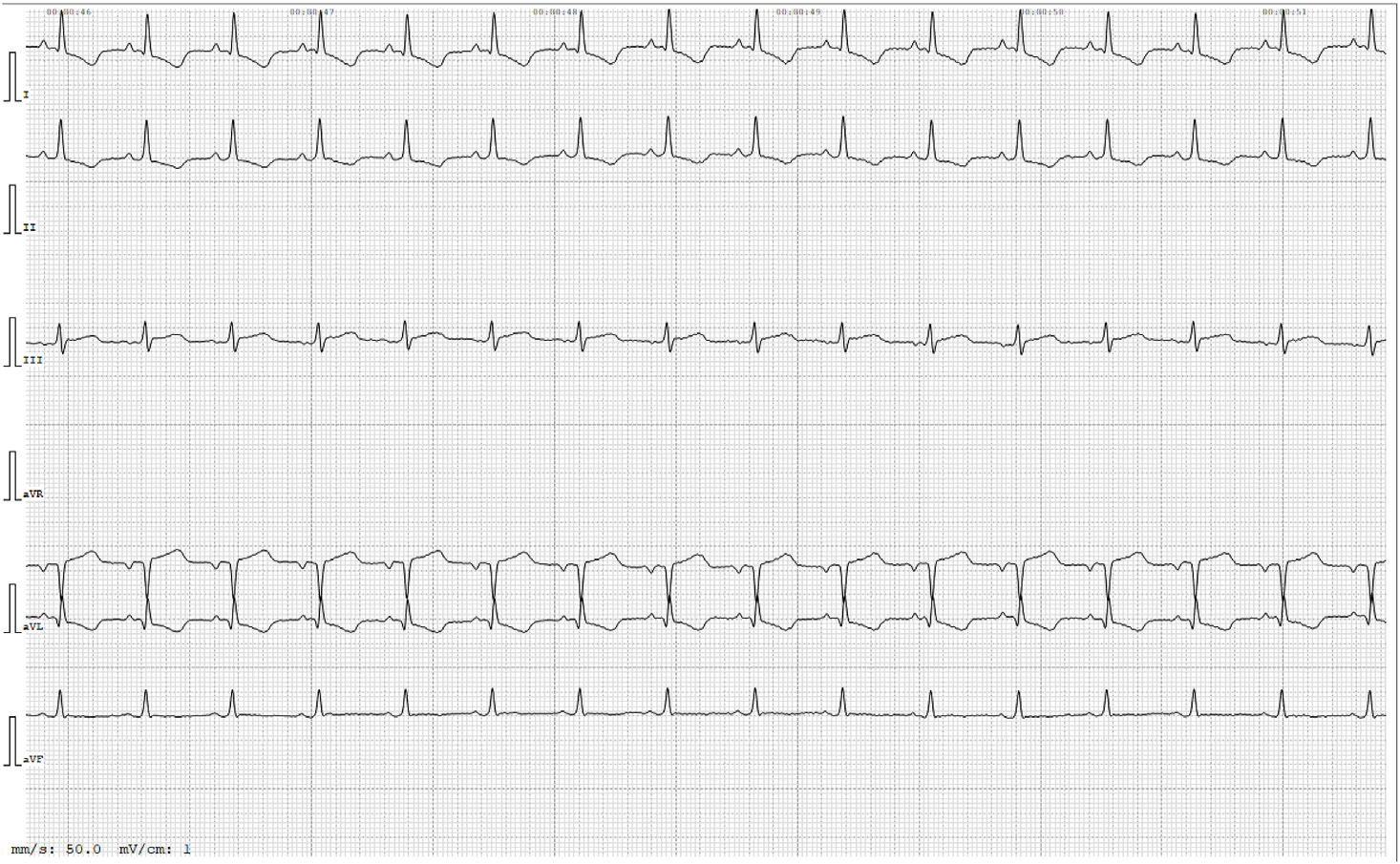
次日出院,在家中继续使用呋塞米(1 mg/kg,PO q24h)、阿替洛尔(6.25 mg,PO q12h)、氯吡格雷(18.75 mg,PO q24h)和米氮平(2 mg,透皮 q24h)。
04 复查
1周后复查。主人报告说猫昏昏欲睡,身体虚弱,呼吸频率正常,食欲减退。心脏听诊显示心动过缓,心率85次/分。
心电图显示心律规则,QRS波群狭窄,ST段内出现P′波。P′平均电轴为-40°,表明心室传导为偏心1:1。诊断结果为逸出性交界性心律,心房逆向传导继发于三度窦房传导阻滞或窦性停搏(下图)。
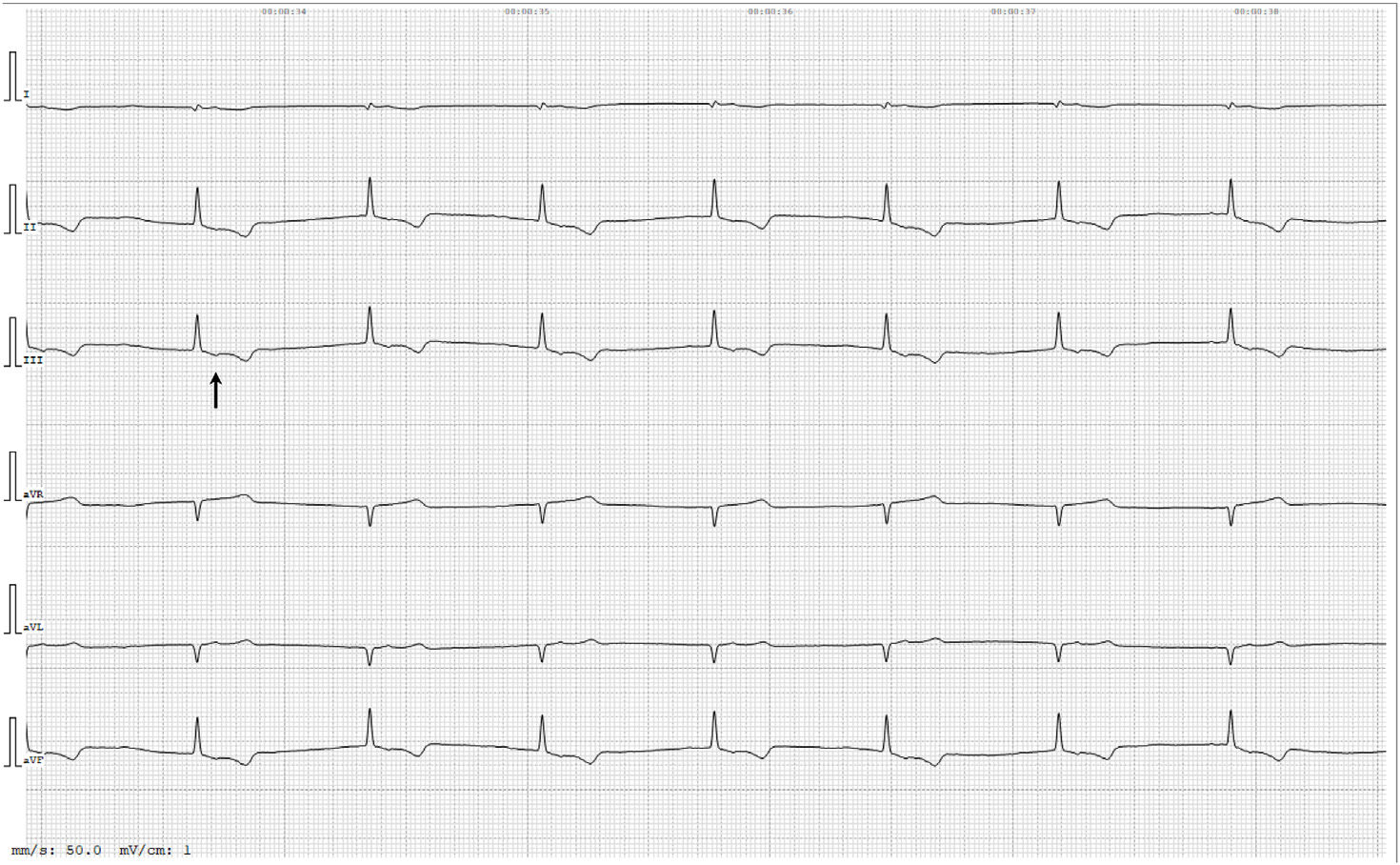
由于怀疑米氮平和阿替洛尔之间的相互作用会导致不良反应,因此停用了米氮平。3后复查,由于心率持续为80次/分的交界性心律,阿替洛尔被减量至每天一次。临床状况逐渐好转,并开始正常进食。
10天后复查,心电图显示窦性心律,心率正常(下图)。阿替洛尔的用量恢复为每天2次,在随后的复查中,记录到了窦性心律。
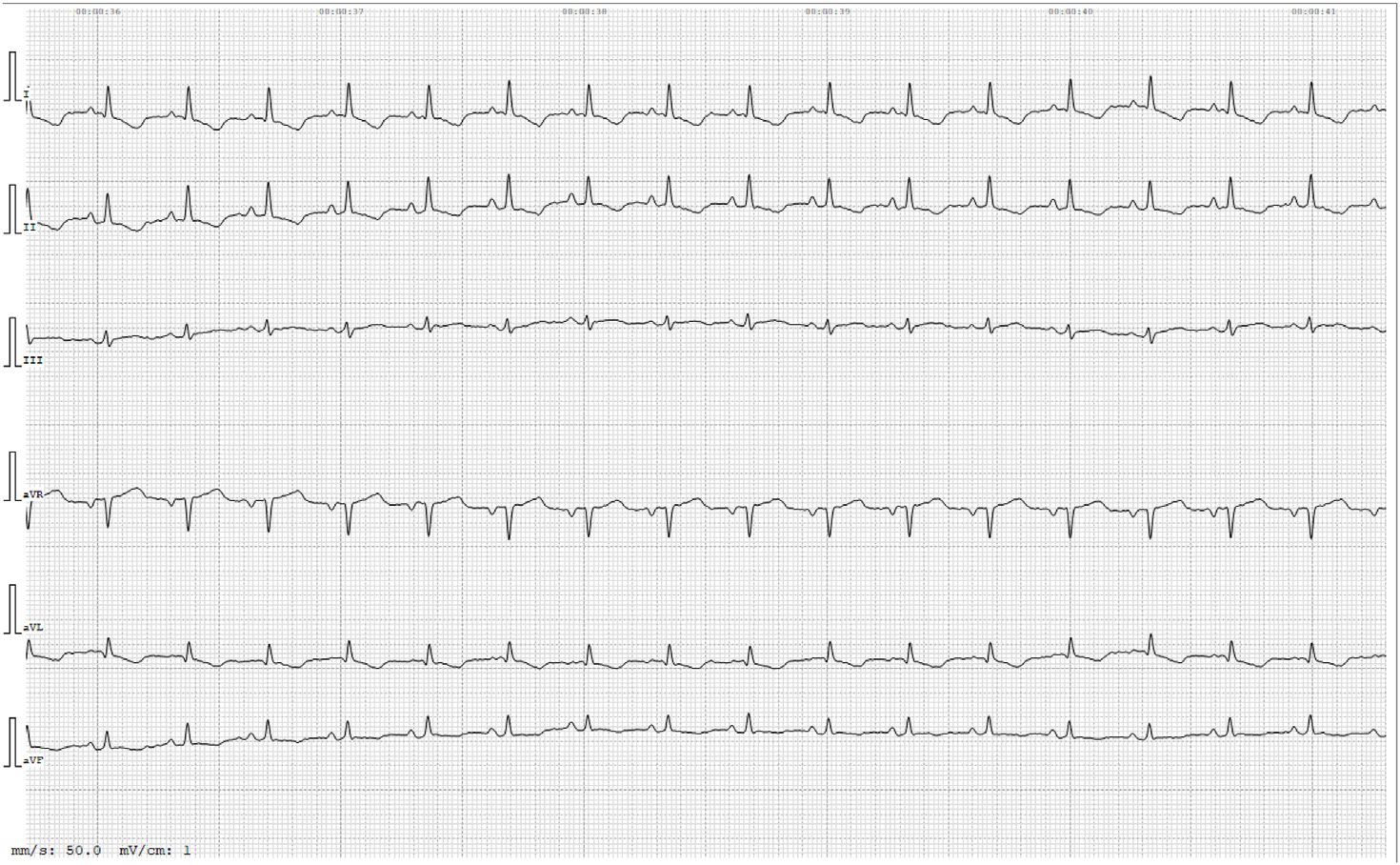
05 讨论
本报告描述了一例因同时服用阿替洛尔和米氮平而继发的严重症状性心动过缓猫病例。
阿替洛尔是第二代β-肾上腺素能拮抗剂,可选择性地与血管平滑肌和心脏中的β-1肾上腺素能受体结合,抑制交感神经刺激。这种活性可诱导负性肌力和慢性肌力效应,降低心率、血压和心肌收缩力。
阿替洛尔通常用于亚临床肥厚型心肌病猫,其益处包括降低心率、增加心室充盈时间、减少心肌需氧量、防止心律失常以及减少左心室流出道动态阻塞[1]。然而,该药对猫长期存活的有利影响却从未在猫身上出现过[2]。
米氮平源自四环类抗抑郁药,属于去肾上腺素能和特异性血清素能抗抑郁药[3]。由于具有止吐和刺激食欲的特性,它常用于兽医领域[4-6]。米氮平是一种突触前 α2-肾上腺素能受体拮抗剂,它通过阻断突触前抑制受体来增加去甲肾上腺素能和血清素能的神经传递,从而导致去甲肾上腺素释放到突触间隙的增加,并因此增加突触后的可用性。去甲肾上腺素的这种净增加可能是其刺激食欲作用的原因。
血清素能效应是通过5-羟色胺(5-HT)1受体样活性和去甲肾上腺素对血清素能传递的增强作用产生的。米氮平还能拮抗5-HT2受体,从而通过下丘脑内的核团刺激食欲。米氮平对5-HT3受体的拮抗作用使其具有止吐和反胃的特性。
由于米氮平具有血清素能活性,过量服用米氮平会导致与血清素综合征一致的严重不良反应,包括自主神经活动亢进、神经肌肉症状和精神状态改变。在患有血清素综合征的猫中,也会出现心动过速、心动过缓和高血压等心血管症状[7,8]。
抗抑郁药和β-受体阻滞剂相互作用导致的不良反应在人类医学中已有描述。有几种抗抑郁药是细胞色素P450 2D6肝酶的抑制剂,这些酶参与了某些β受体阻滞剂的代谢[9]。因此,如果同时服用抗抑郁药,会增加β-受体阻滞剂的血浆浓度,导致心律失常和低血压等心血管后果。
心动过缓是β-受体阻滞剂与抗抑郁药(如选择性5-HT再摄取抑制剂或安非他明)相互作用导致的最常见副作用,在一项针对66名人类患者的研究中就有相关报道[10]。
由于存在交界性心律和逆行性P′波,该心律的两个鉴别标准是心律起源异常(如窦性停搏)或传导障碍(如三度窦房阻滞)。这两种心律失常在体表心电图上难以区分,但是,考虑到改变治疗方法后心律失常得到缓解,传导障碍伴有窦房阻滞的可能性更大。
该病例报告强调,停用米氮平和减少阿替洛尔剂量后,传导障碍得到了缓解。但是无法确定缓慢性心律失常是由米氮平单独引起的,还是与阿替洛尔联用引起的。米氮平停药3天后复查,患者的心律失常没有改变,在减少阿替洛尔剂量10天后,患者的缓慢性心律失常才得到缓解。
不过,第一次复查时心律失常没有缓解可能是由于米氮平停药时间较短,没有完全消除药物残留。不能排除即使不改变阿替洛尔的剂量,心律失常也可能在几天后缓解的情况。
此外,也不能排除这种对心律的强烈影响可能受到肥厚型心肌病继发的心脏重塑的影响。然而,在人类健康人群中也有这种副作用的报道。因此,在同时使用这两种药物时,兽医应意识到这一潜在风险。
文献来源:Oricco S, Quintavalla C, Apolloni I, Crosara S. Bradyarrhythmia after treatment with atenolol and mirtazapine in a cat with hypertrophic cardiomyopathy. J Vet Cardiol. 2024 Mar 29;53:72-76.
参考文献
[1] V. Luis Fuentes, J. Abbott, V. Chetboul, E. Cote, P.R. Fox, J. Haggstrom, M.D. Kittleson, K. Schober, J.A. Stern. ACVIM consensus statement guidelines for the classification, diagnosis, and management of cardiomyopathies in cats. J Vet Intern Med, 34 (2020), pp. 1062-1077.
[2] K.E. Schober, J. Zientek, X. Li, V.L. Fuentes, J.D. Bonagura. Effect of treatment with atenolol on 5-year survival in cats with preclinical (asymptomatic) hypertrophic cardiomyopathy. J Vet Cardiol, 15 (2013), pp. 93-104.
[3] J.M. Kent. SNaRIs, NaSSAs, and NaRIs: new agents for the treatment of depression. Lancet, 355 (2000), pp. 911-918.
[4] W. Agnew, R. Korman. Pharmacological appetite stimulation: rational choices in the inappetent cat. J Feline Med Surg, 16 (2014), pp. 749-756.
[5] J.M. Quimby, K.F. Lunn. Mirtazapine as an appetite stimulant and anti-emetic in cats with chronic kidney disease: a masked placebo-controlled crossover clinical trial. Vet J, 197 (2013), pp. 651-655.
[6] J.M. Quimby, D.L. Gustafson, K.F. Lunn. The pharmacokinetics of mirtazapine in cats with chronic kidney disease and in age-matched control cats. J Vet Intern Med, 25 (2011), pp. 985-989.
[7] L.E. Ferguson, M.K. McLean, J.A. Bates, J.M. Quimby. Mirtazapine toxicity in cats: retrospective study of 84 cases (2006-2011). J Feline Med Surg, 18 (2016), pp. 868-874.
[8] C.M. Pugh, J.T. Sweeney, C.P. Bloch, J.A. Lee, J.A. Johnson, L.R. Hovda. Selective serotonin reuptake inhibitor (SSRI) toxicosis in cats: 33 cases (2004-2010). J Vet Emerg Crit Care (San Antonio), 23 (2013), pp. 565-570.
[9] J. Shin, N.K. Hills, P.R. Finley. Combining antidepressants with β-blockers: evidence of a clinically significant CYP2D6 drug interaction. Pharmacotherapy, 40 (2020), pp. 507-516.
[10] J. Woroń, M. Siwek, A. Gorostowicz. Adverse effects of interactions between antidepressants and medications used in treatment of cardiovascular disorders. Psychiatr Pol, 53 (2019), pp. 977-995.