| 一般情况 | |
|---|---|
 | 品种:伯恩山犬 |
| 年龄:3个月 | |
| 性别:雌 | |
| 是否绝育:否 | |
| 诊断:胰腺扭转 | |
01 主诉及病史
呕吐持续4天。食欲从低下发展到完全厌食,没有腹泻或排便变化。
既往身体健康,但未完全接种疫苗。曾有过饮食不节的病史,在发病前4天曾咀嚼过植物材料。
02 检查
体格检查显示神志清醒,反应灵敏。粘膜呈淡粉色,估计脱水5%。触诊时发现有轻微腹部不适,但未触及肿块。直肠检查时未发现腹泻,腹部听诊时发现腹水增多。
全血细胞计数显示中性粒细胞增多(中性粒细胞25.49×10^9/L [3-11.8];白细胞总数30.32×10^9/L [6-17])。血生化显示葡萄糖(6.9 mmol/L [3.3-6.1])、磷(0.48 mmol/L [0.16-0.37])、总钙(0.67 mmol/L [0.48-0.61])、碱性磷酸酶(260U/L [20-150])和淀粉酶(1564 U/L [200-1200])轻度升高。球蛋白(1.1 mmol/L [1.4-3.2])和血尿素氮(0.33 mmol/L [0.29-1.4])也有轻微下降。
静脉血气分析和电解质分析显示存在轻度低碳酸血症(29.9 mmHg [30-47])、低碱过量(-5.2 mmol/L [-5.0-5.0])、低钠(139 mmol/L [140-151])和低血尿素氮(0.33 mmol/L [0.29-1.4])。存在离子型高钙血症(1.46 mmol/L [1.13-1.42])。充盈细胞体积和总固形物分别为37%和6.6 g/dL。凝血酶原时间和活化部分凝血活酶时间均在正常范围内。
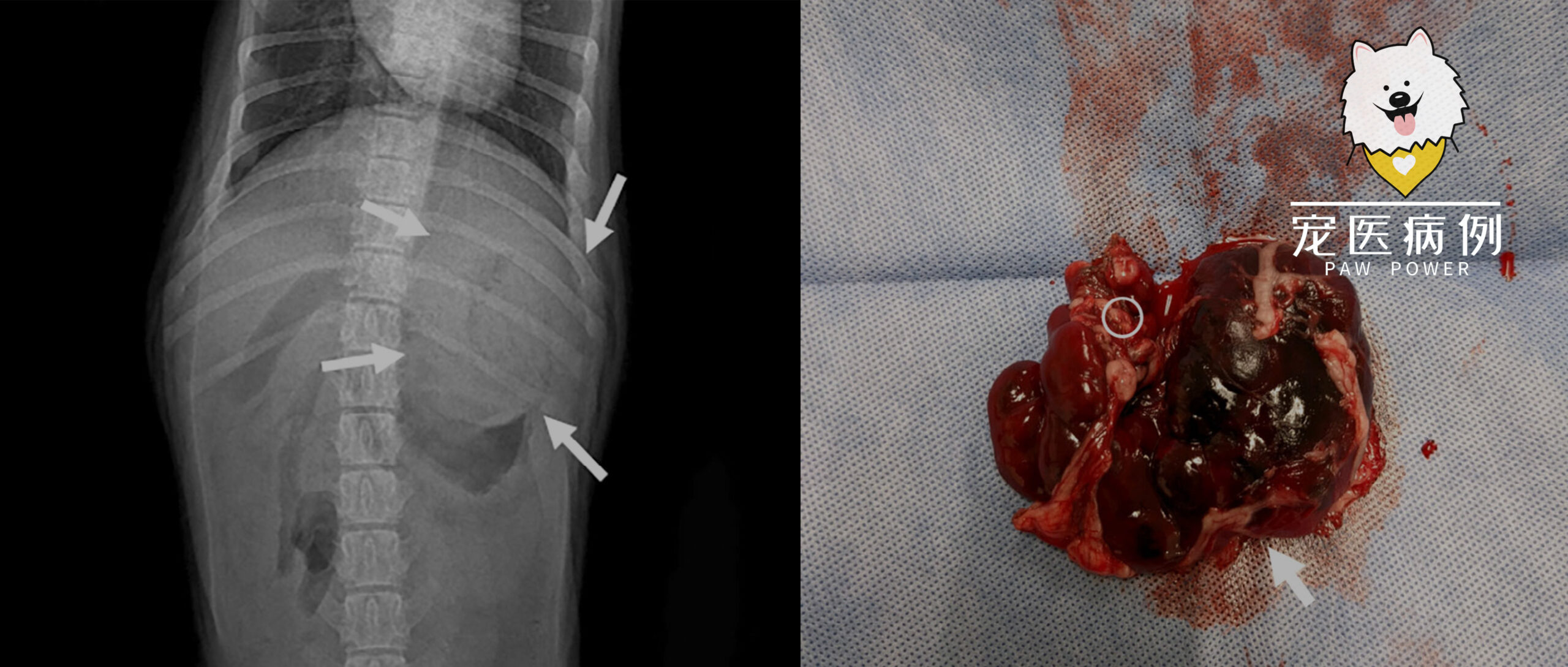
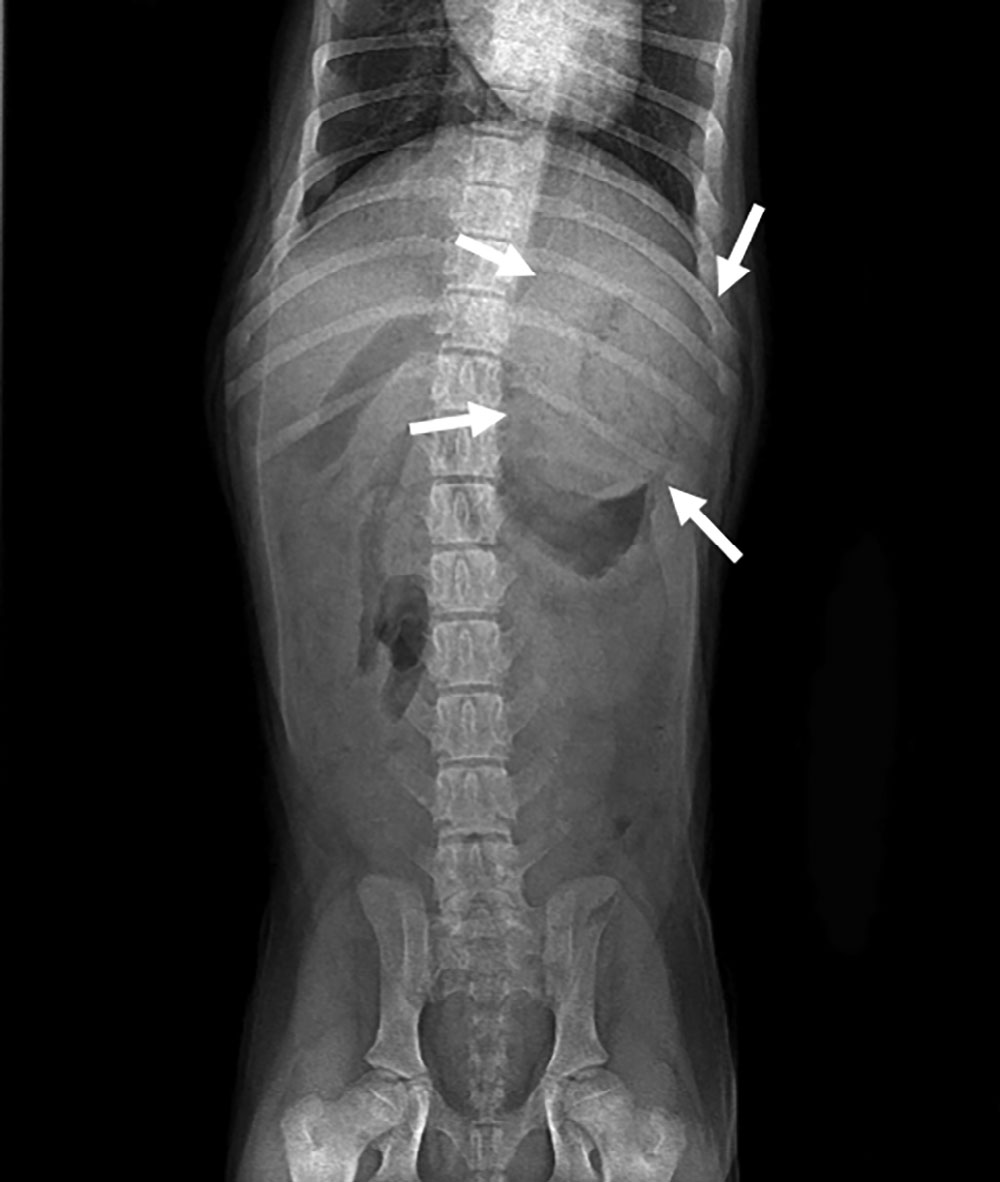
腹部X光检查显示浆膜细节轻度减少,腹背切面上胃部前方疑似有软组织不透明肿块影(下图)。
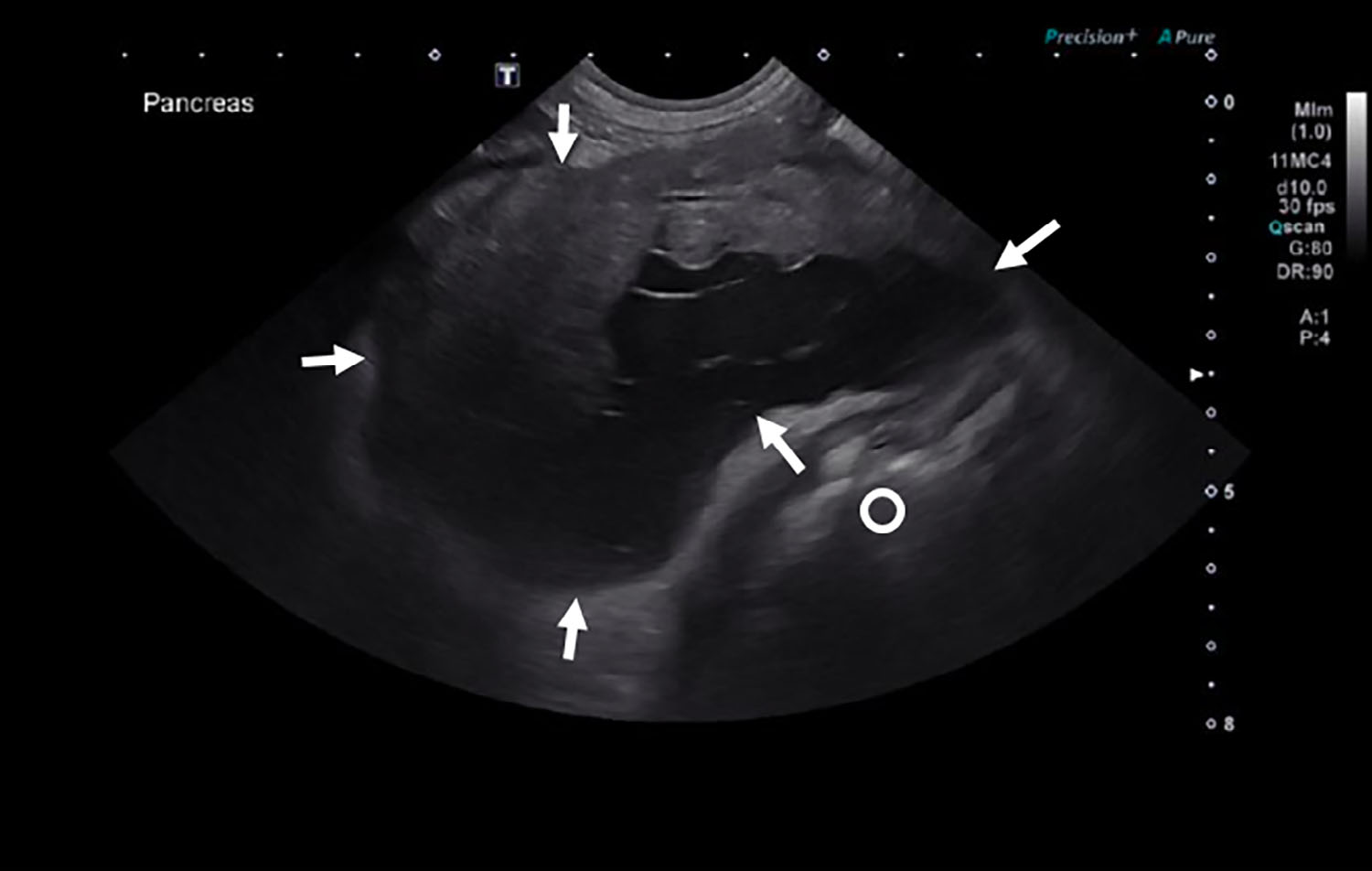
腹部超声显示在胃和肝之间有一个6×8 cm的部分充满液体的肿块,胃向尾部移位(下图)。对胰腺进行了评估,发现右侧胰腺略有肿大,呈低回声,周围有高回声脂肪,符合炎症。胰腺左缘无法确定。建议进行手术探查。
03 手术
以90 mL/kg/天的速度静脉输液(乳酸林格氏液),并静脉注射枸橼酸马洛比坦 1 mg/kg。经过6小时的补液和血容量补充后,静脉注射咪达唑仑0.3 mg/kg、芬太尼5 μg/kg、氯胺酮4 mg/kg的预处理药物。用丙泊酚静脉注射诱导全身麻醉(1.8 mg/kg以方便插管)。插管后使用100%氧气和七氟烷气体吸入麻醉。
术前在超声引导下进行了经腹平面阻滞镇痛(布比卡因1mg/kg,氯胺酮1 mg/kg,右美托咪定1 μg/kg)。在手术准备期间,静脉注射了一次甘珀酸0.02 mg/kg以缓解相对心动过缓。围术期抗生素为头孢唑啉22 mg/kg,在麻醉下静脉注射90分钟。手术中,一过性轻度低血压发作时需要注射一次10 mL/kg的林格氏液。
手术进行了常规的腹中线18 cm腹腔切开术,并用电刀切除了镰状脂肪,以帮助暴露术区和手术操作。腹腔内有轻微的血清性脓性液体,还发现了一个5 mm脐疝。
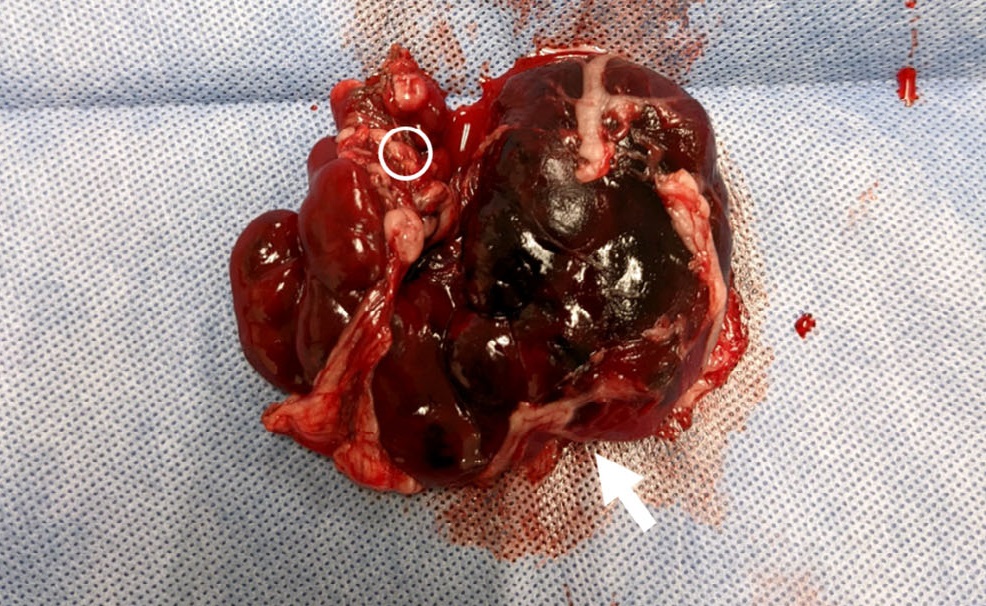
左侧胰腺远端三分之二部分严重充血、坚硬且发红(约4×6 cm)(下图)。胰腺近端有明显的扭转。扭转附近的胰腺组织看起来正常。使用结扎血管封闭装置切除了扭转的左侧胰腺。
腹部未发现其他异常。用0.9%无菌生理盐水灌洗腹部,并进行常规三层缝合。脐疝在腹部初次缝合时进行了修补。由于担心术后残留部分发生胰腺炎,并为了尽早进行肠内营养,恢复期间放置了鼻胃管。
肿块的组织病理学检查显示,整个胰腺和胰周脂肪组织都有中度到明显的出血和水肿,偶有纤维蛋白血栓形成。受影响最严重的区域出现弥漫性凝固性坏死。中度受影响的区域有多灶性凝固性坏死区。少量散在中性粒细胞,间皮细胞轻度肥大。胰腺和胰周出血明显,伴有胰腺梗死。没有发现肿瘤、感染或原发性炎症迹象。少量炎症被认为是组织坏死的反应。
04 预后
麻醉后恢复顺利,术后镇痛和抗焦虑药物为芬太尼 3 μg/kg/h、加巴喷丁100 mg PO Q8h、曲唑多纳75 mg PO Q8h。继续接受静脉输液治疗(林格氏液90 mL/kg/天)。在开始鼻胃管喂食之前,患者开始主动进食。
经过一夜的观察,患者的胃残余量极少,也没有出现恶心、呕吐或腹泻。转为口服药物治疗(枸橼酸马罗匹坦30 mg、加巴喷丁100 mg、曲唑酮75 mg),并在28小时后出院。出院后没有出现并发症。
术后14个月,主人称临床状况良好,没有慢性胃肠道症状或生长困难。体格检查发现身体状况评分为7/9,没有其他明显的异常。评估了胰蛋白酶样免疫反应(TLI)、胰脂肪酶免疫反应(pLI)、血清钴胺素和叶酸,以评估胰腺外分泌功能。结果显示TLI/pLI正常,表明没有长期胰腺炎症或胰腺外分泌功能障碍。空腹样本的TLI为21.2 μg/L [5.7-45.2];pLI为39 μg/L [<200]。钴胺素和叶酸正常,表明没有慢性肠病或吸收不良的证据。
05 讨论
扭转(torsion)是一种器官围绕其长轴发生轴向旋转的疾病,通常会导致供血血管闭塞和随后的缺血性损伤[1]。旋转(volvulus)描述的是器官围绕肠系膜根部的旋转[2]。
本病例报告作者选择使用“扭转”一词而非“旋转”,因为这种命名方式与之前发表的兽医病例报告一致,而且在解剖学上更为准确,因为扭转是围绕长轴而非肠系膜根部进行的[1,2]。迄今为止,文献中仅有一份病例报告描述了犬胰腺扭转的临床发现和手术治疗[1]。本病例是第一例对犬胰腺扭转术后胰腺功能进行长期随访的病例。
在人类文献中,旋转和扭转被交替用于描述胰腺的异常旋转和随后的缺血[2-8]。这种命名上的不一致很可能是由于这种病症相对不常见,导致文献中缺乏共识。此外,人类胰腺位置不正通常与其他腹部器官受累有关,这可能会进一步混淆术语[2-8]。
在该病例和之前报道的胰腺扭转病例中,胰腺左侧区域都是受影响的区域[1]。在解剖学上,胰腺右侧区域嵌入十二指肠系膜,中央区域紧邻幽门,而左侧区域位于大网膜内,与周围固定结构的结缔组织附着较少[9]。
左侧区域仍有一些解剖学附着物:网膜和胃十二指肠动脉、脾动脉和腹腔动脉小分支的血管结构[9]。犬胰腺的左侧区域与十二指肠中段和幽门附近的其余器官相比,结缔组织较少,因此可能更容易发生扭转。
这种活动度可能既促进了扭转,又使已报道的动物胰腺扭转有不同的成像结果。在之前的报告中,腹部成像显示胃大弯附近和尾部有软组织肿块效应,使升结肠和横结肠向尾部移位[1]。在本病例中,作为肿块效应检测到的胰腺扭转位于左侧,胃的头侧和肝的尾侧。该肿块无法通过超声明确与胰腺相连。彩色血流多普勒可能有助于显示扭转的胰腺区域内缺乏血流。增强CT有助于确定扭转器官的血流缺乏[4-6,8]。
由于多种因素的综合影响,该病例没有进行增强CT检查。虽然患者就诊当天无法进行CT检查,但CT检查不会改变患者进行手术探查的决定。增强CT是首选的诊断方式,人类文献中大多数急性腹部病例都采用这种诊断方式。
胰腺扭转在人类文献中鲜有报道,通常与脾脏位置不正常有关[2,4,5]。这可能是由于与犬相比,人类胰腺在解剖结构上存在差异。人类胰腺是一个单尾器官,头部固定在十二指肠系膜上,尾部固定在脾门上[10]。因此,大多数报道的胰腺扭转都是继发于脾扭转或“游走脾”[2,4-8]。也有继发于其他先天性畸形(如裂孔疝)的报道[3]。
在人类文献中,游走脾在快速生长的幼儿和育龄妇女中呈双相表现[2,5,6]。人们怀疑这些人群的韧带松弛容易导致“游走脾”以及随后的脾和胰腺扭转[2,5,6]。犬胰腺扭转病例都是年轻、快速生长的大型犬和巨型犬,他们可能也存在快速生长和腹部韧带松弛。这种腹部区域的变化可能是犬发生这种罕见疾病的危险因素。
胰腺扭转的临床表现与许多其他急腹症相似,表现为呕吐、腹痛和厌食,因此,胰腺扭转应被视为年轻大型犬急腹症中的一个鉴别诊断。胰腺部分切除术是治疗胰腺扭转的一种可行的治疗方法,效果良好。本病例没有发现长期的胰腺炎症或外分泌功能障碍。
文献来源:Moses IA, Hallowell TC. Successful surgical management of pancreatic torsion in a 3-month-old Bernese Mountain dog without evidence of long-term pancreatic dysfunction. Vet Med Sci. 2024 May;10(3):e1467.
参考文献
[1] Brabson, T. L., Maki, L. C., Newell, S. M., & Ralphs, S. C. (2015). Pancreatic torsion in a dog. Canadian Veterinary Journal, 56(5), 476–478.
[2] Flores‐Ríos, E., Méndez‐Díaz, C., Rodríguez‐García, E., & Pérez‐Ramos, T. (2015). Wandering spleen, gastric and pancreatic volvulus and right‐sided descending and sigmoid colon. Journal of Radiology Case Reports, 9(10), 18–25.
[3] Chevallier, P., Peten, E., Pellegrino, C., Souci, J., Motamedi, J. P., & Padovani, B. (2001). Hiatal hernia with pancreatic volvulus: A rare cause of acute pancreatitis. Ajr American Journal of Roentgenology, 177(2), 373–374.
[4] Colombo, F., D’Amore, P., Crespi, M., Sampietro, G., & Foschi, D. (2020). Torsion of wandering spleen involving the pancreatic tail. Annals of Medicine and Surgery (London), 50, 10–13.
[5] Priyadarshi, R. N., Anand, U., Kumar, B., & Prakash, V. (2013). Torsion in wandering spleen: CT demonstration of whirl sign. Abdominal Imaging, 38(4), 835–838.
[6] Seif Amir Hosseini, A., Streit, U., Uhlig, J., Biggemann, L., Kahl, F., Ahmed, S., & Markus, D. (2019). Splenic torsion with involvement of pancreas and descending colon in a 9‐year‐old boy. BJR Case Reports, 5(1), 20180051.
[7] Sheflin, J. R., Lee, C. M., & Kretchmar, K. A. (1984). Torsion of wandering spleen and distal pancreas. Ajr American Journal of Roentgenology, 142(1), 100–101.
[8] Zimmermann, M. E., & Cohen, R. C. (2000). Wandering spleen presenting as an asymptomatic mass. Australian and New Zealand Journal of Surgery, 70(12), 904–906.
[9] Evans, H. E., & DeLahunta, A. (2013). Miller’s anatomy of the dog. Elsevier Saunders.
[10] Standring, S. (2020). Gray’s anatomy: The anatomical basis of clinical practice. Elsevier.