| 一般情况 | |
|---|---|
 | 品种:马尔济斯犬 |
| 年龄:8岁6个月 | |
| 性别:雌 | |
| 是否绝育:否 | |
| 诊断:卵巢黄体瘤 | |
01 主诉及病史
10天前出现外阴出血、血尿和食欲减退。最后一次发情在约8个月前,整个发情周期中未发现异常。
02 检查
仅发现阴道出血,无外阴水肿,心脏有二级杂音。未发现其他异常。实验室检查未发现异常。
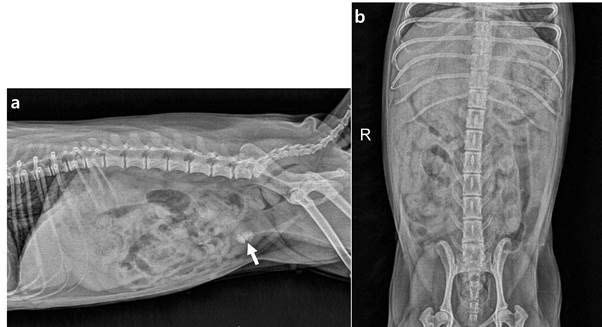
腹部放射线检查显示,除了膀胱结石外,没有其他异常(下图)。
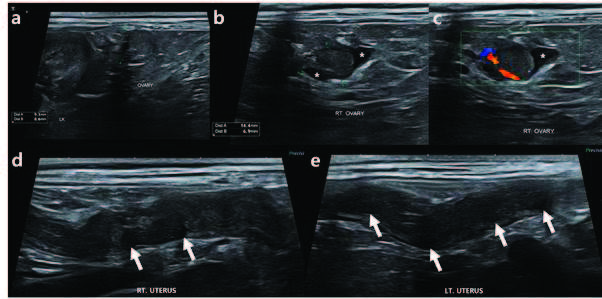
腹部超声发现右侧卵巢周围有囊性结构,导致其比左侧卵巢略大(下图)。在彩色多普勒模式下还观察到实质内有血流信号。右侧卵巢实质轮廓和形状规则,回声正常。在双侧子宫角的子宫内膜壁上观察到不规则增厚,并伴有多个囊性病变,提示子宫内膜囊性增生。超声检查还提示单侧右侧卵巢疾病的可能。
03 手术
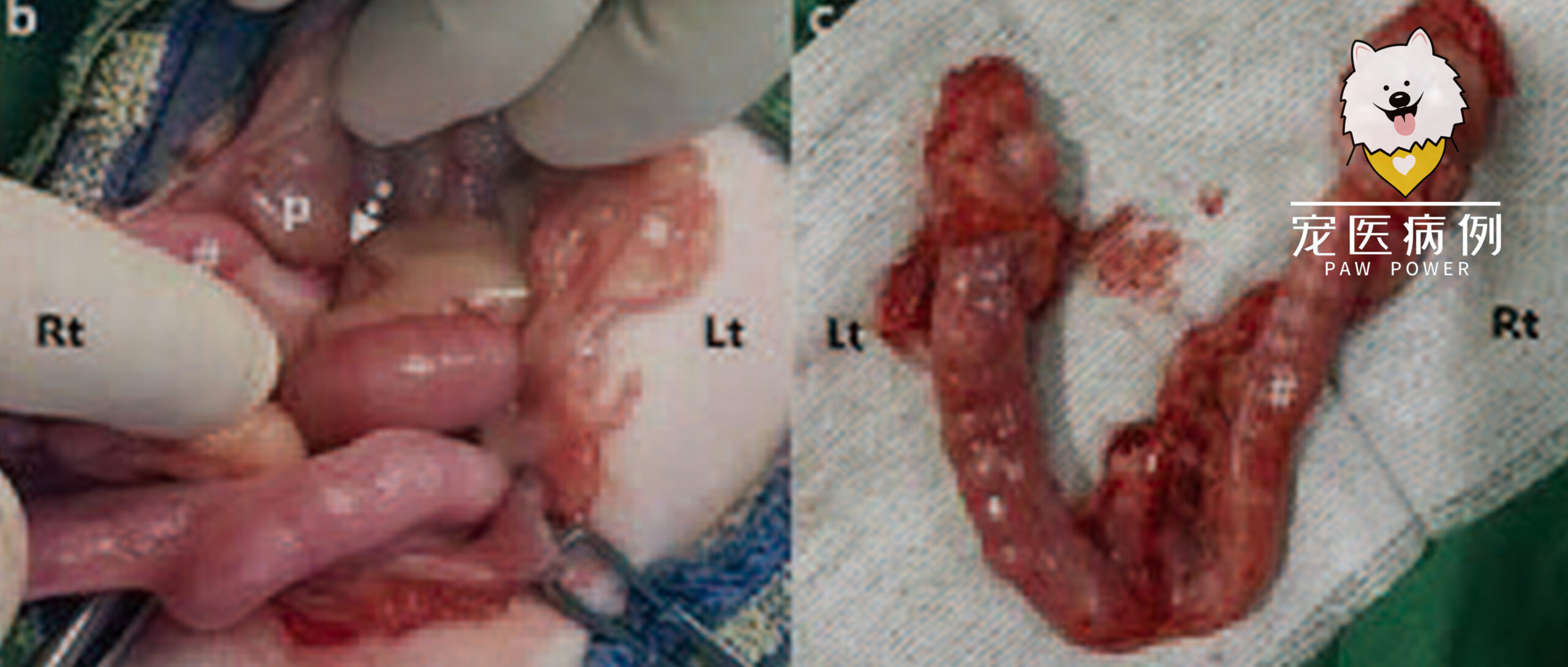
计划进行囊肿切除术和卵巢切除术,并对右侧卵巢进行组织病理学检查。手术中发现,右卵巢比左卵巢大,并与周围的肠系膜脂肪层和右侧胰腺实质粘连在一起(下图)。
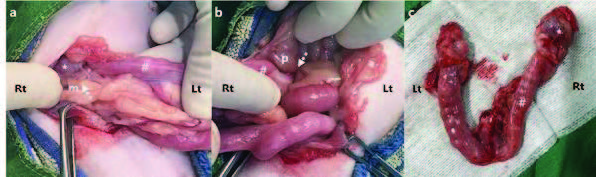
手术细致地将右侧卵巢与周围粘连的组织分离,连同膀胱结石一并切除。手术后,对两个卵巢进行了组织病理学检查,并进行了尿石成分检测。
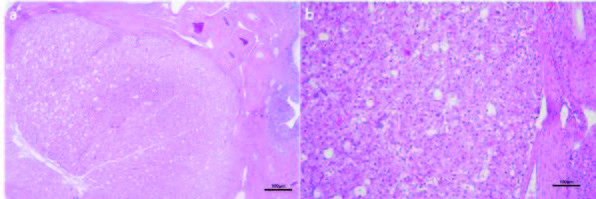
组织病理学检查显示左侧卵巢正常。证实了右侧卵巢黄体瘤的诊断,其特征是细胞类似黄体细胞,胞质丰富,含有脂滴,核大卵圆形,有少量有丝分裂(下图)。结石为草酸钙。
04 预后
手术后,患者出现血尿1天,之后血尿和外阴出血症状均有所改善。
术后3天食欲恢复正常。
到撰写本病例报告时为止,大约10个月没有出现任何临床症状。
05 讨论
未绝育母犬的卵巢肿瘤发病率相对较低,估计为6.25%,约占所有犬肿瘤的0.5%-1.2%[1-3]。这些肿瘤通常出现在老年母犬或患有卵巢残余综合征的母犬身上——这种情况通常与母犬过早绝育有关[1-4]。
卵巢肿瘤已在14个月到16岁的犬中确诊,大多数病例为10岁以上的犬[3]。值得注意的是,卵巢颗粒细胞瘤和畸胎瘤的发病年龄略低[4]。德国牧羊犬、拳师犬、约克夏梗犬、贵宾犬、波士顿梗犬和英国斗牛犬等特定犬种的发病率较高[3]。虽然左侧卵巢通常会受到影响,但上皮性卵巢肿瘤经常表现为双侧卵巢肿块[2,4]。
犬的卵巢肿瘤可根据其起源细胞分为以下三大类:1)上皮细胞肿瘤;2)性索间质细胞肿瘤;3)生殖细胞肿瘤[1-6]。
上皮细胞肿瘤包括腺瘤、腺癌、未分化癌、囊腺瘤和囊腺癌,其中乳头状腺瘤和腺癌占已报道犬卵巢肿瘤的40%-50%。生殖细胞肿瘤包括胚胎发育不良瘤、畸胎瘤、畸胎癌和胚胎癌,占犬卵巢肿瘤的6%-12%。性索间质细胞肿瘤包括生殖细胞瘤、肉瘤和黄体瘤,其中生殖细胞瘤最常见,肉瘤和黄体瘤比较罕见,占原发性卵巢肿瘤的比例不到5%[6]。
此外,罕见的卵巢肿瘤并不完全符合这些类别[3]。大多数犬卵巢肿瘤的推荐治疗方法是手术切除,通常是通过卵巢切除术,即切除卵巢和子宫[4]。
由于临床症状通常模糊且无特异性,因此诊断犬的卵巢肿瘤具有挑战性。临床表现通常源于腹腔内生长的肿块效应,可能导致腹水、转移和激素功能障碍[2]。
卵巢肿瘤的表现因原发组织不同而各异[2]。上皮细胞肿瘤在形成占位性肿块之前一般没有症状。相反,性索间质细胞肿瘤可能会出现阴道出血、子宫蓄脓或发情频率改变,这是因为肿瘤组织产生过多雌激素导致子宫内膜增生[2,3]。大多数患有卵巢肿瘤的犬都会表现出腹胀和可触及的肿块。其他常见症状包括阴道出血、子宫蓄脓和子宫内膜囊性增生[2]。
正常犬的卵巢通常较小,最大为25 mm,根据犬的体型和生殖周期而有所不同[2]。然而,当受到肿瘤或囊性疾病的影响时,卵巢的体积会明显增大[2]。犬最常见的卵巢疾病是卵巢囊肿和卵巢肿瘤[1]。
除了存在分泌激素的肿瘤外,在卵巢肿瘤中未观察到持续的异常实验室结果[3]。因此,影像诊断技术(如射线照相术和超声波照相术)在犬生殖肿瘤的诊断和管理中发挥着至关重要的作用[3,7]。
虽然放射学摄影是最早用于犬卵巢肿瘤的成像技术,但它也有一些局限性,尤其是当卵巢没有明显增大时[7]。卵巢增大会导致其韧带拉长,从而在X光片上造成邻近器官向内侧移位,而不是向腹侧移位。这也会导致肾脏尾端向腹侧偏移[1]。
在兽医临床实践中,超声检查是分析生殖系统的重要工具,它还能提供肿瘤结构的详细信息[8]。虽然正常犬卵巢由于体积小且回声与周围组织相似,在生殖周期的发情期可能无法被持续检测到[6],但卵巢肿瘤的位置通常可以通过其与邻近子宫角的接近程度以及与肾脏的尾部相对位置来确定[1]。
然而,在卵巢肿块非常大和怀疑有转移的病例中,确定起源可能具有挑战性,仅仅依靠放射线或超声可能会有局限性[1]。在这种情况下,有必要采用CT作为先进的诊断方法,以精确确定肿瘤的来源并评估转移情况[1]。在超声检查中,犬的卵巢肿瘤可能表现为单侧增大、区域性或局灶性病变,可能是实性或囊性的[7]。
犬卵巢的正常超声外观在发情周期中有所不同[9,10]。在超声检查中,卵巢囊肿表现为无回声、环绕良好的薄壁结构,远端增强[10]。大卵泡和黄体可能与卵巢囊肿相混淆,必须根据其临床表现来解释与卵巢相关的充满液体的结构[10]。
根据超声外观将卵巢肿块分为三大类——实性肿块、实性肿块伴囊性成分和囊性肿块——为确定这些肿瘤的特征提供了有价值的框架[3,4,7]。该分类法考虑了肿块内无回声腔(充满液体的区域)的百分比,有助于区分各种卵巢肿瘤。
- 实性肿块,包含少于10%的无回声腔,可能包括腺癌和肉瘤。
- 有囊性成分的实性肿块——占无回声腔的10%至 50%——包括腺癌、颗粒细胞瘤和胚胎发育不良瘤等。
- 无回声腔超过50%的囊性肿块包括腺瘤、畸胎瘤和其他囊性卵巢肿瘤[4,7]。
无回声腔的直径从0.2-3.5 cm不等,在所有病例中,实性实质的外观一致[7]。畸胎瘤通常呈囊性,并可能因毛发、皮肤、汗腺、软骨、骨骼和牙齿等结构而显示部分矿化和远端阴影,这可能有助于将这些肿瘤与其他卵巢肿块区分开来。子宫肌腺瘤通常表现为实性肿块,而血管肉瘤则表现为具有异质回声的实性肿块[7]。
在激素活跃的(性索间质)肿瘤病例中,通常会观察到子宫的变化,如子宫内膜囊性增生或子宫蓄脓,以及腹水的出现[7]。这些发现并非性索间质瘤所独有,游离液体的出现可能预示着腹膜播散,因此有必要对转移性疾病进行彻底评估。彩色多普勒超声是一种宝贵的工具,可用于识别卵巢肿块中的实体、血管成分,并帮助确定其特征。
一般来说,较小的卵巢肿瘤位于肾脏尾部附近,很容易被识别为卵巢肿瘤[3]。较大的实性肿块更有可能是恶性的。相比之下,轮廓规则的囊性肿块通常是良性的[3]。
兽医文献中有关卵巢黄体瘤的数据很有限[3,11],本病例报告强调了一个罕见病例,即通过超声检查初步确定了一只犬的疑似单侧卵巢肿瘤,随后通过术后组织病理学检查证实其为黄体瘤。
文献来源:Kim J, Lee N, Kim Y, Choi J, Yoon J. Diagnostic value of ultrasonography in identifying unilateral ovarian luteoma in a dog. Open Vet J. 2024 Mar;14(3):930-936.
参考文献
[1] Arlt S.P, Haimerl P. Cystic ovaries and ovarian neoplasia in the female dog—a systematic review. Reprod. Domest. Anim. 51 Suppl. 2016;1:3–3.
[2] Hong S.B, Choi H.J, Lee Y.W. Computed tomographic features of canine ovarian masses. J. Vet. Clin. 2022;39:107–113.
[3] Troisi A, Orlandi R, Vallesi E, Pastore S, Sforna M, Quartuccio M, Zappone V, Cristarella S, Polisca A. Clinical and ultrasonographic findings of ovarian tumours in bitches: a retrospective study. Theriogenology. 2023;210:227–227.
[4] Diez-Bru N, Garcia-Real I, Martinez E.M, Rollan E, Mayenco A, Llorens P. Ultrasonographic appearance of ovarian tumors in 10 dogs. Vet. Radiol. Ultrasound. 1998;39:226–233.
[5] Yamini B, VanDenBrink P.L, Refsal K.R. Ovarian steroid cell tumor resembling luteoma associated with hyperadrenocorticism (Cushing’s disease) in a dog. Vet. Pathol. 1997;34:57–60.
[6] Nishina H, Izawa T, Ozaki M, Kuwamura M, Yamate J. Unilateral luteoma of the ovary in a pregnant Risso’s dolphin (Grampus griseus) J. Vet. Med. Sci. 2017;79:1749–1752.
[7] Russo M, England G.C.W, Catone G, Marino G. Imaging of canine neoplastic reproductive disorders. Animals. 2021;11:1213.
[8] Nogueira Aires L.P, Gasser B, Silva P, Del’Aguila-Silva P, Yamada D.I, Carneiro R.K, Bressianini Lima B, Padilha-Nakaghi L.C, Ramirez Uscategui R.A, Spada S, Russo M, Rossi Feliciano M.A. Ovarian contrast-enhanced ultrasonography and Doppler fluxometry in bitches during the postovulatory estrus and corpora lutea formation. Theriogenology. 2022;194:162–170.
[9] Eker K, Salmanoğlu M.R. Ultrasonographic monitoring of follicular development, ovulation and corpora lutea formation in a bitch. Turk. J. Vet. Anim. Sci. 2006;30:589–592.
[10] Penninck P, d’Anjou M.A. Atlas of small animal ultrasonography. 2nd. Hoboken, NJ: John Wiley & Sons Inc; 2008. pp. 397–400.
[11] Ferré-Dolcet L, Romagnoli S, Banzato T, Cavicchioli L, Di Maggio R, Cattai A, Berlanda M, Schrank M, Mollo A. Progesterone-responsive vaginal leiomyoma and hyperprogesteronemia due to ovarian luteoma in an older bitch. BMC Vet. Res. 2020;16:284.