
| 一般情况 | |
|---|---|
 | 品种:金毛寻回犬 |
| 年龄:7岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:胃肠道间质瘤 | |
01 主诉及病史
因呕吐、厌食和抑郁就诊。
02 检查
体重36.8千克。血液检查发现碱性磷酸酶升高(662 IU/L [29-97])。
腹部X光片显示,腹腔内的肿块使肠道移位并受到压迫。
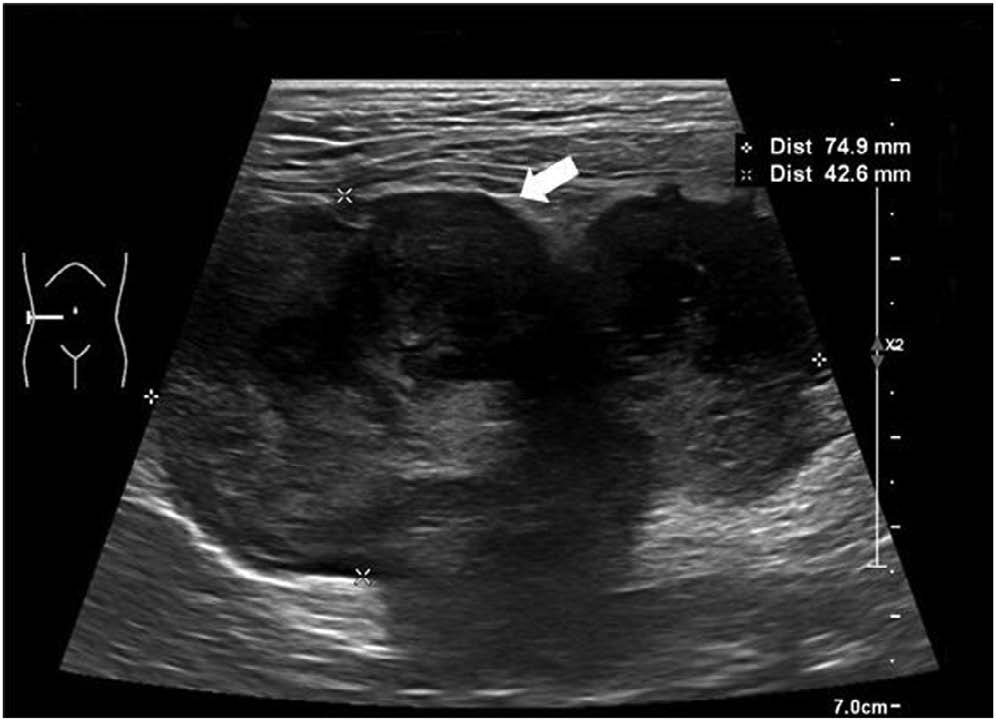
超声检查显示,右中腹腔有一个无定形的边缘不规则肿块(下图)。
CT显示,在横向视图(下图a)和冠状视图(下图b)中,一个7.85×5.90×8.75 cm的肿块来自盲肠的右尾腹部。

在超声引导下对肿块进行细针穿刺细胞学检查,发现是间充质细胞源性肿瘤。
03 手术
进行探查性开腹手术,以切除CT确定的腹部肿块。为了确定肿瘤及其边缘,术中使用短波红外荧光成像设备进行了吲哚菁绿成像。
将吲哚菁绿(25 mg)溶于5 mL无菌水中,配成5 mg/mL吲哚菁绿溶液。手术前24小时,以5 mg/kg剂量静脉注射,注射总量为36.8 mL。注射吲哚菁绿后,该犬住院1天以监测生命体征。住院期间,定期监测心率、呼吸频率、血压和体温,未发现明显异常。
静脉注射22 mg/kg头孢唑啉、1 mg/kg法莫替丁和0.2 mg/kg咪达唑仑。在使用8.5 mm气管插管后,静脉注射6 mg/kg丙泊酚诱导全身麻醉,并用异氟醚维持麻醉。
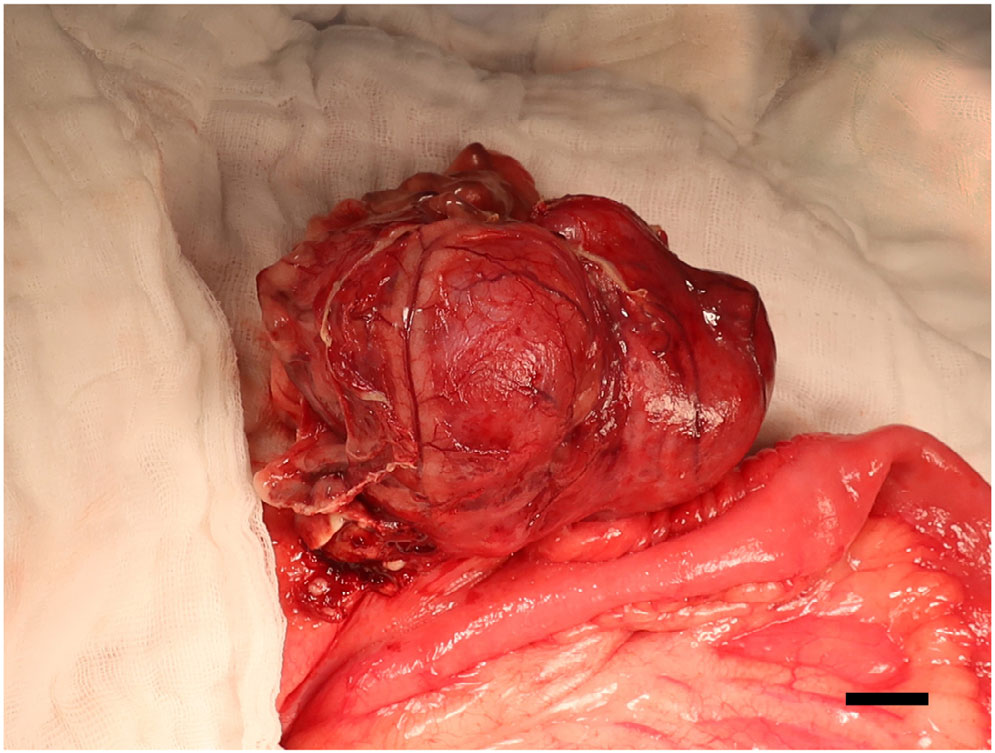
将狗置于背卧位,用15号刀片做中线切口,进入盲肠。经确认,肿块来自盲肠,肠系膜和肠道粘连严重(下图)。
从腹腔取出肿块后,进行了术中短波红外成像,可观察到吲哚菁绿蛋白复合物的荧光,其红外对比度为808 nm,发射峰值为808 nm(下图a)。肉眼观察到的荧光距离肿瘤约2-3 mm,但由于技术限制,无法测量确切距离。在距回盲肠结肠交界处荧光成像末端区域0.5 cm处进行切除,切除手术在盲肠肿块所在部位进行,肿块与肠道平行切除。肿块切除后,使用红外荧光成像评估手术部位的残留荧光组织(下图b)。
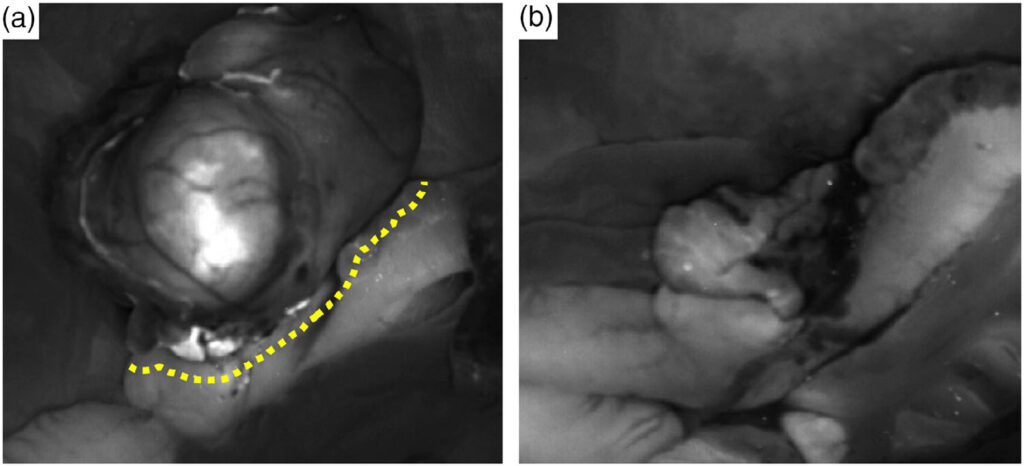
确认无荧光后,使用4-0缝线以简单间断的方式缝合切除区域。腹腔灌洗后,在腹腔内放置主动抽吸装置,然后关闭体壁、皮下组织和皮肤,完成手术。
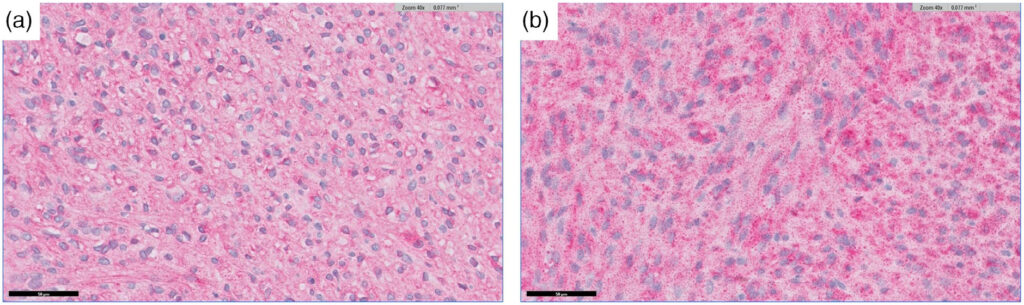
病理检查显示这是一个含有纺锤形细胞的肉瘤,组织病理学和免疫组化结果显示,C-kit(下图a)和DOG1(下图b)阳性,支持恶性胃肠道间质瘤的诊断。染色标记区没有肿瘤细胞。有丝分裂数为每10个高倍视野3个,未观察到淋巴管侵犯。肠切片边缘完整,无肿瘤细胞。
04 预后
术后3天开具了抗生素处方后出院,术后镇痛采用透皮芬太尼贴片,剂量为25 µg/h。
术后由于辅助全身化疗的疗效较低且治疗费用较高,该犬没有接受辅助化疗。
患者定期到医院通过胸部和腹部X光片及腹部超声检查评估局部复发和转移情况。检查间隔为术后1个月、3个月。此后每3个月进行一次随访。
直到最后一次随访,检查中都没有发现转移或复发的迹象。
05 讨论
胃肠道肿瘤,如平滑肌肉瘤和胃肠道间质瘤(GIST),是一种不常见的间质肿瘤,约占狗所有肿瘤的3%[1,2]。GIST来源于卡贾尔间质细胞[3],卡哈尔氏间质细胞是平滑肌和神经丛中的起搏细胞,控制着肠道的蠕动和更新[2,4]。
以前,GIST被认为与胃肠道肿瘤中的平滑肌肉瘤相似,并被归入同一类胃肠道肿瘤。然而,随着免疫组化染色技术的进步,GIST已与平滑肌肉瘤区分开来[5,6]。放疗和化疗等辅助疗法对GIST无效,因此手术切除始终是主要的治疗方法[7]。
过去几十年来,为提高手术效果,已开发出多种手术技术和程序,如使用吲哚菁绿[8]进行荧光成像。静脉注射吲哚菁绿后,它会与血浆蛋白结合,吲哚菁绿-血浆蛋白复合物会发出波长约为805-830纳米的光[9]。
由于肿瘤的通透性和滞留效应增强,吲哚菁绿复合物会在肿瘤细胞内积聚[10]。使用短波红外成像设备可观察到肿瘤和肿瘤边缘[9]。利用术中短波红外成像进行肿瘤切除的兽医病例鲜有报道。本病例是首例通过术中短波红外成像完成切除的犬GIST病例。
在人类中,GIST最常见于胃部,其次是小肠和结肠[5]。相比之下,狗GIST最常发生在盲肠[4,5,10],本病例中的肿瘤就位于盲肠。
平滑肌肉瘤看起来与GIST相似,这种间质细胞肿瘤被重新归类为表达CD117[2,4]的肿瘤。患GIST的犬在发病时的年龄可能比患平滑肌肉瘤的犬大,因此,患GIST的犬可能会因盲肠穿孔和化脓性腹膜炎而比其他犬有更高的围手术期死亡率[11]。
完全肠切除和吻合术是包括GIST在内的肠道肿瘤的主要手术治疗方法[12]。一般来说,在进行肠道肿瘤手术时,建议在肿瘤的头尾方向切除约3厘米的正常肠道组织,以确保足够的手术切缘[12]。
在多项研究中,GIST的复发率约为7%-29%[11,13]。因此,在手术中完全切除肿瘤非常重要。
为了确定肿瘤的起源和足够的手术切缘以进行最小化切除,对该病例进行了术中短波红外荧光成像。在标准手术方法中,胃肠道肿瘤连同受影响的肠道应在每个方向上距离大体正常的肠道3厘米处切除,以防止复发和肿瘤残留[12]。
然而,利用短波红外荧光成像技术可以在与荧光标记相距0.5厘米的手术边缘进行切除。在手术过程中,可以实时观察肿瘤的情况,更准确地规划手术边缘。这种方法可以提高肿瘤切除的准确性,降低复发风险。本病例的组织病理学检查证实,切除的肿瘤是一种GIST,手术边缘没有肿瘤细胞残留,表明手术很成功。
吲哚菁绿在兽医学中的应用也有一些局限性。其一是需要对吲哚菁绿可视化设备的使用进行专门培训,这可能会限制有经验的外科医生使用。迄今为止,还没有关于吲哚菁绿在犬胃肠道手术中的剂量和注射时间的研究。此外,吲哚菁绿不仅会在肿瘤中积聚,也会在炎症细胞中积聚[8]。最后,仅凭这一个病例的结果,还无法确认在手术过程中使用短波红外成像技术就能成功实现肿瘤的完全切除。
总之,利用吲哚菁绿进行的短波红外成像是一种很有前景的技术,可改善患有胃肠道肿瘤的犬猫的手术切缘。还需要进一步研究,以评估该技术的长期效果,并确定如何提高该技术在兽医临床实践中的可及性和可用性及其不良影响。
文献来源:Choi J, Lee S. Excision of a gastrointestinal stromal tumour in a dog using short-wave infrared fluorescence imaging and indocyanine green. Vet Med Sci. 2024 Jul;10(4):e1506.
参考文献
[1] Frgelecová, L., Škorič, M., Fictum, P., & Husník, R. (2014). Canine gastrointestinal tract tumours: A retrospective study of 74 cases. Acta Veterinaria Brno, 82, 387–392.
[2] Russell, K. N., Mehler, S. J., Skorupski, K. A., Baez, J. L., Shofer, F. S., & Goldschmidt, M. H. (2007). Clinical and immunohistochemical differentiation of gastrointestinal stromal tumors from leiomyosarcomas in dogs: 42 cases (1990–2003). Journal of the American Veterinary Medical Association, 230, 1329–1333.
[3] Montañés, I., Vila, A., Roura, X., Santos, L., Canturri, A., Verdés, J., Martín, L., Díaz‐Bertrana, C., & Lloret, A. (2019). Gastrointestinal stromal tumors (GIST): Retrospective study of 6 dogs. Clínica Veterinaria de Pequeños Animales, 39, 155–161.
[4] Gillespie, V., Baer, K., Farrelly, J., Craft, D., & Luong, R. (2011). Canine gastrointestinal stromal tumors: Immunohistochemical expression of CD34 and examination of prognostic indicators including proliferation markers Ki67 and AgNOR. Veterinary Pathology, 48, 283–291.
[5] Miettinen, M., & Lasota, J. (2001). Gastrointestinal stromal tumors—Definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnosis. Virchows Archiv, 438, 1–12.
[6] Nishida, T., & Hirota, S. (2000). Invited reviews—Biological and clinical review of stromal tumors in the gastrointestinal tract. Histology and Histopathology, 15, 1293–1301.
[7] Parab, T. M., DeRogatis, M. J., Boaz, A. M., Grasso, S. A., Issack, P. S., Duarte, D. A., Urayeneza, O., Vahdat, S., Qiao, J. H., & Hinika, G. S. (2019). Gastrointestinal stromal tumors: A comprehensive review. Journal of Gastrointestinal Oncology, 10, 144–154.
[8] Alander, J. T., Kaartinen, I., Laakso, A., Pätilä, T., Spillmann, T., Tuchin, V. V., Venermo, M., & Välisuo, P. (2012). A review of indocyanine green fluorescent imaging in surgery. Journal of Biomedical Imaging, 2012, 940585.
[9] Holt, D., Okusanya, O., Judy, R., Venegas, O., Jiang, J., DeJesus, E., Eruslanov, E., Quatromoni, J., Bhojnagarwala, P., Deshpande, C., Albelda, S., Nie, S., & Singhal, S. (2014). Intraoperative near‐infrared imaging can distinguish cancer from normal tissue but not inflammation. PLoS ONE, 9, e103342.
[10] Frost, D., Lasota, J., & Miettinen, M. (2003). Gastrointestinal stromal tumors and leiomyomas in the dog: A histopathologic, immunohistochemical, and molecular genetic study of 50 cases. Veterinary Pathology, 40, 42–54.
[11] Maas, C. P., Ter Haar, G., Van Der Gaag, I., & Kirpensteijn, J. (2007). Reclassification of small intestinal and cecal smooth muscle tumors in 72 dogs: Clinical, histologic, and immunohistochemical evaluation. Veterinary Surgery, 36, 302–313.
[12] Tobias, K. M., & Johnston, S. A. (Eds.). (2017). Veterinary surgery: Small animal. Elsevier, 1513–1561.
[13] Del Alcazar, C. M., Mahoney, J. A., Dittrich, K., Stefanovski, D., & Church, M. E. (2021). Outcome, prognostic factors and histological characterization of canine gastrointestinal sarcomas. Veterinary and Comparative Oncology, 19, 578–586.