
| 病例1 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:13岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:皮肤疥螨病 | |
01 主诉及病史
2周前颈部、四肢及腹部出现皮损和严重的瘙痒。
来自单宠物家庭,可自由出入于户外。主人未报告自己感染疥螨的迹象。
02 检查
通过VRS评分,主人将猫的瘙痒程度评为严重瘙痒(4/4)。瘙痒和病变部位包括颈部、右肘及前肢外侧、左大腿后侧和腹部(下图)。病变部位出现脱毛/斑秃、糜烂、结痂及丘疹。
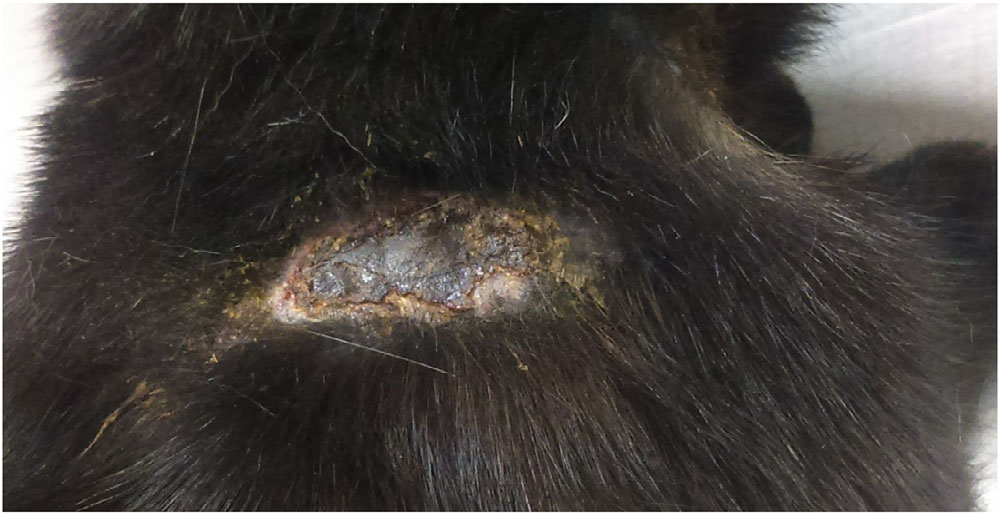
从肘部采集4-6块深层刮片样本,观察到了疥螨(下图)。
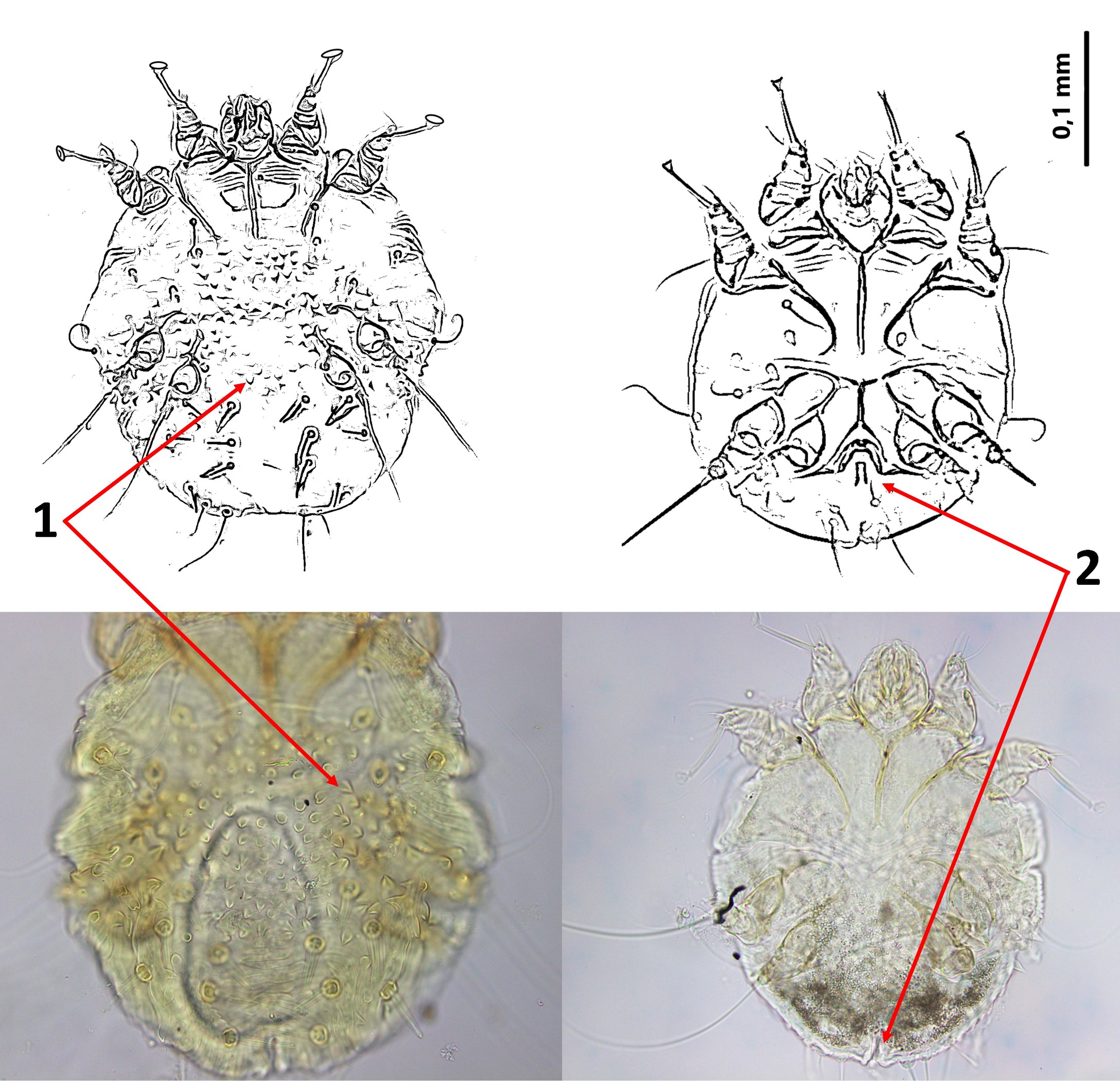
疥螨的分类是根据形态特征和虫体大小进行的。识别的依据是观察背侧的大面积的棘刺、尾侧的鳞片和腹侧的肛门。后者是与另一种疥螨(Notoedres cati)区分的关键特征,Notoedres cati的肛门位于背部。
03 治疗
接受了单剂量的莫西菌素(4 mg外用)和吡虫啉(40 mg滴剂)产品。
指导主人彻底清洁猫的生活环境,每周用吸尘器吸尘、用洗涤剂清洗被褥、毛毯和地毯。
04 预后
第14天和第30天进行了随访,病情明显好转,瘙痒症状得到缓解,而且没有出现新的皮损,皮肤刮片检查均为阴性。
| 病例2 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:7岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:皮肤疥螨病 | |
05 主诉
及病史1周前胸部出现皮损和严重的瘙痒。
来自单宠物家庭,可自由出入于户外。主人未报告自己感染疥螨的迹象。
06 检查
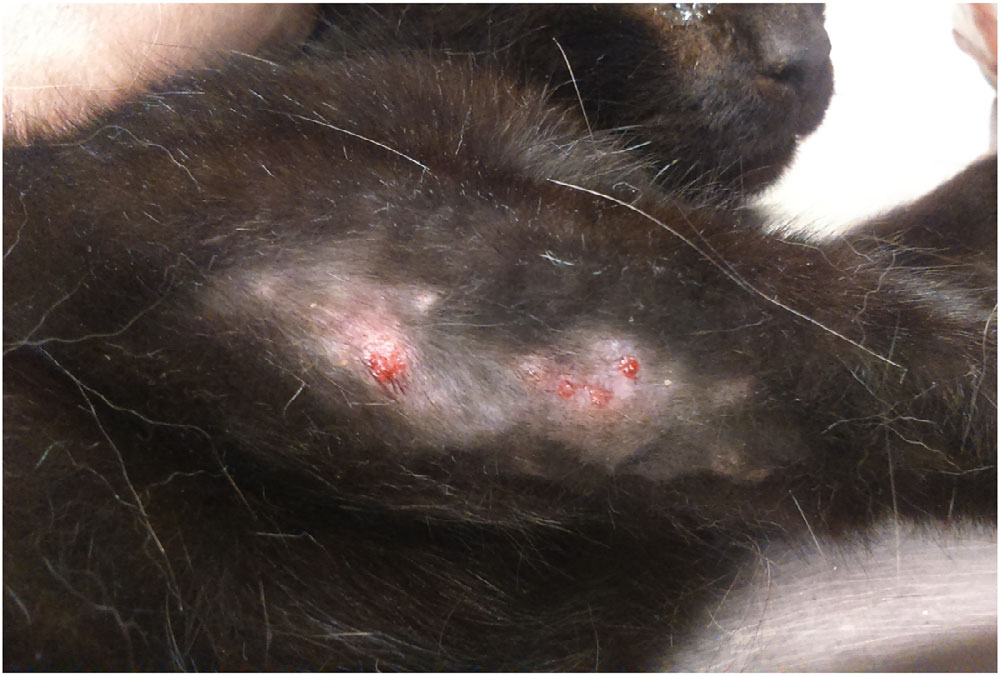
通过VRS评分,主人将猫的瘙痒程度评为严重瘙痒(4/4)。只有胸部右外侧出现瘙痒(下图)。病变部位出现脱毛/斑秃、糜烂及结痂。
从胸部采集4-6块深层刮片样本,观察到了疥螨(下图)。

07 治疗
接受了局部塞拉菌素(45 mg)治疗,两次治疗间隔2周。
指导主人彻底清洁猫的生活环境,每周用吸尘器吸尘、用洗涤剂清洗被褥、毛毯和地毯。
08 预后
第14天和第30天进行了随访,病情明显好转,瘙痒症状得到缓解,而且没有出现新的皮损,皮肤刮片检查均为阴性。
| 病例3 | |
|---|---|
 | 品种:暹罗猫 |
| 年龄:2岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:皮肤疥螨病 | |
09 主诉及病史
2周前头部及背部出现皮损和严重的瘙痒。
来自单宠物家庭,可自由出入于户外。主人未报告自己感染疥螨的迹象。
10 检查
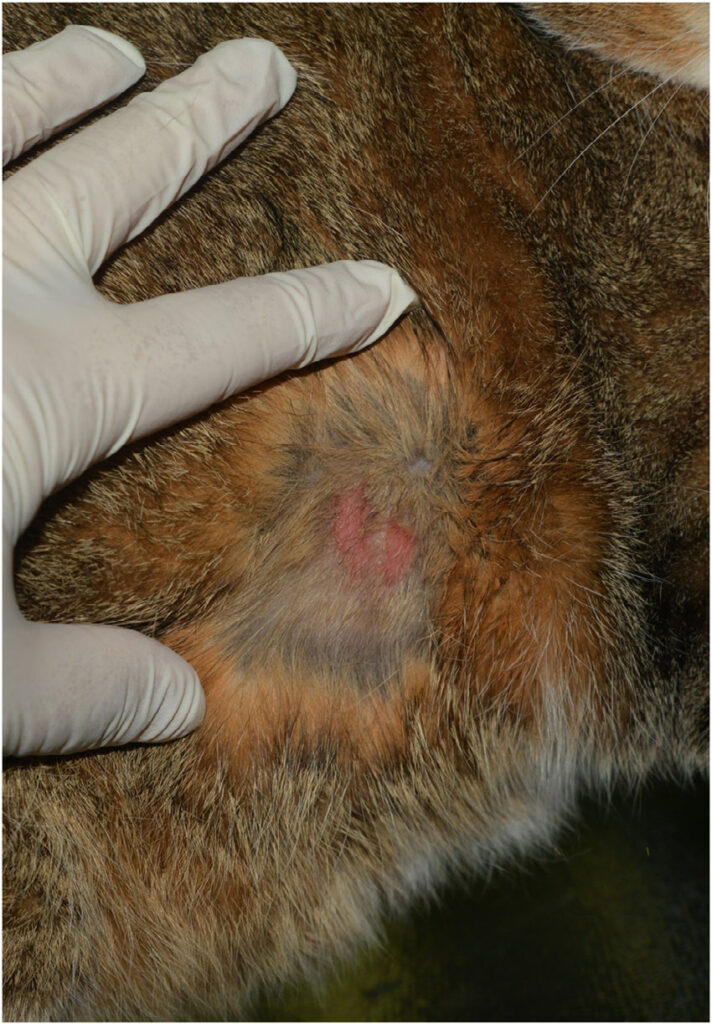
通过VRS评分,主人将猫的瘙痒程度评为严重瘙痒(4/4)。病变和瘙痒主要发生在头部、耳廓(下图)、背部和尾部。病变部位出现脱毛/斑秃、糜烂、结痂及丘疹。
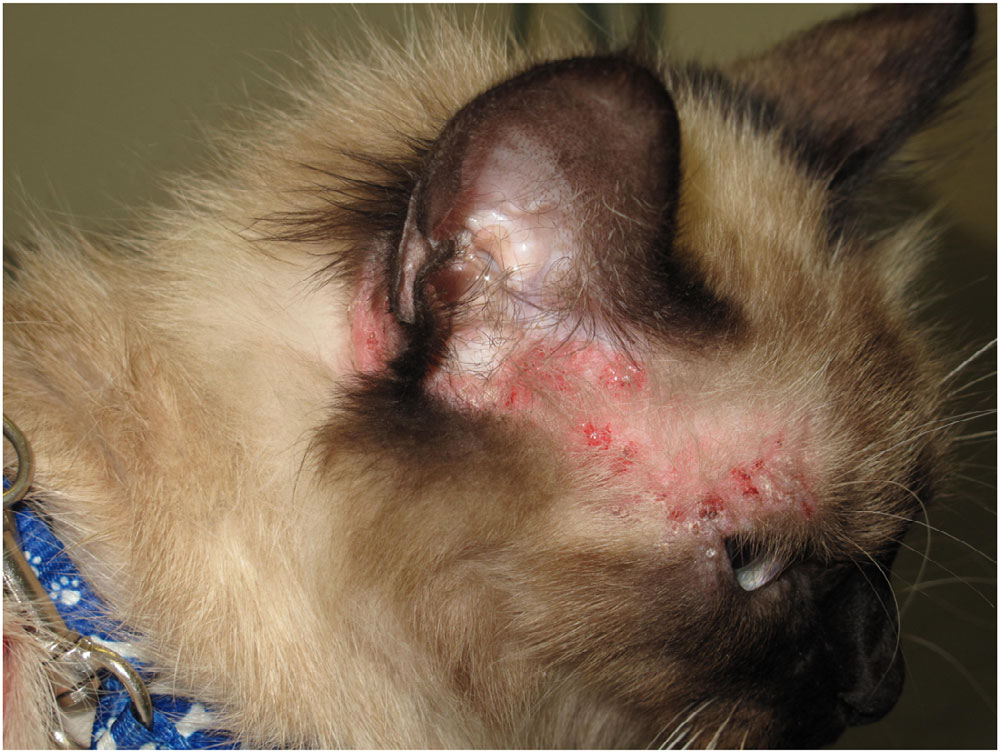
从头部采集4-6块深层刮片样本,观察到了疥螨(下图)。

11 治疗
接受伊维菌素治疗,剂量为200 μg/kg,每周一次皮下注射,持续4周。
指导主人彻底清洁猫的生活环境,每周用吸尘器吸尘、用洗涤剂清洗被褥、毛毯和地毯。
12 预后
第14天和第30天进行了随访,病情明显好转,瘙痒症状得到缓解,而且没有出现新的皮损,皮肤刮片检查均为阴性。
13 讨论
疥螨病(Sarcoptic mange)是由疥螨(Sarcoptes scabiei,S. scabiei)引起的一种体外寄生虫病[1]。这种寄生虫已从多种哺乳动物中分离出来,既有驯养动物(狗、猫、兔子、豚鼠、绵羊、山羊、牛和猪),也有野生动物(豺、狼、狐狸、有袋动物和熊)[2-4]。
疥螨病可通过直接或间接传播发生[5]。疥螨病具有高度传染性,可通过动物传染给人类,也可在人与人之间传播[6]。
它的亚种通常被认为具有宿主特异性,因此,犬疥螨(S. scabiei var. canis)通常只在犬身上完成其繁殖周期,但可以在离开宿主后存活几天[7]。然而,一份基于微卫星标记调查的新报告提出了不同的假设,认为其分布主要与地理位置有关[5],在交替宿主的情况下,这一过程取决于湿度和温度[8]。根据2013年发表的一项研究,在波兰,疥螨病在皮肤科就诊的狗中所占比例不到5%[9]。
猫最常见的疥螨是耳螨(Otodectes cynotis),而其他皮肤相关疥螨(S. scabiei和Notoedres cati)的感染则少见得多[10]。Notoedres cati感染常见于气候温暖的国家。猫感染S. scabiei极为罕见,已发表的病例报告也很少[4,11-13]。本系列病例介绍了对波兰3只猫感染S. scabiei的临床观察和后续治疗。
在伴侣动物中,疥螨病最常见于狗[4]。在温暖潮湿的气候条件下,疥螨病的发病率可能会更高,但迄今为止还缺乏相关证据[14]。
犬疥螨病的特征是剧烈瘙痒,通常发生在腹部、耳廓边缘和肘部[15]。疥螨病的特征性病变包括丘疹和红斑,以及瘙痒后病变,如结痂、糜烂、鳞屑和脱毛/斑秃[16]。
慢性侵袭会导致皮肤苔癣化,变厚并出现色素沉着[17,18]。长期受感染的动物还可能出现更普遍的症状,如胃肠道症状、体质下降或因免疫系统过度刺激而继发皮肤感染[19]。
相比之下,猫疥螨病的临床表现似乎更加多样。虽然犬疥螨病的主要病变是丘疹,但结痂似乎是猫疥螨病更为显著的临床特征[4,13,20]。
本报告中所有猫都出现了结痂,但3只猫中只有2只出现了丘疹。以前关于猫疥螨病的报告曾描述过口背部结痂[4,12,13]、四肢远端和尾巴结痂[12],甚至脚部也有结痂,并导致爪子畸形和甲沟炎[21]。
在本文报告的病例中,病变位置也不相同,与在狗身上观察到的典型模式不同。病例2的病变只发生在胸部的一侧,这并不是犬疥螨病的典型病变部位,但以前曾有过关于猫的报道[13,22]。
这些病例在时间和地点上并不集中。所有猫都居住在同一地区(省),但来自非常遥远的地方。目前还不清楚这些猫是如何感染疥螨的,但它们都有户外活动的机会,而且似乎有可能接触到野生动物。
在波兰,疥螨在野生动物中很常见。1994年至2013年期间在波兰比亚沃韦扎地区进行的一项长期调查显示,在10种受调查的食肉动物中,有6种感染了疥螨。最常感染的五个物种包括赤狐(19%)、獾(9%)、狼(7%)、浣熊(6%)和貂(5%)[23]。
犬疥螨(S. scabiei var. canis)会通过环境间接侵袭动物[24],或通过最低限度的直接接触侵袭动物[25]。根据这些信息以及赤狐在波兰的普遍存在,赤狐很可能是感染的源头。
寄生虫对宿主的特异性可能非常高。据报道,犬疥螨会在2周左右自发死亡[26]。然而,狗也会感染与狐狸相同的亚种,在免疫抑制、共同感染或共同侵袭的情况下,这种亚种也能适应猫的感染[27]。
狗、猫和狐狸体内的螨虫形态特征相似,尤其是这些动物体型较小,有助于寄生虫在密集的毛囊中穿行。相似的宿主行为和环境共存也增加了亚种在宿主之间转移的可能性[28]。
疥螨可成功地从野外的狐狸感染到狗,再从狗感染到人[28]。既往研究根据分子标记(微卫星)进行的一项研究表明,家养/野生猫科动物之间的转移与地理模式关系更大。遗传特征与主成分分析表明,在意大利、法国和瑞士,犬疥螨在不同食肉宿主之间关系密切[5]。
伊维菌素注射液(200 μg/kg,皮下注射,每周三到四次)、塞拉菌素滴剂(8 mg/kg,间隔14天)和1%莫西菌素与10%吡虫啉的复方制剂(0.1 mL/kg,间隔14天)已被用于治疗疥螨病,无需额外治疗[4,13,29]。
还建议使用石灰硫磺浸剂进行辅助治疗。但在上述的三个案例中,均未采用这种方法[13]。一份报告描述了伊维菌素和塞拉菌素与莫西菌素-吡虫啉组合的低效性,但最终还是有效的[4]。
在本报告中介绍的病例中,所有疗法都能达到临床治愈的效果,而且在治疗过程中无需更换配方。在开始治疗2周后的复诊中,所有猫的原有病变均有明显改善,没有出现新的病变,瘙痒症状也得到缓解。
总之,猫疥螨病是一种罕见的猫寄生虫感染。猫疥螨病的临床表现似乎比狗更加多变,尤其是在瘙痒程度和皮损位置方面。结痂和瘙痒似乎同样是猫感染疥螨的重要症状。人畜共患病传播的可能性会对公共卫生产生影响,因此,尽管疥螨病很少见,但对于患有瘙痒性炎症性皮肤病的猫来说,将疥螨感染作为鉴别诊断是非常重要的。
文献来源:Szczepanik M, Wilkolek P, Kalisz G, Szczepaniak K. Feline sarcoptic mange in Poland: A case series of three cats. Vet Med Sci. 2024 Jul;10(4):e1500.
参考文献
[1] Ali, M. H., Begum, N., Azam, M. G., & Roy, B. C. (2011). Prevalence and pathology of mite infestation in street dogs at Dinajpur municipality area. Journal of Bangladesh Agricultural University, 9, 111–120.
[2] Berkovitz, A., Waner, T., King, R., & Perl, S. (2009). Concurrent parasitation with Sarcoptes and Demodex in a Golden Jackal. Israel Journal of Veterinary Medicine, 64, 10–11.
[3] Browne, E., Driessen, M. M., Cross, P. C., Escobar, L. E., Foley, J., López‐Olvera, J. R., Niedringhaus, K. D., Rossi, L., & Carver, S. (2022). Sustaining transmission in different host species: The emblematic case of Sarcoptes scabiei. Bioscience, 72, 166–176.
[4] Huang, H. P., & Lien, Y. H. (2013). Feline sarcoptic mange in Taiwan: a case series of five cats. Veterinary Dermatology, 24(4), 457–459.
[5] Moroni, B., Albanese, F., Rita Molinar Min, A., Pasquetti, M., Guillot, J., Pisano, S. R. R., Ryser‐Degiorgis, M. P., Rüfenacht, S., Gauthier, D., Cano‐Terriza, D., Scaravelli, D., Rossi, L., & Peano, A. (2023). Sarcoptic mange in Felidae: Does Sarcoptes scabiei var. felis exist? A first molecular study. Parasite, 30, 11.
[6] Moroni, B., Rossi, L., Bernigaud, C., & Guillot, J. (2022). Zoonotic episodes of scabies: A global overview. Pathogens, 11(2), 213.
[7] Montecino‐Latorre, D., Cypher, B. L., Rudd, J. L., Clifford, D. L., Mazet, J. A. K., & Foley, J. E. (2019). Assessing the role of dens in the spread, establishment and persistence of sarcoptic mange in an endangered canid. Epidemics, 27, 28–40.
[8] Arlian, L. G., & Morgan, M. S. (2017). A review of Sarcoptes scabiei: Past, present and future. Parasites & Vectors, 10, 297.
[9] Pomorska‐Handwerker, D. (2013). Choroby dermatologiczne u psów i kotów w Polsce (Skin diseases in dogs and cats in Poland). Royal Canin.
[10] Curtis, C. F. (2004). Current trends in the treatment of Sarcoptes, Cheyletiella and Otodectes mite infestations in dogs and cats. Veterinary Dermatology, 5(2), 108–114.
[11] Korbelik, J., Singh, A., Rousseau, J., & Weese, J. S. (2019). Characterization of the otic bacterial microbiota in dogs with otitis externa compared to healthy individuals. Veterinary Dermatology, 30(3), 228–e70.
[12] Malik, R., McKellar Stewart, K., Sousa, C. A., Krockenberger, M. B., Pope, S., Ihrke, P., Beatty, J., Barrs, V. R. D., & Walton, S. (2006). Crusted scabies (sarcoptic mange) in four cats due to Sarcoptes scabiei infestation. Journal of Feline Medicine and Surgery, 8, 327–339.
[13] Singh, R., Turkar, S., Dua, K., & Khan, I. S. (2019). A rare case of Sarcoptes Scabiei in Persian cat. Veterinary Medicine, 39, 56–58.
[14] Khoobdel, M., Azari‐Hamidia, S., Hanafi‐Bojd, A. A., Bakhshi, H., Jafari, A., & Moradi, M. (2022). Scabies as a neglected tropical disease in Iran: A systematic review with meta‐analysis, during 2000–2022. Journal of Arthropod‐Borne Diseases, 16, 180–195.
[15] Miller, W. H., Griffin, C. E., & Campbell, K. (2012). Muller & Kirk’s small animal dermatology, Muller & Kirk’s small animal dermatology. Saunders.
[16] Nwufoh, O. C., Sadiq, N. A., Fagbohun, O., Adebiyi, A., Adeshina, R., Emmanuel, E., & Emikpe, B. O. (2021). Molecular detection and characterization of Sarcoptes scabiei var canis using skin scrapings and skin biopsies. Journal of Parasitic Diseases, 45, 258–262.
[17] Chen, Y. Z., Liu, G. H., Song, H. Q., Lin, R. Q., Weng, Y. B., & Zhu, X. Q. (2014). Prevalence of Sarcoptes scabiei infection in pet dogs in Southern China. Scientific World Journal, 2014, 718590.
[18] Mueller, R. S. (2005). Superficial mites in small animal dermatology. In SCIVAC – International Congress – Rimini, 2005. IVIS.
[19] Escobar, L. E., Carver, S., Cross, P. C., Rossi, L., Almberg, E. S., Yabsley, M. J., Niedringhaus, K. D., Van Wick, P., Dominguez‐Villegas, E., Gakuya, F., Xie, Y., Angelone, S., Gortázar, C., & Astorga, F. (2022). Sarcoptic mange: An emerging panzootic in wildlife. Transboundary and Emerging Diseases, 69, 927–942.
[20] Colombo, M., Morelli, S., Sacra, M., Trezza, G., Paoletti, B., Traversa, D., & Di Cesare, A. (2023). An uncommon and severe clinical case of Sarcoptes scabiei infestation in a cat. Pathogens, 12, 0–5.
[21] Hawkins, J. A., McDonald, R. K., & Woody, B. J. (1987). Sarcoptes scabiei infestation in a cat. Journal of the American Veterinary Medical Association, 190, 1572–1573.
[22] Hardy, J. I., Fox, M. T., Loeffler, A., & Sinclair, G. (2012). Feline sarcoptic mange in the UK: A case report. The Veterinary Record, 171, 351–351.
[23] Kołodziej‐Sobocińska, M., Zalewski, A., & Kowalczyk, R. (2014). Sarcoptic mange vulnerability in carnivores of the Białowieża Primeval Forest, Poland: Underlying determinant factors. Ecological Research, 29, 237–244.
[24] Arlian, L. G., & Vyszenski‐Moher, D. L. (1988). Life cycle of Sarcoptes scabiei var. canis. Journal of Parasitology, 74, 427–430.
[25] Mörner, T. (1992). Sarcoptic mange in Swedish wildlife. Revue Scientifique Et Technique (International Office of Epizootics), 11, 1115–1121.
[26] Toops, E., & Kennis, R. (2007). Sarcoptic mange in dogs. Standard of Care Emergency and Critical Care Medicine, 9, 7–10.
[27] Næsborg‐Nielsen, C., Wilkinson, V., Mejia‐Pacheco, N., & Carver, S. (2022). Evidence underscoring immunological and clinical pathological changes associated with Sarcoptes scabiei infection: Synthesis and meta‐analysis. BMC Infectious Diseases, 22, 658(2022).
[28] Kumar, S. N., Jabakumar, K. A., Ram, S. J., Sreekanth, G. N. V, & Kumar, V. J. A. (2023). A review on zoonotic Sarcoptes . The Pharma Innovation Journal, 12, 497–501.
[29] Hardy, J. I., Fox, M. T., Loeffler, A., & Sinclair, G. (2012). Feline sarcoptic mange in the UK: A case report. The Veterinary Record, 171, 351–351.