
| 一般情况 | |
|---|---|
 | 品种:布列塔尼犬 |
| 年龄:5岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:肝上皮样血管内皮瘤 | |
01 主诉及病史
因发现左侧甲状腺结节就诊。
02 检查
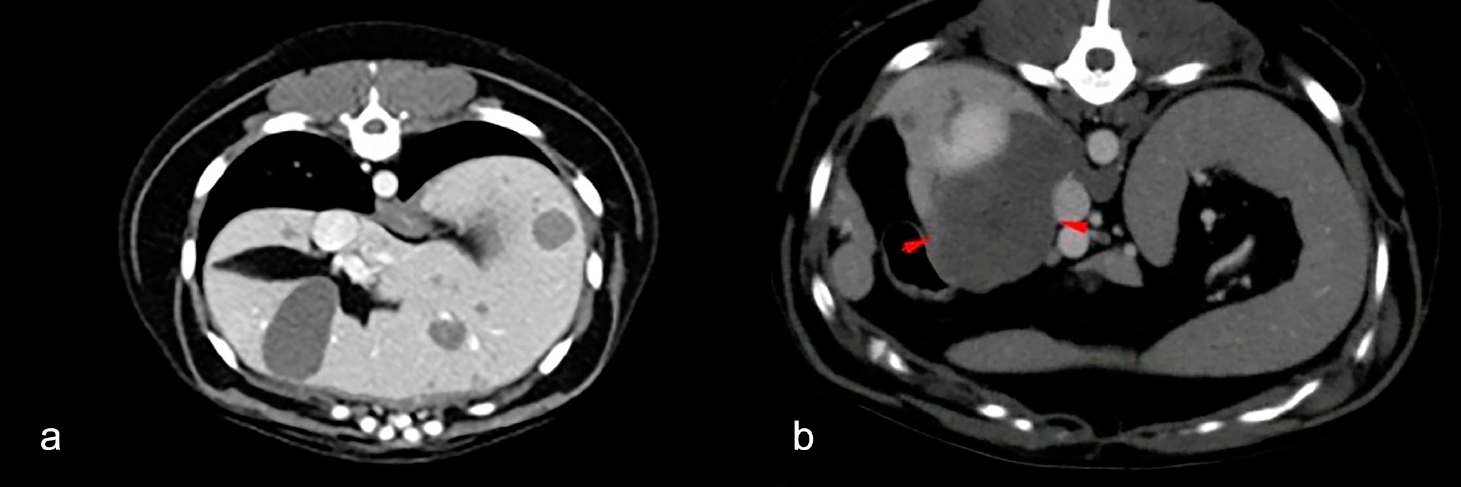
腹部触诊无异常。全身CT扫描在左甲状腺叶处发现了一个边缘光滑、椭圆形、体积为3.8×3×2.4 cm占位性病变。该病变在气管的邻近部分没有尖锐的脂肪劈裂面,在普通扫描中与颈部肌肉呈等低强化,在对比扫描中呈异质强化。没有证据显示血管受侵。
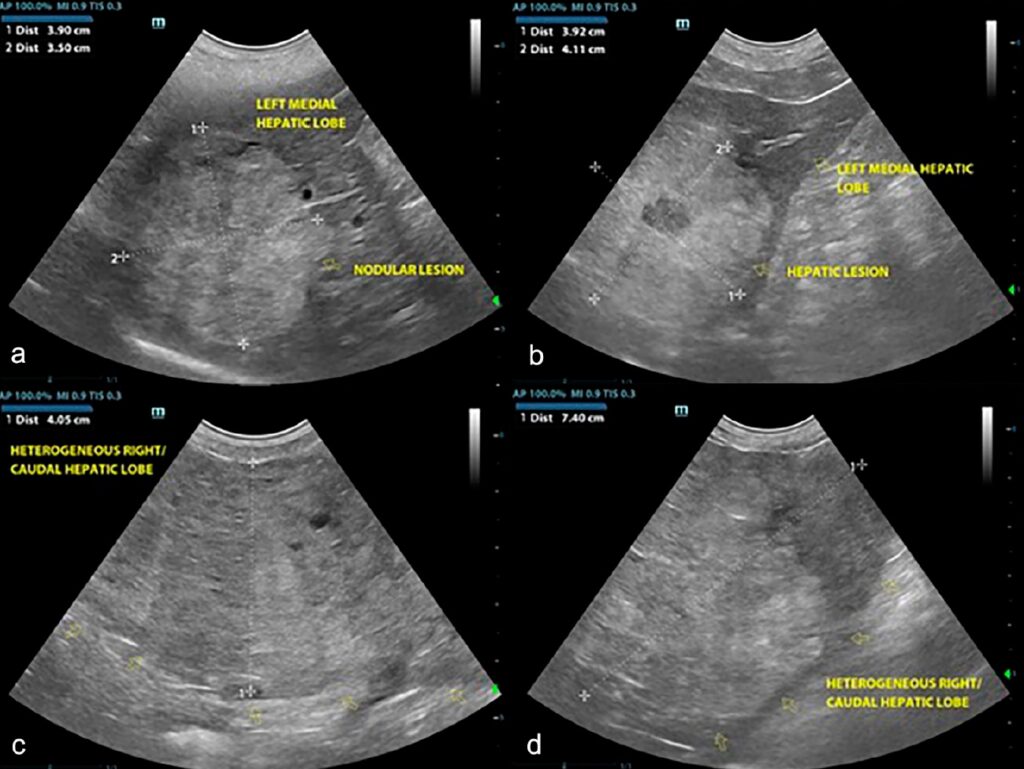
CT扫描还发现了多灶性、大小不一的肝结节(下图a),其中最大的结节位于尾状叶的尾突处,长4.6 cm,在普通扫描下与肝实质呈等强化,在对比后扫描中呈弱强化(下图b)。
在超声引导下,对肝脏病变部位进行细针穿刺细胞学检查,结果显示样本细胞不完整,呈血性,无法确诊。
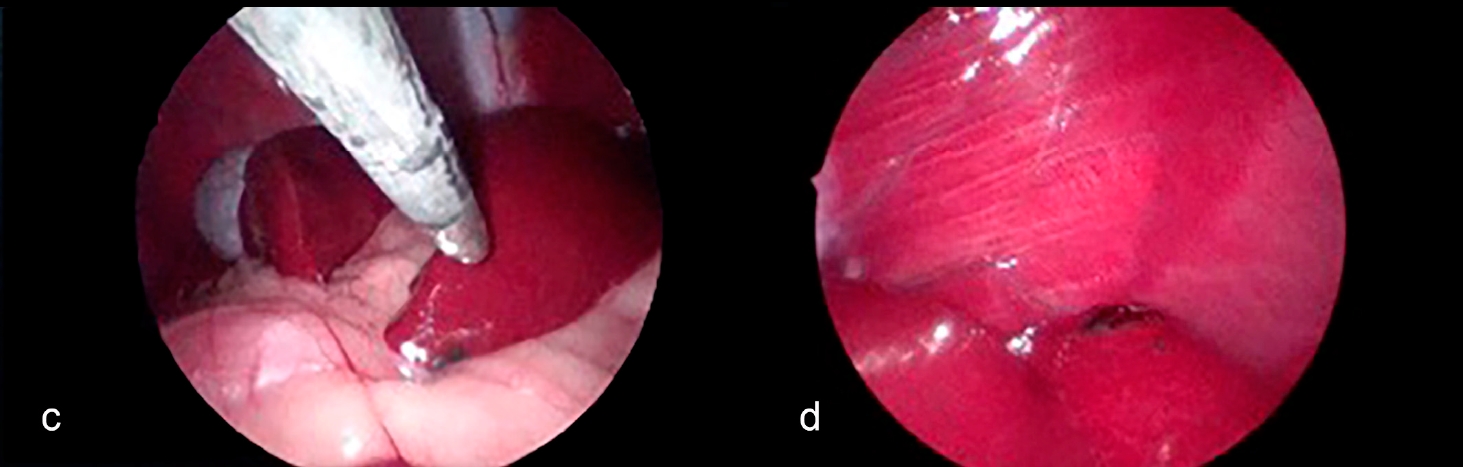
腹腔镜检查发现,肝脏病变为多灶、暗红色、实质内结节,涉及多个肝叶(下图cd)。
03 手术
进行了甲状腺切除术和腹腔镜手术,并进行了肝活检。在腹中线开两个5 mm孔。将犬向两侧倾斜以充分探查肝脏,然后用一个5 mm的杯状镊子采集肝组织。手术过程中没有出血。
病理结果显示,甲状腺结节符合滤泡状紧凑型甲状腺癌,有浸润性囊肿侵犯和血管内肿瘤栓子。
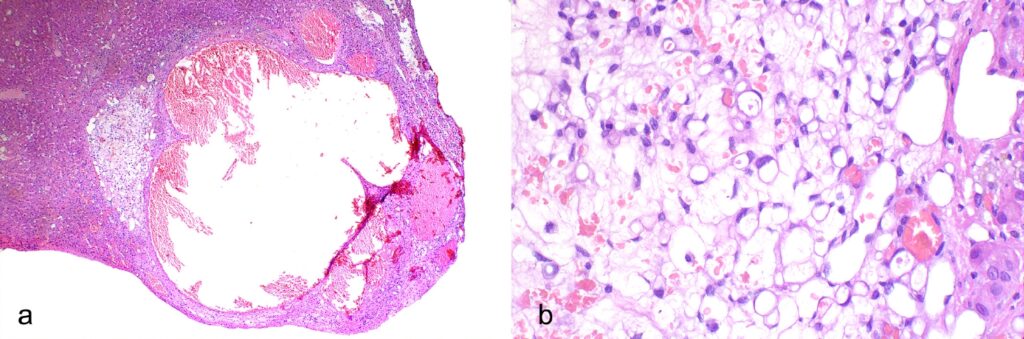
肝实质由一个多灶、分界不清、无包膜的增生物撑大,由单层平滑的纺锤形细胞构成的肝腔隙内衬(下图a),可解释为异位和充血的血管。血管管腔内局部可见血栓形成。在异位血管结构的旁边,有成群或单个的多角形上皮样细胞,嵌入中等量的肌样水肿基质中(下图ab)。细胞大小为20-30 μm,有适量的透明细胞质,有一个大的单液泡,将细胞核置换到细胞外围(印戒状),偶尔含有红细胞(微腔形成)。细胞核呈椭圆形或扁平状。无细胞和无核分裂为中度,未观察到有丝分裂(下图b)。
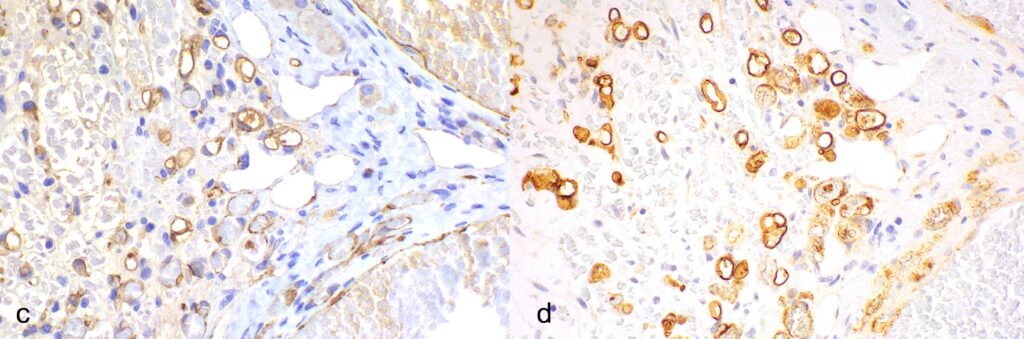
印戒和微腔形成细胞以及血管裂隙边缘细胞呈弥漫性阳性,CD31呈强膜状免疫标记(下图c),FVIII-RA呈强细胞质-膜状免疫标记(下图d)。最终诊断结果为肝上皮样血管内皮瘤。
04 预后
每两个月接受一次监测,没有接受药物治疗。腹腔镜手术后的前6个月,超声检查显示肝脏病变稳定,但随后肝结节逐渐增大,并在20个月的随访中再次趋于稳定。在此期间,血常规和临床状况稳定。
27个月时的超声检查显示疾病进一步恶化(下图),病变的数量增加,尤其是已经出现的病变的大小。
该犬开始服用沙利度胺,这是一种抗血管生成的化合物,每天的剂量为8 mg/kg。36个月后,没有出现临床症状,所有检查结果均正常。
05 讨论
增生性血管疾病包括血管畸形、反应性增生和血管肿瘤[1]。血管畸形是指血管结构异常,如动静脉畸形、毛细血管扩张、反应性血管瘤病和血管瘤[1]。其他被认为是反应性的罕见血管疾病包括猫反应性血管内皮瘤病和乳头状内皮增生症。
血管肿瘤包括良性肿瘤(血管瘤)、中间型肿瘤(血管内皮瘤)和恶性肿瘤(血管肉瘤)。其中,血管内皮瘤在大多数物种中都很罕见,偶尔也有在狗的皮肤、脾脏、肺和脑中出现[4-9]。不同的显微镜下变型也有报道,包括上皮样型、网状型和卡波西状型[1,6,7,9]。
原发性肝上皮样血管内皮瘤是一种不常见的肿瘤,发病率低于每10万人中0.1例[10,11]。肝上皮样血管内皮瘤多发于中年女性,大体上可分为单发型、多发型和弥漫型[12]。
由于这种肿瘤的罕见性,其预后和分子背景的特征仍不十分明确[11]。既往研究发现,WWTR1-CAMTA1是人类上皮样血管内皮瘤中的一种复发性突变,与肿瘤部位无关。所涉及的基因具有转录共激活因子和肿瘤抑制基因的功能,其突变被认为会导致肿瘤发生[13]。
根据人类WHO分类[15],肝血管内皮瘤是一种恶性内皮肿瘤,由上皮样细胞组成,嵌入肌透明或纤维基质,常有微腔形成。这只狗的显微镜特征与人类患者的特征相似[10,15]。
此外,在本病例中,肿瘤细胞通常有一个大的胞浆空泡,偶尔含有红细胞,并浸泡在类肌基质中。这种形态被解释为微腔的形成,这是典型的血管内皮瘤的特征,通过发现腔内红细胞和内皮标志物CD31和FVIII-RA的阳性免疫标记得到了证实,正如在人类中细胞被内皮标志物CD31、CD34、FVIII-RA、podoplanin和ERG标记所描述的那样[10,15]。
在人体中,肝血管内皮瘤的鉴别诊断包括胆管癌、转移性印戒细胞癌和肝细胞癌的硬化变异型[11,16]。免疫组化有助于鉴别和确认血管内皮瘤的内皮起源。
在人类中,上皮样血管内皮瘤可能会被误诊为血管肉瘤,但其典型的形态学特征应引导病理学家做出正确诊断,因为血管肉瘤具有与血管内皮瘤相反的严重不典型性、核多形性和高有丝分裂活性[11]。
因此,即使在狗身上,免疫组化也只能用于确认肿瘤的内皮来源。要区分血管内皮瘤和血管肉瘤,必须仔细评估组织学特征。事实上,在本病例中,细胞不典型性、核多形性和有丝分裂活性等特征极少,与犬血管肉瘤典型的恶性形态特征并不相似。
狗可能会患上多种恶性肿瘤,与品种和性别无关。一项研究报告了一个有趣的发现:33%患有甲状腺癌的狗,如本病例中的狗,还患有其他肿瘤[18]。因此,必须进行全面检查。
在人类中,血管内皮瘤的存活率不一,从无症状到进展,很少发生转移[10,15]。考虑到这些不可预测的行为,目前还没有关于人类肝上皮样血管内皮瘤的预后和治疗的标准指南[11]。治疗选择非常广泛,包括化疗、手术和肝移植[11,14]。然而,人们普遍认为,在采用更具侵袭性的疗法之前,应先进行单纯的临床观察,以评估肿瘤的表现,因为如果肿瘤没有侵袭性,疾病会自发消退或趋于稳定,因此应避免过度治疗[11]。
在这只狗身上,肿瘤的病程稳定了6个月,随后病灶增大(6至27个月),随后又趋于稳定。36个月后,患者无任何症状,临床状况良好,这与人类医学中某些病例的情况类似[11]。
总之,本报告描述了首例犬肝血管内皮瘤病例。本报告中的肿瘤表现出长期的病情稳定,在随访的第36个月无明显症状或疾病进展。
文献来源:Muscatello LV, Massari F, Roccabianca P, Sarli G, Benazzi C, Bianchi ML. Hepatic Epithelioid Hemangioendothelioma in a Dog. Animals (Basel). 2024 Apr 25;14(9):1302.
参考文献
1. Marr J., Miranda I.C., Miller A.D., Summers B.A. A Review of Proliferative Vascular Disorders of the Central Nervous System of Animals. Vet. Pathol. 2021;58:864–880.
2. Fuji R.N., Patton K.M., Steinbach T.J., Schulman F.Y., Bradley G.A., Brown T.T., Wilson E.A., Summers B.A. Feline systemic reactive angioendotheliomatosis: Eight cases and literature review. Vet. Pathol. 2005;42:608–617.
3. Godizzi F., Caniatti M., Treggiari E., Romanelli G., Bonfanti U., Ghisleni G., Roccabianca P. Extravascular papillary endothelial hyperplasia mimicking soft tissue sarcoma in 2 cats: A potential diagnostic pitfall. J. Vet. Diagn. Investig. 2022;34:552–557.
4. Machida N., Arimura T., Otagiri Y., Kiryu K., Oka T. Epithelioid Haemangioendothelioma of the Lung in a Dog. J. Comp. Pathol. 1998;119:317–322.
5. Pires I., Queiroga F.L., Silva F., Pinto C., Lopes C. Kaposi-like vascular tumor of the urinary bladder in a cow. J. Vet. Med. Sci. 2009;71:831–833.
6. Pounden W.D., Sprunger E. Malignant hemangioendothelioma of a canine spleen. N. Am. Vet. 1947;28:461.
7. Roccabianca P., Schulman Y., Avallone G., Foster R., Scruggs J., Dittmer K. In: Surgical Pathology of Tumors of Domestic Animals. Volume 3: Tumors of Soft Tissue. Kiupel M., editor. Davis-Thompson DVM Foundation; Gurnee, IL, USA: 2020.
8. Vincek V., Zaulyanov L., Mirzabeigi M. Kaposiform hemangioendothelioma: The first reported case in a nonhuman animal species. Vet. Pathol. 2004;41:695–697.
9. Yaman T., Uyar A., Keles O.F., Yener Z. Epithelioid and spindle-cell haemangioendothelioma in the brain of a dog: A case report. Vet. Med. 2018;63:193–197.
10. Lefkowitch J.H. Lefkowitch JHBT-SLBI. 10th ed. Elsevier; Amsterdam, The Netherlands: 2021. Neoplasms and Nodules; pp. 205–267.
11. Virarkar M., Saleh M., Diab R., Taggart M., Bhargava P., Bhosale P. Hepatic hemangioendothelioma: An update. World J. Gastrointest. Oncol. 2020;12:248–256.
12. Kou K., Chen Y.G., Zhou J.P., Sun X.D., Sun D.W., Li S.X., Lv G.Y. Hepatic epithelioid hemangioendothelioma: Update on diagnosis and therapy. World J. Clin. Cases. 2020;8:3978–3987.
13. Errani C., Zhang L., Sung Y.S., Hajdu M., Singer S., Maki R.G., Healey J.H., Antonescu C.R. A novel WWTR1-CAMTA1 gene fusion is a consistent abnormality in epithelioid hemangioendothelioma of different anatomic sites. Genes Chromosomes Cancer. 2011;50:644–653.
14. Mascarenhas R.C.V., Sanghvi A.N., Friedlander L., Geyer S.J., Beasley H.S., Van Thiel D.H. Thalidomide inhibits the growth and progression of hepatic epithelioid hemangioendothelioma. Oncology. 2004;67:471–475.
15. Hornick J. The WHO Classification of Tumours. International Agency for Research on Cancer; Lyon, France: 2019. Digestive System Tumours.
16. Mehrabi A., Kashfi A., Fonouni H., Schemmer P., Schmied B.M., Hallscheidt P., Schirmacher P., Weitz J., Friess H., Schmidt J., et al. Primary malignant hepatic epithelioid hemangioendothelioma: A comprehensive review of the literature with emphasis on the surgical therapy. Cancer. 2006;107:2108–2121.
17. Griebie E.R., David F.H., Ober C.P., Feeney D.A., Anderson K.L., Wuenschmann A., Jessen C.R. Evaluation of canine hepatic masses by use of triphasic computed tomography and B-mode, color flow, power, and pulsed-wave Doppler ultrasonography and correlation with histopathologic classification. Am. J. Vet. Res. 2017;78:1273–1283.
18. Rebhun R.B., Thamm D.H. Multiple distinct malignancies in dogs: 53 cases. J. Am. Anim. Hosp. Assoc. 2010;46:20–30.