
| 一般情况 | |
|---|---|
 | 品种:斗牛梗 |
| 年龄:6岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:颌面区域慢性感染 | |
01 主诉及病史
因颌面区域慢性感染和多处瘘道就诊。3年前面部出现开放性伤口、口腔有恶臭味以及厌食。
该犬在多家医院接受了治疗,对口腔外和口腔内的病灶进行了探查,并多次取出外植入物。医生尝试了初级封闭和放置引流管相结合的方法,采集了样本进行微生物培养测试,并根据培养结果开出了镇痛和抗菌治疗处方。
在3年的治疗过程中,使用过以下抗菌药物:阿莫西林/克拉维酸、氨苄西林、阿米卡星、头孢霉素、头孢氨苄、米诺环素和奥比沙星。由于病变的性质、大小和向深层组织的侵袭逐渐恶化,该犬被再次转诊。
02 检查
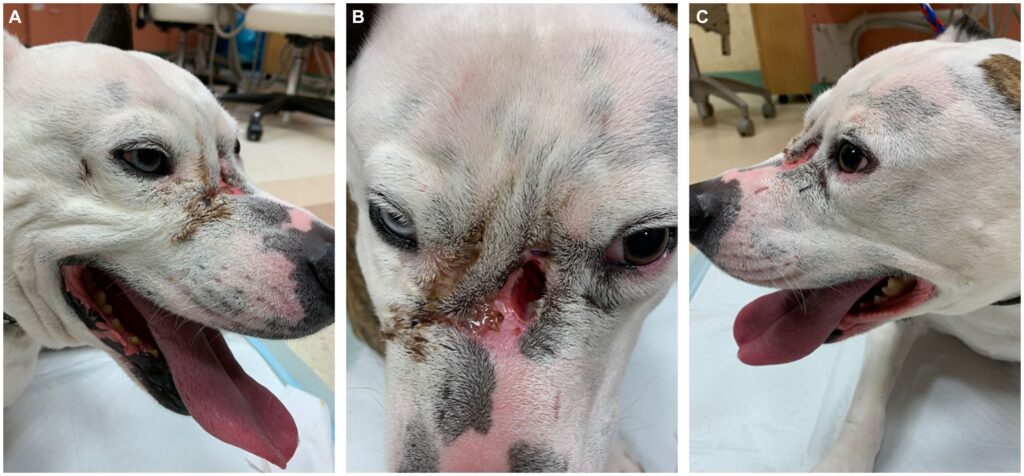
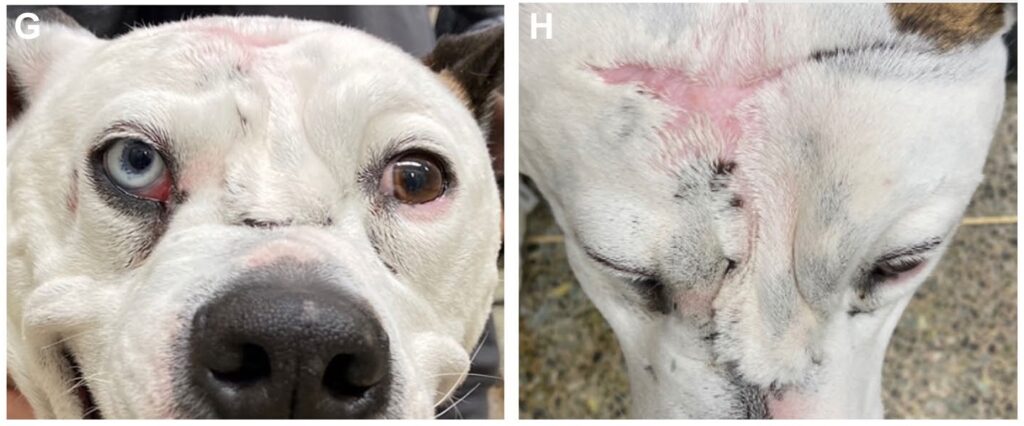
鼻梁上发现了一个大的瘘道(20×20 mm),影响到额骨、鼻骨和上颌骨。在左眼腹侧、右眼外侧、两眼之间和右眼内侧还发现了四条约4×4 mm的皮肤瘘道(下图)。
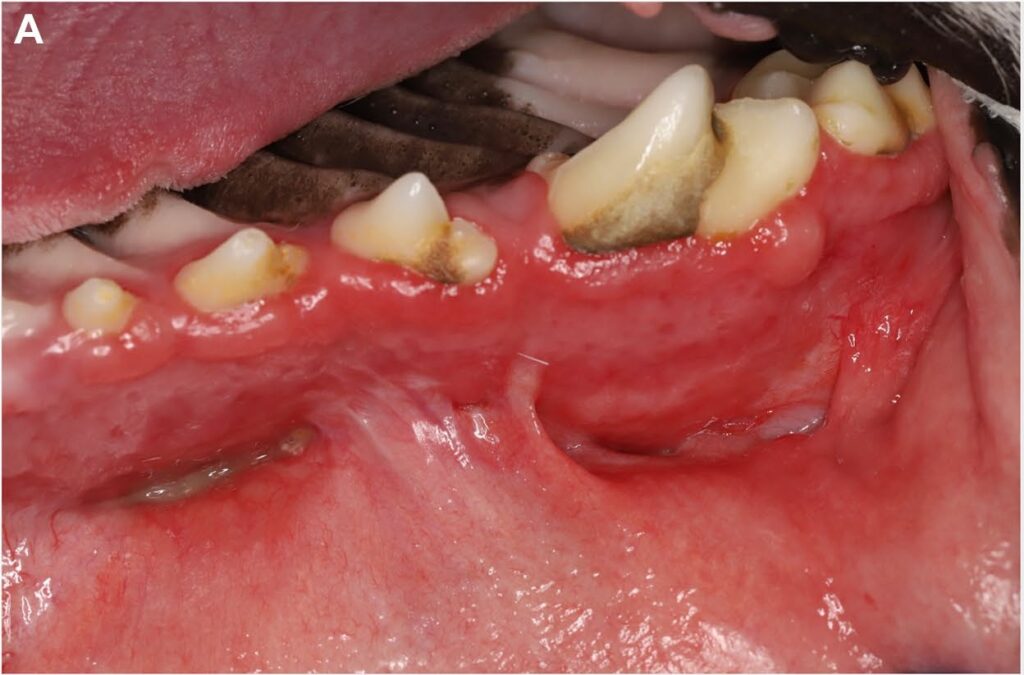
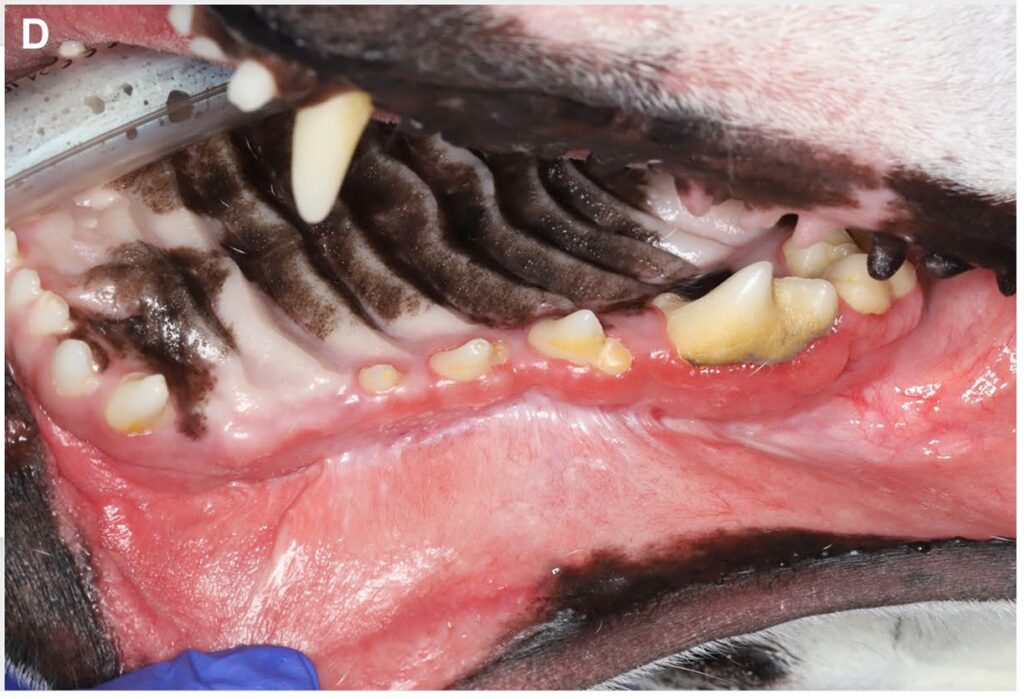
口腔内部检查发现,口鼻瘘管从右上颌犬齿延伸至右上颌第四前臼齿(下图)。右上颌颊侧保持完好。多条瘘道周围有粘液脓性分泌物和结痂。双侧下颌淋巴结肿大。
体格检查发现白内障伴核硬化、虹膜萎缩、虹膜异色。血液学评估显示白细胞增多(14900/μL [6000-13000]),并有轻度中性粒细胞增多(11507/μL [3000-10500])。血生化值在参考范围内。
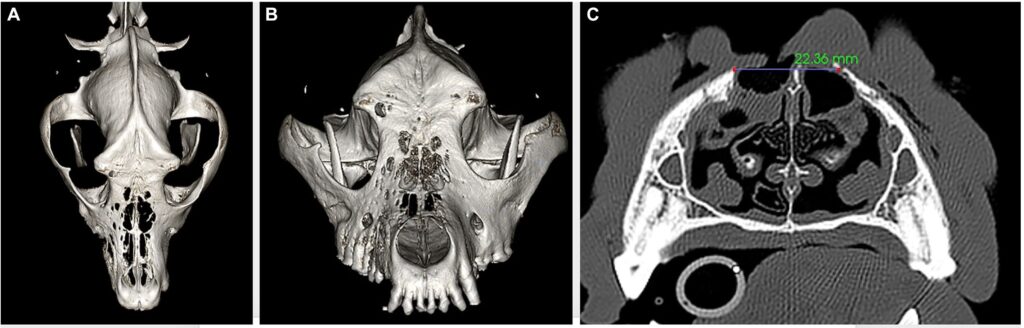
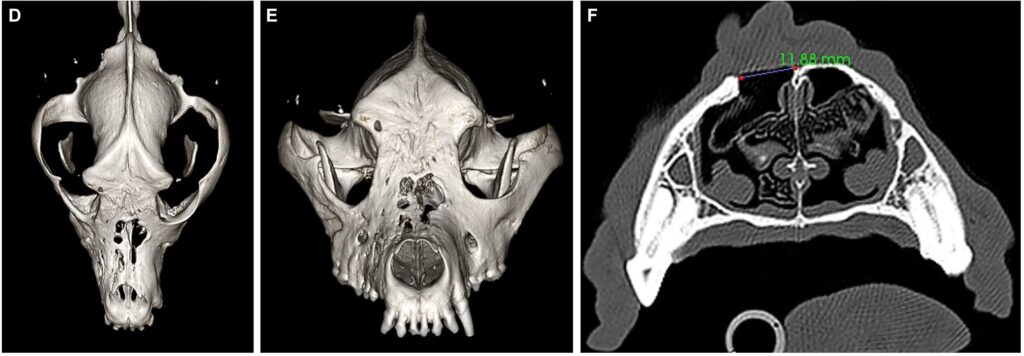
颅骨常规CT造影结果显示,多灶性至凝聚性透明骨质病变主要影响右侧上颌骨喙突的皮质骨(下图AB)。鼻骨、额骨和上颌骨均有大片瘘道,并与皮肤表面相通(下图C)。右侧额窦有一个轻度对比增强的软组织结构(可能是肿瘤或肉芽肿)。右下颌和内侧咽后淋巴结肿大。观察到严重的右颞下颌关节骨关节炎,可能是继发于以前的创伤或关节感染。
CT检查后进行了鼻内镜检查,结果证实了之前在CT上发现的大部分骨质和软组织病变。鼻内镜检查后,对病变部位进行了取样,以进行组织病理学评估以及微生物和真菌检测。放置了支架绷带并保持3天。出院时服用了镇痛药(卡泊芬 2.2 mg/kg PO q12h;加巴喷丁10 mg/kg PO q12h)和广谱抗菌药阿莫西林/克拉维酸(13.75 mg/kg PO q12h)。
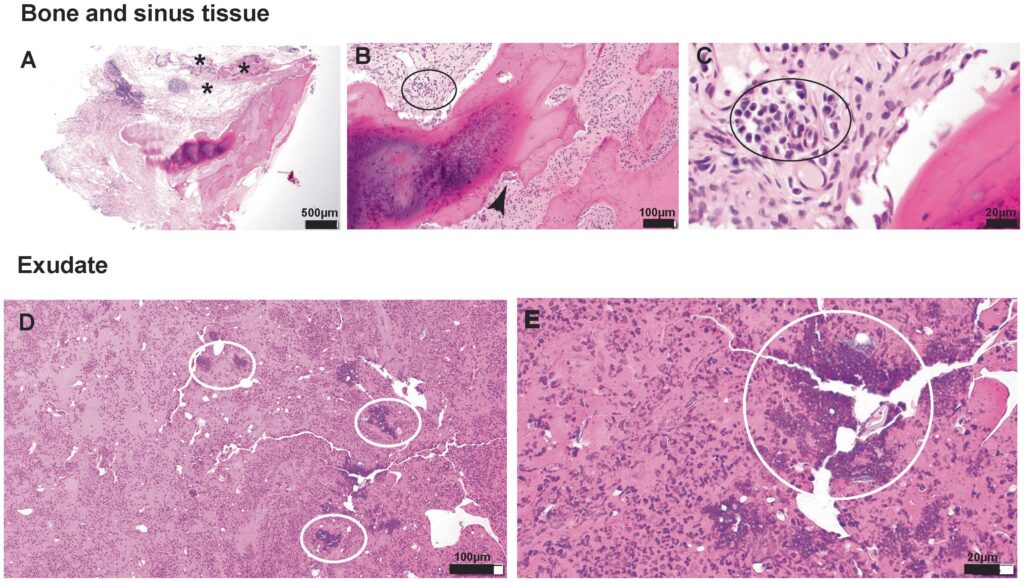
组织病理学发现,活检样本由带结痂的渗出物和与软组织相关的骨碎片组成(下图)。骨组织是片状骨(成熟骨)碎片,边缘多处有编织骨(未成熟骨)(下图A)。在没有成骨细胞的情况下,发现了由多核破骨细胞占据的多处吸收裂隙,表明骨质正在重塑(下图B)。未发现骨髓腔感染。结痂和渗出物中悬浮着大量完整和退化的中性粒细胞,其中混杂着细菌球菌菌落和类似植物和花粉的异物(下图C-E)。
与骨碎片相关的软组织包括疏松的纤维结缔组织,其中浸润着散在的淋巴细胞、浆细胞和圆形淋巴细胞簇(淋巴滤泡增生)。这种纤维结缔组织的内衬主要是假增生的柱状纤毛上皮,多处被鳞状上皮内衬取代,表明发生了鳞状化生。
微生物培养和药敏结果显示存在多重耐药的凝固酶阴性葡萄球菌,因此,抗菌治疗改为恩诺沙星(10 mg/kg PO q12h),持续4周。
03 手术
检查结果符合严重软组织感染以及额头、上颌和鼻腔区域广泛溶骨,导致多条口内和口外瘘道。外来植入材料的存在可能使愈合过程复杂化。在尝试重建手术之前,首先通过延长抗菌治疗将感染降至最低。
重建手术分两个阶段进行。首先,对较小的缺损使用推进皮瓣进行口外修复(下图A),并使用颞浅轴向模式皮瓣(下图B-D)修复面中部的大型瘘道。皮瓣基底位于颧弓水平。皮瓣的宽度接近颧弓的长度:眶尾缘是皮瓣的喙侧边界,颧弓的尾侧代表皮瓣的尾缘。皮瓣长度为相对眼眶背缘中部。皮瓣被抬高至额肌深处,以帮助保留额肌的血液供应。皮瓣从远端隆起,向基部推进。推进皮瓣吸收邻近松弛组织,线性移动以填充缺损。在深层使用4-0缝线简单间断缝合,在皮肤使用3-0缝线简单间断缝合,以缝合手术部位。
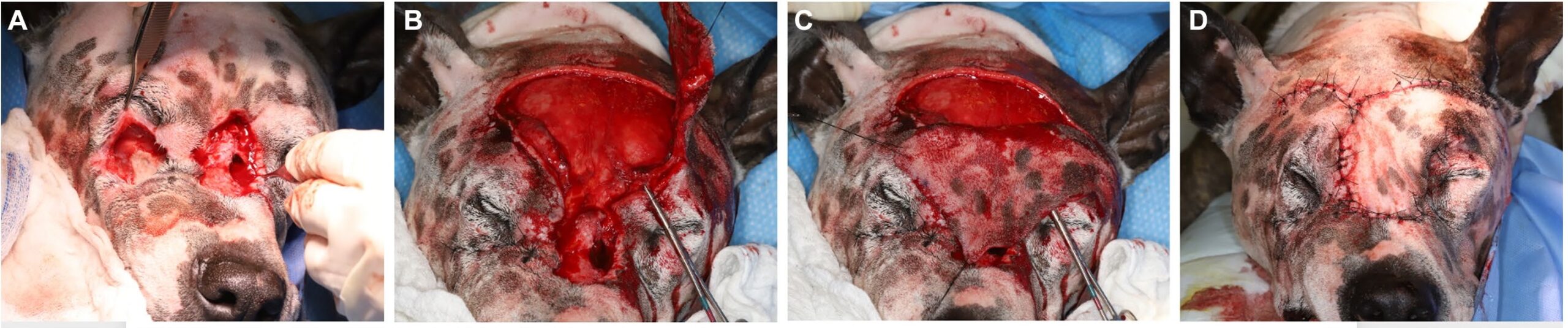
04 预后
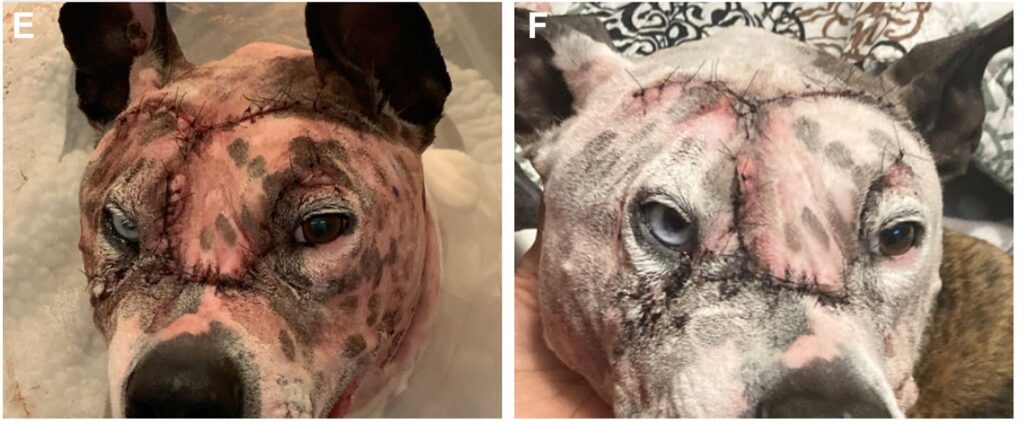
住院接受了2天的支持性护理,以观察皮瓣的初始活力(下图E)。主人报告说该犬在家表现良好,并获得了一张术后10天的照片(下图F)。
术后2周复查时,皮瓣愈合良好,缝线也已拆除。
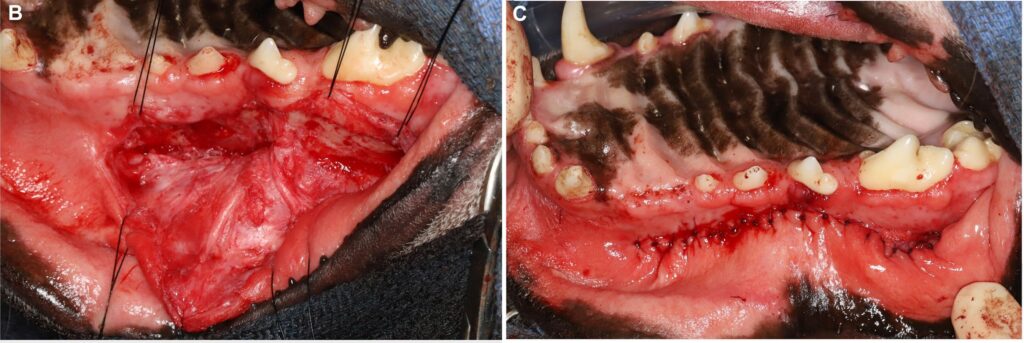
术后8周,该犬接受了第二阶段手术,以处理与鼻腔相通的口内瘘道,这些瘘道被认为是广泛的口鼻瘘管。为它进行了全面的口腔健康评估和治疗,包括全口X光检查。无需拔牙,并在封闭缺损前进行了牙周清洁。大块粘骨膜瓣被提起并被裁剪,以便进行无张力闭合(下图BC)。
6个月后,该犬接受了复查和CT评估。该犬在家中表现良好,之前修复的口鼻瘘和口外瘘没有开裂(下图)。
实验室检查结果都在参考范围内,之前发现的淋巴细胞增多症状已经缓解。全麻下接受了头颅CT复查,成像结果显示,修复和重塑过程顺利,小的骨缺损已愈合,上颌骨、鼻骨和额骨中央大的骨缺损也已大大缩小(下图)。
05 讨论
颌面部多条瘘道导致的感染相对较少见,部分原因可能是犬的颌面区域有丰富的血液供应和侧支循环[1],与身体其他部位相比不易感染。
源自口腔的微生物、皮肤或呼吸道的细菌侵入深层组织和骨骼附近通常会引起炎症,导致血管变化,包括但不限于血管扩张、血栓形成、内皮损伤、血清渗入血管外空间、自由基释放和多形核细胞外渗[2]。这些变化反过来又可能导致软组织和骨骼的缺血性损伤,并可能表现为单个或多个区域的骨溶解和瘘管。
细菌的引入可能源于创伤、骨外科手术、菌血症或毗邻的感染灶,降低犬先天防御功能的全身性疾病也会进一步促进细菌的引入[3]。这些疾病包括糖尿病、贫血、免疫抑制和营养不良[4-6]。
免疫抑制的原因包括但不限于化疗、糖皮质激素和环孢素治疗或可能削弱免疫系统的潜在疾病,如淋巴瘤和免疫介导的中性粒细胞减少症。辐射、恶性肿瘤和双膦酸盐等药物都可能导致骨骼供血减少,从而容易引起感染和坏死[3,7,8]。
颌面部慢性感染是一种以软组织炎症为特征的病症,可能涉及颅骨、面部和/或上颌骨的感染。颌面软组织感染和多发性溶骨性病变,包括颌面区域广泛的瘘道,由于其复杂的解剖结构和对重建能力的潜在影响,处理起来尤其具有挑战性,会造成轻微到严重的毁容[3]。
报道最多的人类颌面感染致病菌是金黄色葡萄球菌、链球菌和厌氧菌[12,13]。感染的来源多种多样,如牙科感染、鼻窦炎、外伤、手术或身体其他部位的感染扩散[3,12,13]。
在本病例中,上述原因被认为是导致临床表现的综合因素。首先,未知的历史创伤可能造成了病变。其次,外来植入材料被多次取出,这些植入材料损害了伤口的愈合能力,很可能加剧了感染过程。第三,这只狗接受了多次手术,每次手术都会影响血液供应并延迟伤口愈合。
因此,兽医选择了一种更积极的修复技术,使用一个大的轴向皮瓣来获得新的血液供应,以关闭更大的缺损并帮助愈合过程。最后,该犬接受了大量不同的抗菌药物治疗。这可能是在药敏试验中发现耐多种药物的阴性凝固酶葡萄球菌的原因。抗菌药耐药性是全球威胁人类和动物健康的最重要问题之一[14]。
要对急性或慢性感染患者采取完整的治疗方案,就必须对颅面区域进行功能成像[3,12,13]。CT和MRI可用于早期发现病情[15]。在检测颌面骨髓炎时,骨闪烁成像比CT扫描更准确[15]。CT可显示骨侵蚀、溶解或重塑,可能会与骨髓炎或肿瘤过程相混淆。
由于该犬的病程较长,因此选择将CT造影等先进的成像技术与内窥镜检查相结合,以观察所有可能的病变,并获取样本进行进一步分析。内窥镜检查是在CT成像之后进行的,以避免因操作内窥镜而造成组织变化。锥形束CT的缺点是在评估软组织病变方面有局限性,因为它缺乏对比度分辨率和HU[16]。只有当骨骼受累时,才可考虑锥形束CT,但仍被认为不如传统CT[17]。
根据该犬的病史、临床表现和影像诊断结果,该病被认为是慢性病。为了优化治疗效果,兽医选择了分阶段手术。首先,根据药敏结果提供长期抗菌药物治疗,以尽量减少细菌负担。其次,先采用口外重建方法,理由是任何残留的感染和坏死组织都可以继续从最低点引流,因为感染性疾病过程往往会沿着阻力最小的路径发展[18]。在这只狗身上,口腔内瘘道被认为是所有病变的最低点,因此后期再进行修复。
大面积面部缺损的重建通常需要使用局部轴向皮瓣,如尾耳皮瓣、颞浅皮瓣或角或肌皮轴向皮瓣[9-11]。小到中等程度的面部缺损可以用局部推进皮瓣或转位皮瓣来缝合[10]。颞浅层轴向皮瓣用于治疗面中部的大面积缺损,局部推进皮瓣用于治疗其余的缺损,这两种方法结合使用,成功地关闭了病灶。
在口腔内缺损感染性渗出物持续引流消退后,用局部粘膜前移皮瓣修复了口鼻缺损[10]。本病例的成功治疗基于口内和口外手术部位的愈合,并通过重复CT成像确认,CT成像记录了修复和重塑的骨质病变以及完整的上覆软组织。
文献来源:Wolfs E, Kot CCS, Vapniarsky N, Arzi B. Case report: Management of generalized infection and draining tracts of the frontomaxillary region in a dog. Front Vet Sci. 2024 Feb 16;11:1343039.
参考文献
1. Hermanson JW, De Lahunta A. Miller and Evans’ anatomy of the dog. 5th ed. St. Louis, MO: Elsevier; (2020) 510–527.
2. Strumas N, Antonyshyn O, Caldwell C, Mainprize J. Multimodality imaging for precise localization of craniofacial osteomyelitis. J Craniofacial Surg. (2003) 14:215–9.
3. Prasad C, Mouli N, Agarwal S, Chandra Prasad K, Chandra PS. Osteomyelitis in the head and neck. Acta Otolaryngol. (2007) 127:194–205.
4. Gaffen SL, Herzberg MC, Taubman MA, Van Dyke TE. Recent advances in host defense mechanisms/ therapies against oral infectious diseases and consequences for systemic disease. Adv Dent Res. (2014) 26:30–7.
5. Walker A. Host defense mechanisms in the gastrointestinal tract. Pediatrics. (1976) 57:901–16.
6. Fowler E, Breault LG, Cuenin MF. Periodontal disease and its association with systemic disease. Mil Med. (2001) 166:85–9.
7. Peralta S, Arzi B, Nemec A, Lommer MJ, Verstraete FJM. Non-radiation-related osteonecrosis of the jaws in dogs: 14 cases (1996–2014). Front Vet Sci. (2015) 2:e7.
8. Nemec A, Arzi B, Hansen K, Murphy BG, Lommer MJ, Peralta S. Osteonecrosis of the jaws in dogs in previously irradiated fields: 13 cases (1989–2014). Front Vet Sci. (2015) 2:e5.
9. Smith MM. Advanced maxillofacial reconstruction techniques, Verstraete FJM, Lommer MJ, Arzi B, (Eds.) Oral and maxillofacial surgery in dogs and cats, 2nd ed. St. Louis, MO: Elsevier; (2020). 487–494.
10. Guzu M, Rossetti D, Hennet PR. Locoregional flap reconstruction following oromaxillofacial oncologic surgery in dogs and cats: a review and decisional algorithm. Front Vet Sci. (2021) 8:685036.
11. Pavletic MM. Axial pattern skin flaps. Atlas Small Anim Wound Manag Reconstruct Surg. (2018) 39:417–61.
12. Mortazavi MM, Khan MA, Quadri SA, Suriya SS, Fahimdanesh KM, Fard SA. Cranial osteomyelitis: a comprehensive review of modern therapies. World Neurosurg. (2018) 111:142–53.
13. Pincus DJ, Armstrong MB, Thaller SR. Osteomyelitis of the craniofacial skeleton. Semin Plast Surg. (2009) 23:73.
14. Palma E, Tilocca B, Roncada P. Antimicrobial resistance in veterinary medicine: an overview. Int J Mol Sci. (2020) 21:1914.
15. Chapman PR, Choudhary G, Singhal A. Skull base osteomyelitis: a comprehensive imaging review. Am J Neuroradiol. (2021) 42:404–13.
16. Posadzy M, Desimpel J, Vanhoenacker F. Cone beam CT of the musculoskeletal system: clinical applications. Insights Imaging. 9:35–45.
17. Slieker FJB, Van Gemert JTM, Ghafoori Seydani M, Farsai S, Breimer GE, Forouzanfar T. Value of cone beam computed tomography for detecting bone invasion in squamous cell carcinoma of the maxilla. Oral Surg Oral Med Oral Pathol Oral Radiol. (2022) 134:102–9.
18. Beasley DJ, Amedee RG. Deep neck space infections. J La State Med Soc. (1995) 147:181–4.