
| 一般情况 | |
|---|---|
 | 品种:暹罗猫 |
| 年龄:5岁 | |
| 性别:未知 | |
| 是否绝育:未知 | |
| 诊断:术后感染 | |
01 主诉及病史
意外高坠后就诊,诊断为双后腿多处粉碎性骨折,周围软组织受损,随后接受了关节内固定、清创和冲洗手术(下图)。
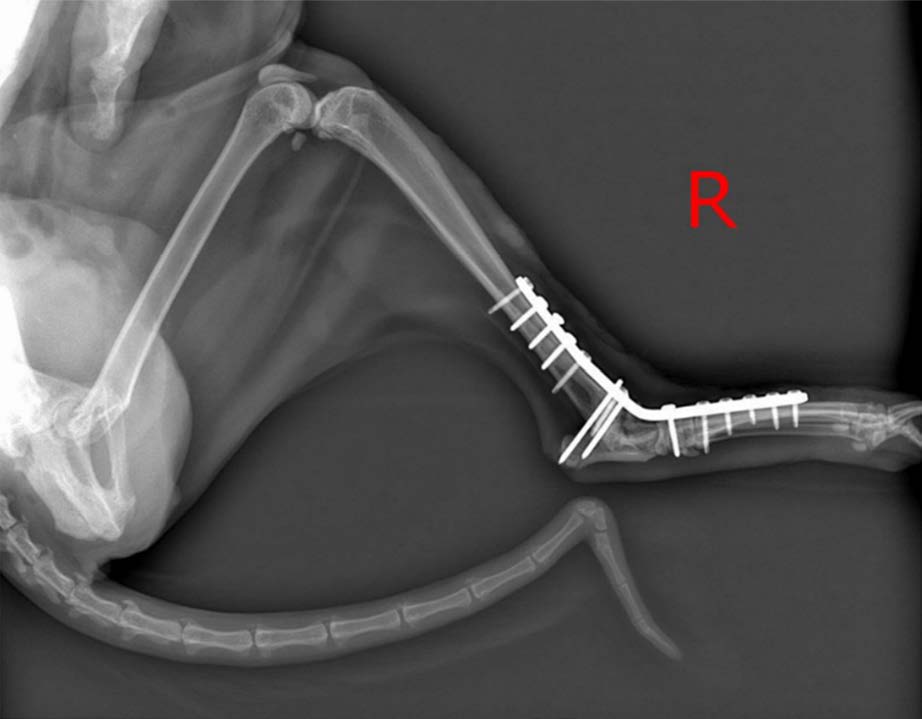
术后2周,左后腿坏死导致截肢,右后腿出现铜绿假单胞菌感染。术后4个月,尽管使用了阿莫西林、马波沙星、强力霉素、头孢霉素和阿奇霉素等多种抗生素治疗,但感染依然存在。在整个抗生素治疗过程中,手术伤口一直处于开放状态,金属植入物清晰可见。
02 治疗
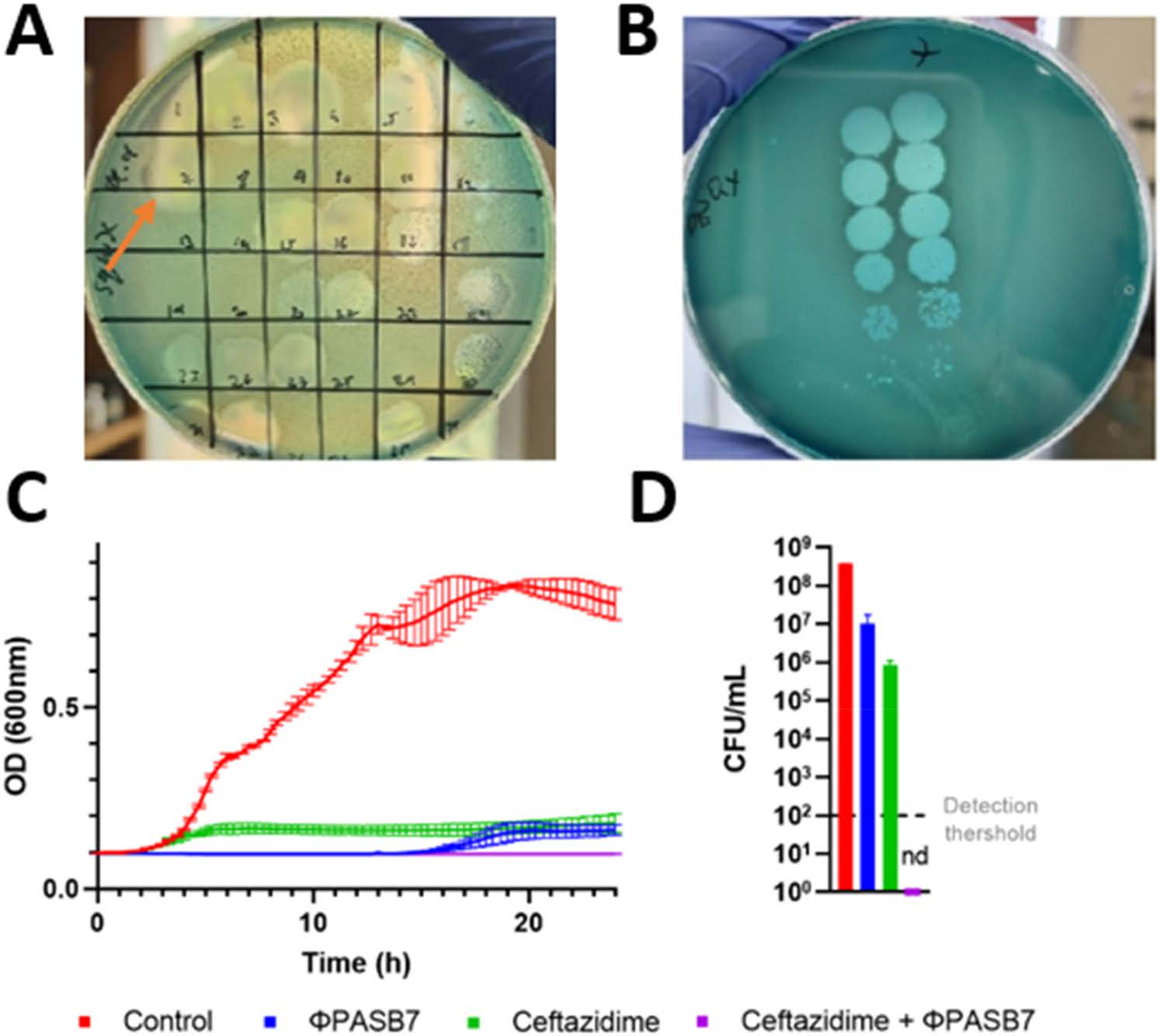
对噬菌体库收集的抗假单胞菌噬菌体进行初步筛选后发现,有17种噬菌体对病原体有抑制作用(下图A)。在这17个噬菌体中,选择了ΦPASB7噬菌体进行进一步分析,因为它在斑块试验中显示出良好的溶菌活性。进一步检测发现,滴度高达10^9 PFU/mL(下图B)。在生长动力学试验中,ΦPASB7能够抑制病原体生长15小时,之后出现少量再生(下图C)。将ΦPASB7与头孢他啶联用进行测试,结果显示这两种药物具有协同作用,因为噬菌体-抗生素联用能够在24小时内消灭病原体(下图D)。
ΦPASB7是一种短尾抗铜绿假单胞菌噬菌体(下图A),于2022年从耶路撒冷喷泉采集的水样中分离出来。基因组分析将这种噬菌体归入裂殖病毒科。它的基因组由72,635个碱基对组成,是一种双链DNA结构,包括101个预测基因(下图B)。该噬菌体含有三个RNA聚合酶基因,还含有6个公认的结构基因,以及细胞膜破坏基因holin和spanin,两者都会导致细胞裂解。

将第一剂ΦPASB7噬菌体(1 mL,10^7 PFU/mL)局部涂抹在伤口上。间隔15分钟后,肌肉注射头孢他啶(30 mg/kg)。观察了30分钟,期间未出现任何不良反应。噬菌体和抗生素剂量均由主人按照兽医的指导在家中使用。噬菌体每天在更换绷带时使用两次,以最大限度地降低污染风险。每天使用四次头孢他啶。
03 预后
在治疗的第一周内,伤口处的分泌物迅速减少。7周后,伤口面积显著缩小(65%),几乎完全闭合,此时停止了治疗(下图)。
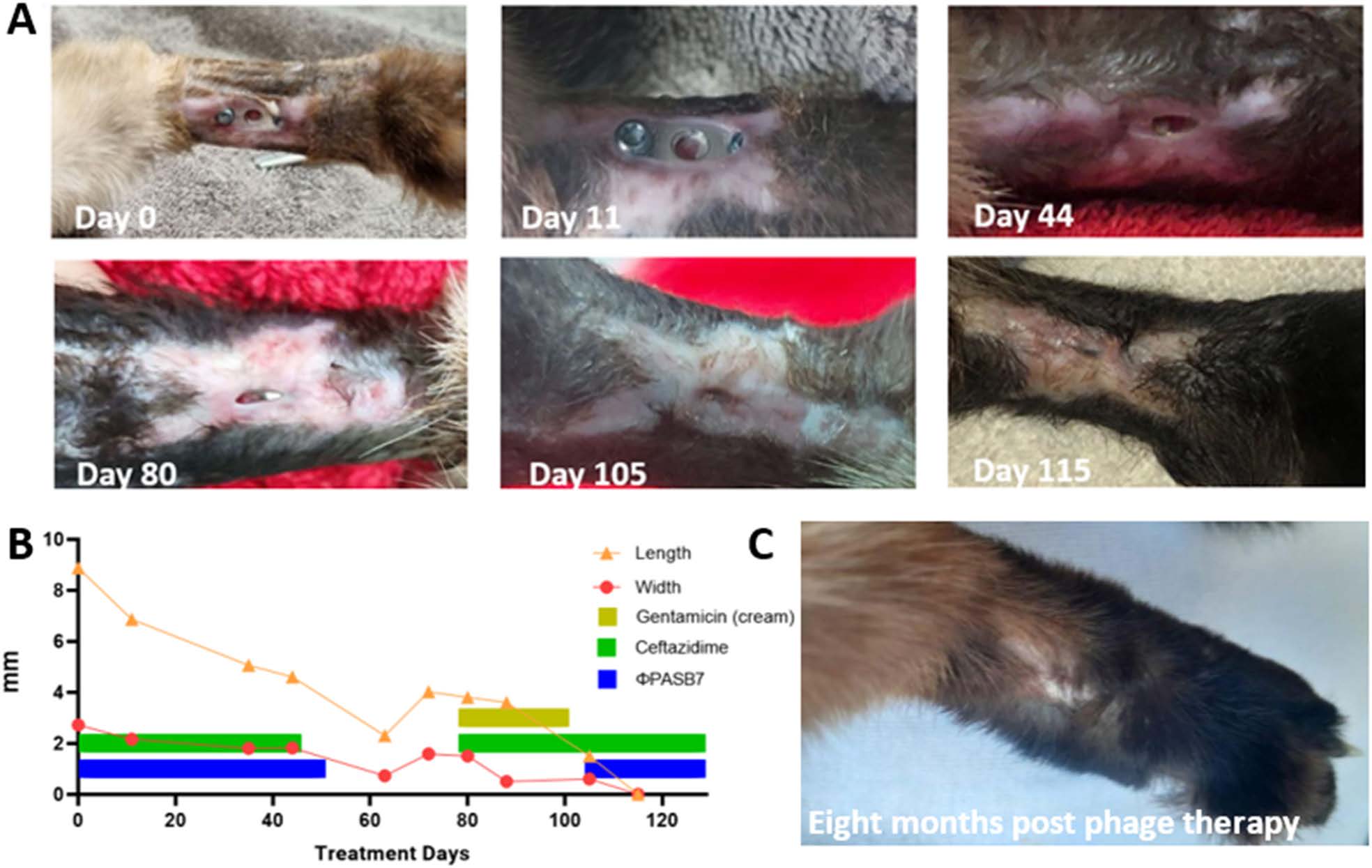
但1个月后,伤口又开始扩大,同时再次出现分泌物和铜绿假单胞菌培养阳性。因此重新开始使用头孢他啶,每天用药两次。此外,每天两次在伤口上局部涂抹 0.1%庆大霉素软膏,并更换绷带,以防止出现新的再感染。
3周后,在效果不理想的情况下,又像以前一样添加了ΦPASB7噬菌体。在重新使用噬菌体的10天内,伤口就完全愈合了。治疗又持续了两周才结束。
治疗8个月后,伤口已无明显感染迹象。在整个噬菌体治疗期间,没有观察到任何副作用。
04 讨论
抗生素耐药性感染给现代医学带来了严峻的挑战,对人类和伴侣动物都造成了影响。2019年,传染病成为导致人类死亡的第二大原因,仅次于心血管疾病[1]。在伴侣动物中,抗生素耐药菌株在全球范围内也显著流行,导致治疗方案越来越具有挑战性[2-4]。
铜绿假单胞菌(Pseudomonas aeruginosa)是最普遍的细菌之一,它是一种机会性病原体,以引起人类和动物的多种感染而闻名,包括呼吸道感染、软组织感染和尿路感染[5]。
由于其较高的医疗负担和较高的抗菌药耐药性流行率,世界卫生组织已将其确认为人类健康中的重要优先病原体[6]。欧洲食品安全局也确认了这种病原体的重要性,因为它有可能从宠物传染给主人和医务人员[7]。这些认识值得立即关注,以开发创新的治疗策略,应对铜绿假单胞菌和许多其他危险的抗生素耐药细菌病原体带来的挑战。
噬菌体疗法是利用细菌特异性病毒对抗细菌病原体的方法。虽然这种疗法早在一个多世纪前就被开发出来,但在过去十年中,这种疗法在全球范围内重新引起了人们的兴趣,被视为对抗顽固性感染的一种潜在解决方案[8]。
噬菌体提供了一种克服治疗过程中可能出现的抗药性的方法。这可以通过多种方法来实现,包括从环境中分离新噬菌体、采用体外适应或”训练”技术来增强噬菌体对细菌宿主的感染力,以及噬菌体工程[9]。
噬菌体还具有穿透和破坏细菌生物膜的卓越能力[10]。此外,噬菌体对细菌宿主具有高度特异性,可确保在保留微生物组的同时精确锁定和消灭病原体[11]。
然而,由于噬菌体的特异性,在有效治疗之前,必须将噬菌体与特定细菌病原体精确匹配[12]。正因如此,近年来许多成功的噬菌体疗法治疗各种人类感染时都采用了噬菌体的个性化方法[13]。在这些疗法中,噬菌体与抗生素联合使用,利用两种药物之间可能出现的协同效应,从而对病原体产生更好的杀灭效果[11]。
在兽医领域,体内噬菌体疗法研究的很大一部分是在受控环境下进行的,涉及农场或实验室动物[14]。然而,在伴侣动物方面,噬菌体疗法的案例却鲜有描述,大多数已发表的研究主要是在体外环境中展示噬菌体抗击从宠物体内分离的病原体的潜力[15]。
唯一记录在案的伴侣动物重要治疗方法是Hawkins等人报告的一项部分对照临床试验。在这项试验中,给患有抗生素耐药中耳炎的狗注射了由六种噬菌体组成的联合药物。在该试验中,感染在48小时后普遍明显好转,且未观察到不良反应[16]。
本病例报告介绍了一个噬菌体联合抗生素疗法的病例,该疗法是为治疗一只在关节置换手术后感染了与金属植入物相关的铜绿假单胞菌的猫而量身定制的。该病例的积极疗效凸显了噬菌体作为抗伴侣动物抗生素感染的重要工具的潜力。
据估计,伴侣动物骨科手术后手术部位感染的发生率高达8.5%,近年来抗生素耐药菌的出现日益突出[17]。这些感染在发病率、死亡率和外科手术相关费用方面造成了巨大负担[17]。因此,亟需新型辅助疗法来有效应对这一日益严重的问题。
噬菌体可以为这一问题提供有希望的解决方案。近年来,85%基于噬菌体的人类骨科感染治疗方法都涉及局部应用噬菌体,取得了很高的成功率[18]。通过局部应用噬菌体治疗人类慢性感染伤口和糖尿病足溃疡也取得了积极成果[8,19]。
因此,在这种情况下,选择利用通过开放式手术伤口直接接触植入物的优势,并指导猫主人直接向植入物施用噬菌体。通过局部使用噬菌体,旨在避免静脉注射治疗的复杂性和成本,并确保噬菌体以尽可能高的浓度到达感染部位。
此外,由于目前有关噬菌体安全性和有效性的大多数数据都来自病例报告,因此将噬菌体疗法推广到伴侣动物可在弥补噬菌体临床试验数量有限所造成的差距方面发挥关键作用[8,11]。这将使研究中心能够就噬菌体疗法对多种细菌感染的潜在益处和局限性得出结论,其中一些细菌感染在人类中可能并不常见,并据此完善噬菌体匹配、噬菌体适配和治疗方案。
由此获得的数据可应用于兽医和人类病例,从而改善治疗效果。宠物噬菌体疗法可以让医疗保健专业人员和公众了解这种治疗方法的潜在益处。提高兽医和宠物主人对噬菌体疗法的认识,可以使噬菌体在各种医疗环境中被更多人接受和采用,为噬菌体被接受为治疗传染病的标准药物铺平道路。
文献来源:Braunstein R, Hubanic G, Yerushalmy O, Oren-Alkalay S, Rimon A, Coppenhagen-Glazer S, Niv O, Marom H, Barsheshet A, Hazan R. Successful phage-antibiotic therapy of P. aeruginosa implant-associated infection in a Siamese cat. Vet Q. 2024 Dec;44(1):1-9.
参考文献
[1] Murray CJL, Ikuta KS, Sharara F, Swetschinski L, Robles Aguilar G, Gray A, Han C, Bisignano C, Rao P, Wool E, et al.. 2022. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet. 399(10325):629–655.
[2] Sobkowich KE, Weese JS, Poljak Z, Plum A, Szlosek D, Bernardo TM.. 2023. Epidemiology of companion animal AMR in the United States of America: filling a gap in the one health approach. Front Public Health. 11:1161950.
[3] Marco-Fuertes A, Marin C, Lorenzo-Rebenaque L, Vega S, Montoro-Dasi L.. 2022. Antimicrobial resistance in companion animals: a new challenge for the one health approach in the European Union. Vet Sci. 9(5):208.
[4] Caneschi A, Bardhi A, Barbarossa A, Zaghini A.. 2023. The use of antibiotics and antimicrobial resistance in veterinary medicine, a complex phenomenon: a narrative review. Antibiotics (Basel). 12(3):487.
[5] Qin S, Xiao W, Zhou C, Pu Q, Deng X, Lan L, Liang H, Song X, Wu M.. 2022. Pseudomonas aeruginosa: pathogenesis, virulence factors, antibiotic resistance, interaction with host, technology advances and emerging therapeutics. Signal Transduct Target Ther. 7(1):199.
[6] Tacconelli E, Carrara E, Savoldi A, Harbarth S, Mendelson M, Monnet DL, Pulcini C, Kahlmeter G, Kluytmans J, Carmeli Y, et al.. 2018. Discovery, research, and development of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis. Lancet Infect Dis. 18(3):318–327.
[7] Nielsen SS, Bicout DJ, Calistri P, Canali E, Drewe JA, Garin-Bastuji B, Gonzales Rojas JL, Gortázar C, Herskin M, Michel V, et al.. 2022. Assessment of listing and categorisation of animal diseases within the framework of the Animal Health Law (Regulation (EU) No 2016/429): antimicrobial-resistant Pseudomonas aeruginosa in dogs and cats. Efsa J. 20(5):e07310.
[8] Uyttebroek S, Chen B, Onsea J, Ruythooren F, Debaveye Y, Devolder D, Spriet I, Depypere M, Wagemans J, Lavigne R, et al.. 2022. Safety and efficacy of phage therapy in difficult-to-treat infections: a systematic review. Lancet Infect Dis. 22(8):e208–e220.
[9] Dedrick RM, Guerrero-Bustamante CA, Garlena RA, Russell DA, Ford K, Harris K, Gilmour KC, Soothill J, Jacobs-Sera D, Schooley RT, et al.. 2019. Engineered bacteriophages for treatment of a patient with a disseminated drug-resistant Mycobacterium abscessus. Nat Med. 25(5):730–733.
[10] Ferriol-González C, Domingo-Calap P.. 2020. Phages for biofilm removal. Antibiotics (Basel). 9(5):268.
[11] Altamirano FLG, Barr JJ.. 2019. Phage therapy in the postantibiotic era. Clin Microbiol Rev. 32(2):e00066-18.
[12] Yerushalmy O, Braunstein R, Alkalay-Oren S, Rimon A, Coppenhagn-Glazer S, Onallah H, Nir-Paz R, Hazan R.. 2023. Towards standardization of phage susceptibility testing: the Israeli phage therapy center “Clinical Phage Microbiology” – a pipeline proposal. Clin Infect Dis. 77(Suppl 5):S337–S351.
[13] Schooley RT, Biswas B, Gill JJ, Hernandez-Morales A, Lancaster J, Lessor L, Barr JJ, Reed SL, Rohwer F, Benler S, et al.. 2017. Development and use of personalized bacteriophage-based therapeutic cocktails to treat a patient with a disseminated resistant Acinetobacter baumannii infection. Antimicrob Agents Chemother. 61(10):e00954–17.
[14] Marshall K, Marsella R.. 2023.Topical bacteriophage therapy for Staphylococcal superficial pyoderma in horses: A double-blind, placebo-controlled pilot study. Pathogens. 12(6):828.
[15] Lerdsittikul V, Thongdee M, Chaiwattanarungruengpaisan S, Atithep T, Apiratwarrasakul S, Withatanung P, Clokie MRJ, Korbsrisate S.. 2022. A novel virulent Litunavirus phage possesses therapeutic value against multidrug-resistant Pseudomonas aeruginosa. Sci Rep. 12(1):21193.
[16] Hawkins C, Harper D, Burch D, Anggård E, Soothill J.. 2010. Topical treatment of Pseudomonas aeruginosa otitis of dogs with a bacteriophage mixture: a before/after clinical trial. Vet Microbiol. 146(3-4):309–313.
[17] Schmökel H. 2023. Balancing the prevention of surgical site infections with responsible antimicrobial use in companion animal practice. Vet Rec. 192(8):330–331.
[18] Genevière J, McCallin S, Huttner A, Pham TT, Suva D.. 2021. A systematic review of phage therapy applied to bone and joint infections: an analysis of success rates, treatment modalities and safety. EFORT Open Rev. 6(12):1148–1156.
[19] Young MJ, Hall LML, Merabishvilli M, Pirnay JP, Clark JR, Jones JD.. 2023. Phage therapy for diabetic foot infection: a case series. Clin Ther. 45(8):797–801.