
| 一般情况 | |
|---|---|
 | 品种:吉娃娃 |
| 年龄:11岁 | |
| 性别:雌 | |
| 是否绝育:是 | |
| 诊断:颗粒细胞瘤 | |
01 主诉及病史
一个月前发现颈部皮下肿块且食欲略有下降。在附近一家医院就诊,超声发现肿块从颈部到腋下,且有大量血流,怀疑是恶性肿瘤,遂转诊。
02 检查
体重2.7公斤。血液化验未发现异常,X光显示单发肿瘤从颈部皮下延伸至腋窝,没有证据表明肿瘤侵犯周围区域或明显转移至肺。
细胞学检查提示为上皮性肿瘤,如腺癌,于是全麻下进行了CT扫描和组织活检,以进一步评估病情。
CT显示肿块在颈部皮下形成,压迫食管和前胸胸壁。肿块内的血流很高,阻塞了腋静脉的血流(下图)。
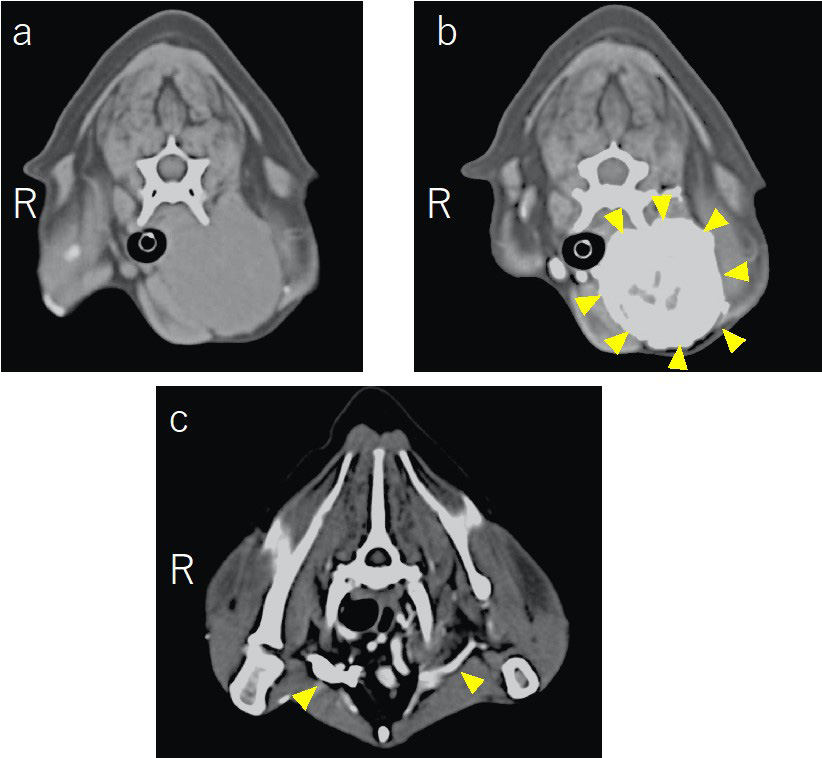
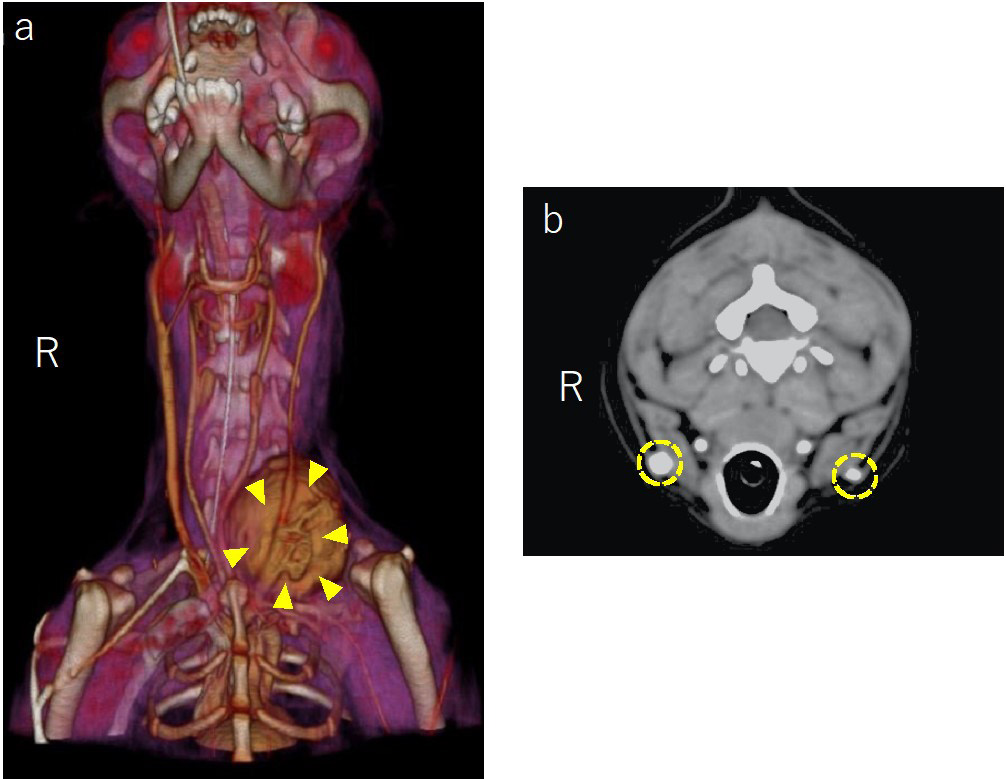
左颈静脉被肿块卡住,血流受阻。因此,流向对侧(右侧)的血流过多,血管直径与左侧(肿瘤侧)相比出现代偿性增大(下图)。
HE染色未能获得组织学诊断。细胞呈片状增生的非上皮细胞,主要呈圆形,细胞核略不规则,嗜酸性细颗粒状细胞质中有一些大小不均的空泡,可能是脂肪滴。细胞分裂在高倍镜下几乎看不到,多条毛细血管穿插在细胞中,但没有明显的细胞不典型性,因此组织学不典型,难以鉴别。
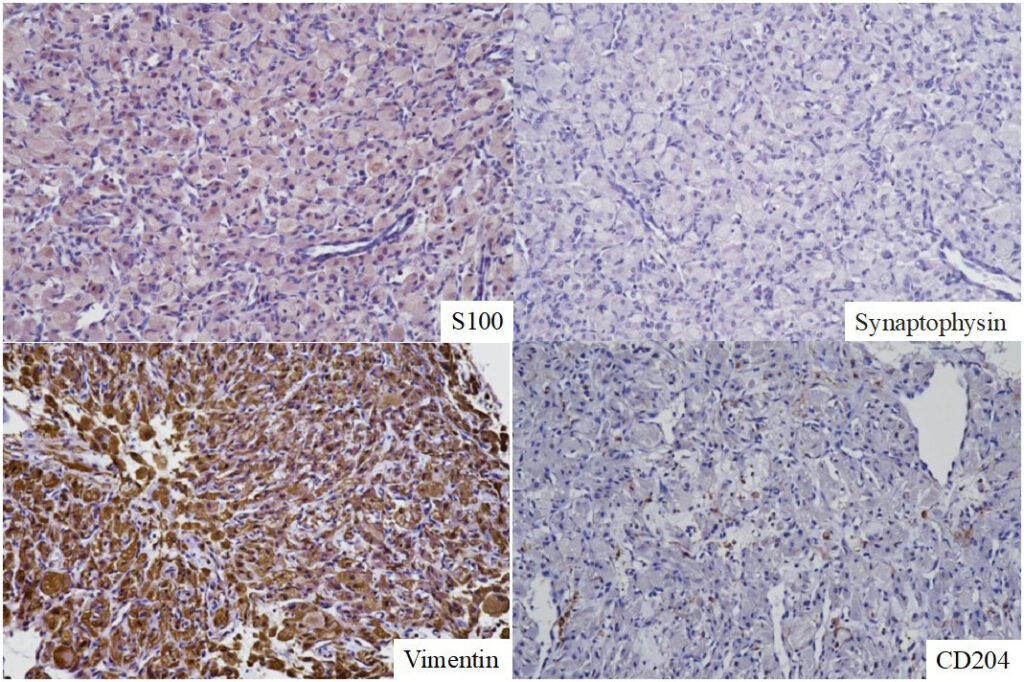
免疫染色结果为波形蛋白和MHC(II)阳性,AE1/AE3、PGP9.5、desmin和CD204阴性。根据这些结果,首先考虑的是嗜铬细胞瘤或分化良好的脂肪肉瘤,其次是肉芽肿。因此,在与主人协商后,尽管术后可能会残疾,但考虑到恶性肿瘤的可能性,还是决定进行大范围切除。
03 手术
静脉注射芬太尼(0.005 mg/kg)、咪达唑仑(0.1 mg/kg)和丙泊酚(6 mg/kg)进行麻醉。异氟醚(2-3%)维持全身麻醉,芬太尼(0.005-0.02 mg/kg/h)持续输注提供术中镇痛。
患者取仰卧位,在左侧颈部至腋窝处做切口。钝性剥离皮下组织,通过胸锁乳突肌和肱二头肌之间的间隙接近肿块。肿块与周围组织之间的粘连较轻,但颈静脉被卡在肿块内,这与 CT 检查结果一致,肿块表面分布着许多血管。
使用电烧和超声凝固器从头侧将肿块与周围组织剥离,但肿块表面的出血未能得到充分控制,于是结扎了左侧颈静脉。然而出血仍在持续,在使用止血肾上腺素反复加压止血后,才实现头侧和背侧剥离。
然而出血仍在持续,循环血量减少导致低血压,并出现代偿性心动过速。因此输液量从5 mL/kg/h增加到10 mL/kg/h。肿块尾侧有粘连,随后的探查证实并验证了其附着于第五至第八颈椎的臂丛神经。因此,尽管存在前肢瘫痪的风险,患者还是接受了神经切除术,以确保安全。
在出血停止且无大块残留后,用0.5%布比卡因HCL浸润伤口表面进行镇痛,然后关闭伤口。虽然麻醉恢复良好,也没有观察到心动过速或呼吸过速等失血的临床症状,但在麻醉恢复后立即开始输20 mL/kg全血。
术后使用芬太尼8小时,之后每8小时静脉注射一次丁丙诺啡(0.02 mg/kg),连续镇痛4天。术后食欲有所改善,全身状况良好,但左前肢出现指关节僵硬。
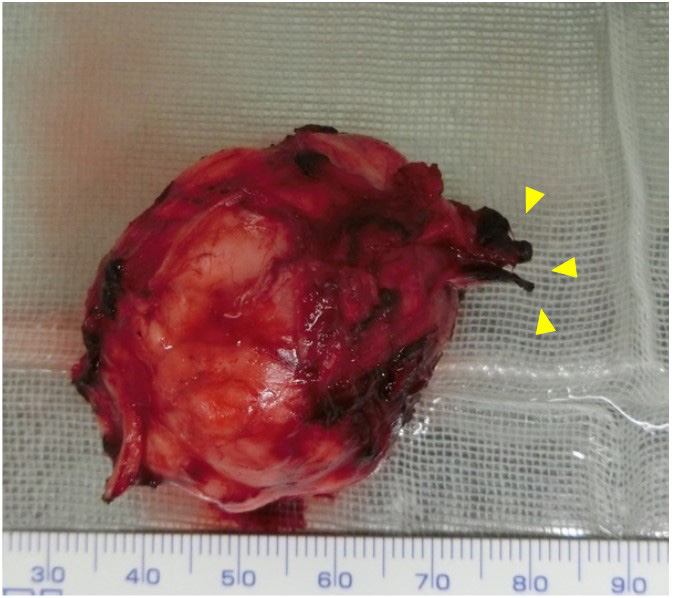
切除的肿块被包囊包围,神经纤维清晰可见(下图)。
病理检查显示,切除的颈部组织为皮下肿块样病变,边界清晰。病灶内有片状增生的非上皮细胞,呈圆形,部分呈纺锤形。这些细胞显示出轻度的核大小不等、丰富的嗜酸性细颗粒胞质以及含有神经纤维的肿块周围区域。肿瘤边界相对清晰,边缘或血管内未发现肿瘤细胞(下图)。
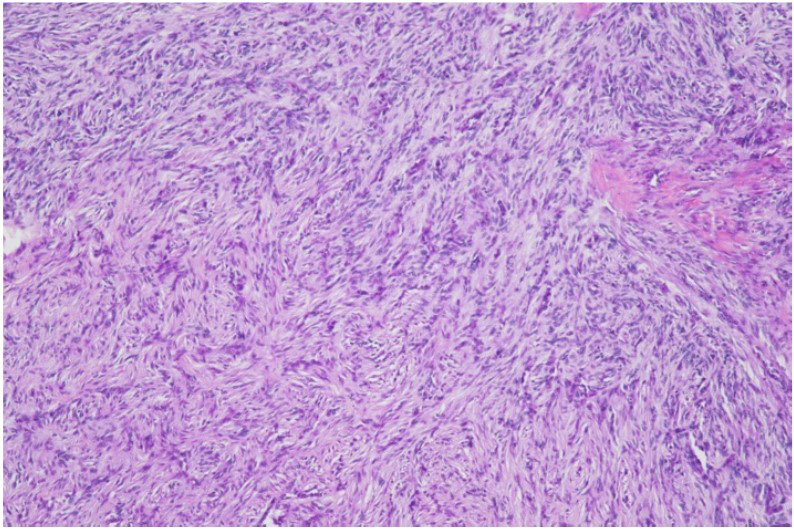
切除肿瘤的病理结果显示,尽管肿瘤的起源部位和组织学均不典型,但根据肿瘤细胞形态以及S100免疫染色呈阳性的事实,该肿瘤被归类为颗粒细胞瘤。该肿瘤被推测为起源于施旺细胞,肿瘤的某些部分呈现出施旺细胞瘤样形态(下图)。肿瘤在安全切缘下切除,周边区域和血管中未发现肿瘤细胞。
04 预后
术后3个月,前肢瘫痪持续存在(下图)。术后6个月,瘫痪持续存在,未发现复发或转移症状。

05 讨论
颗粒细胞瘤(Granular cell tumor,GCT)作为颗粒细胞肌母细胞瘤曾于1926年首次在人类身上被描述[1]。GCT与施旺细胞瘤密切相关,是典型的源自施旺细胞的良性肿瘤[2]。
狗GCT常发生在口腔,尤其是舌头[3],但也有少数病例发生在中枢神经系统,如颅内[4]或脊髓[5]。然而,发生在人类周围神经中的GCT极少见[6],既往还没有关于狗的原发性GCT发生在周围神经中的病例报道。
在治疗肿瘤时,不仅要通过组织学鉴定GCT,还要鉴定肿瘤,并制定手术方案,包括切除范围。然而,由于GCT缺乏特有的临床表现,手术前的准确诊断率极低[7-9],因此必须依赖切除后的病理诊断。
在面对像本病例这样的非典型GCT时,外科医生必须在未获得明确术前诊断的情况下,考虑到各种肿瘤的可能性。本病例报告描述了第一例狗臂丛非典型 GCT病例。
口腔外最常见的GCT病变部位是颅内区域[4,10]。然而,文献显示犬外周神经系统GCT的报告极为罕见,仅有一例安乐死病例涉及左侧第四腰椎神经[5]。因此,在本病例中,术前成像、细胞学或组织活检都无法预测是否存在GCT。
如上所述,与周围神经相关的GCT极其罕见,除此之外,GCT的术前诊断也很困难。也就是说,GCT缺乏特异性的临床表现和细胞形态学特征,在本病例中,通过术前组织活检无法确诊明显的细胞不典型性,难以确定起源,其次是免疫组织学诊断。
免疫组织学诊断结果为波形蛋白和MHC(II)阳性,AE1/AE3、PGP9.5、desmin和CD204阴性,首先考虑嗜铬细胞瘤或分化良好的脂肪肉瘤的可能性,其次考虑肉芽肿,但未得到证实。
影像学检查发现肿块内部和周围有丰富的动脉血流。血管内皮细胞的免疫组织学研究已被用于识别微血管和计算各种实体瘤的血管密度,并显示异常的血管密度与患者的预后密切相关[11]。因此,尽管该病例肿块的来源不明,但根据丰富的血流考虑其为恶性肿瘤。
在切除肿瘤时,虽然通过影像学研究可以预测会有出血,但还是发生了超出预期的出血,且很难控制。在这个病例中,肿块较大,与周围组织粘连紧密,因此很难识别进入肿块的血管。然而,剥离肿块头部并不能控制出血,出血一直持续到肱动脉区域被切除,这表明肿块的主要血流来源是腋动脉。
为了切除肿块,切除了C5至C8的肱神经分支。涉及肱神经的GCT尚未在狗身上报道过,在人类身上也只有少数研究[12,13]。既往报告称,肿块侵犯了肱神经,导致切除不彻底和复发[13]。
原则上,对于GCT病例,可尝试通过显微手术将肿块与浸润的神经分离,从而安全地切除肿块。但是,根据浸润的程度,这可能很难做到,而且不可避免地会造成一定程度的神经损伤,从而影响上肢功能。这一点非常令人担忧,尤其是在人类身上,因为它会影响患者术后的活动。
在本病例中,手术前已预测到肿块会与肱神经相连,并告知了主人切除肿块后可能会导致前肢瘫痪,并征得了主人的同意。此外,考虑到肿块是恶性肿瘤,手术的目的是广泛而彻底地切除肿块,因此进行了彻底切除。
术后神经系统检查发现,患者前肢本体感觉丧失,这表明C5至C8区域的神经纤维受损。但没有发现霍纳征,表明没有发生深层功能障碍,如神经根卡压。
与其他类型的肿瘤类似,局部GCT(包括良性和恶性)的治疗也从手术切除开始。虽然没有关于狗的预后的报道,但发生在舌头表面的良性GCT术后几周迅速复发。
在人类中,如果对良性GCT进行局部广泛切除,且切缘阴性,复发率为2-8%,切缘阳性的病例复发率大于20%。一般来说,GCT是良性病变,可通过局部切除术安全处理[14]。由于肿瘤的高度耐药性,不建议进行放疗和化疗[15]。因此,最初的手术对于确保边缘干净至关重要。臂丛区域的GCT比较罕见,根据受累部位的不同,可有多种表现形式。
臂丛GCT在组织学确诊前可能会被误诊,因为它们表现出的临床症状不明显,CT结果也往往与其他神经鞘瘤相似。
总之,在本病例中,由于肿瘤没有特异性,无法在手术前做出明确诊断。手术治疗势在必行,因为完全切除肿瘤是降低复发和转移的唯一方法。本报告为兽医提供了手术前不明原因肿瘤的诊断和治疗方案。
文献来源:Maeda K, Wada S, Shimaoka C, Iwai S, Okano S. Granular cell tumor of the brachial nerve in a dog: A case report. Braz J Vet Med. 2024 May 28;46:e001424.
参考文献
[1] Abrikossoff A. I. Über Myome ausgehned von der guergestriten willkurlichen Muskulatur. Virchows Archiv. 1926;260(1):215–233.
[2] Stefansson K., Wollmann R. L. S-100 protein in granular cell tumors. Cancer. 1982;49(9):1834–1838.
[3] Patnaik A. K. Histologic and immunohistochemical studies of granular cell tumors in seven dogs, three cats, one horse, and one bird. Veterinary Pathology. 1993;30(2):176–185.
[4] Higgins R. J., LeCouteur R. A., Vernau K. M., Sturges B. K., Obradovich J. E., Bollen A. W. Granular cell tumor of the canine central nervous system: Two cases. Veterinary Pathology. 2001;38(6):620–627.
[5] Rao D., Rylander H., Drees R., Schwarz T., Steinberg H. Granular cell tumor in a lumbar spinal nerve of a dog. Journal of Veterinary Diagnostic Investigation. 2010;22(4):638–642.
[6] Vigier S., Traverse-Glehen A., Durbec M., Tringali S., Dubreuil C., Ceruse P. Deep cervical granular cell tumor: An atypic location suggestive of neurogenic origin. European Annals of Otorhinolaryngology, Head and Neck Diseases. 2014;131(1):65–67.
[7] Battistella M., Cribier B., Feugeas J. P., Roux J., Le Pelletier F., Pinquier L., Plantier F., Cutaneous Histopathology Section of the French Society of Dermatology Vascular invasion and other invasive features in granular cell tumours of the skin: A multicentre study of 119 cases. Journal of Clinical Pathology. 2014;67(1):19–25.
[8] Ferreira J. C., Oton-Leite A. F., Guidi R., Mendonça E. F. Granular cell tumor mimicking a squamous cell carcinoma of the tongue: A case report. BMC Research Notes. 2017;10(1):14.
[9] van de Loo S., Thunnissen E., Postmus P., van der Waal I. Granular cell tumor of the oral cavity: A case series including a case of metachronous occurrence in the tongue and the lung. Medicina Oral, Patologia Oral y Cirugia Bucal. 2015;20(1):e30–e33.
[10] Mayor C., Verdés J., Alomar J., Novellas R., Pumarola M., Añor S. Intracranial Granular Cell Tumours in Three Dogs: Atypical Magnetic Resonance Imaging Features and Immunohistochemical Study. Veterinary Sciences. 2023;10(2):134.
[11] Toi M., Hoshima S., Takayanagi T., Tominaga T. Tumor angiogenesis: A new significant and independent prognostic indicator in early-stage breast carcinoma. Association of vascular endothelial growth factor expression with tumor angiogenesis and with early relapse in primary breast cancer. Japanese Journal of Cancer Research. 1994;85(10):1045–1049.
[12] Jia X., Chen C., Chen L., Yu C., Kondo T. Large malignant granular cell tumor with suprascapular nerve and brachial plexus invasion: A case report and literature review. Medicine. 2017;96(44):e8531.
[13] Kim Y. I., Lee C. K., Cho K. H., Kim S. H. Granular cell tumor of brachial plexus mimicking nerve sheath tumor: A case report. Korean Journal of Spine. 2012;9(3):275–277.
[14] Khansur T., Balducci L., Tavassoli M. Granular cell tumor. clinical spectrum of the benign and malignant entity. Cancer. 1987;60(2):220–222.
[15] Stefansson K., Wollmann R. L. S-100 protein in granular cell tumors. Cancer. 1982;49(9):1834–1838.