
| 病例1 | |
|---|---|
 | 品种:布偶猫 |
| 年龄:6个月 | |
| 性别:雄 | |
| 是否绝育:否 | |
| 诊断:胃肠道嗜酸性硬化性纤维增生症 | |
01 主诉及病史
从2个月大起,持续出现呕吐。
02 检查
全血细胞计数显示嗜酸性粒细胞正常(0.8×10^9/L [0.1-1.5]),血生化结果无异常。
腹部放射线检查发现幽门部位有一个软组织肿块。腹部超声发现幽门十二指肠交界处有一个巨大、异质高回声的腔内肿块,肿块壁分层完全消失(下图)。该肿块导致幽门十二指肠交界处出现严重的流出道梗阻。肿块附近的胃壁增厚,分层消失,但胃体和胃底未见异常。胰十二指肠和胃淋巴结明显肿大。
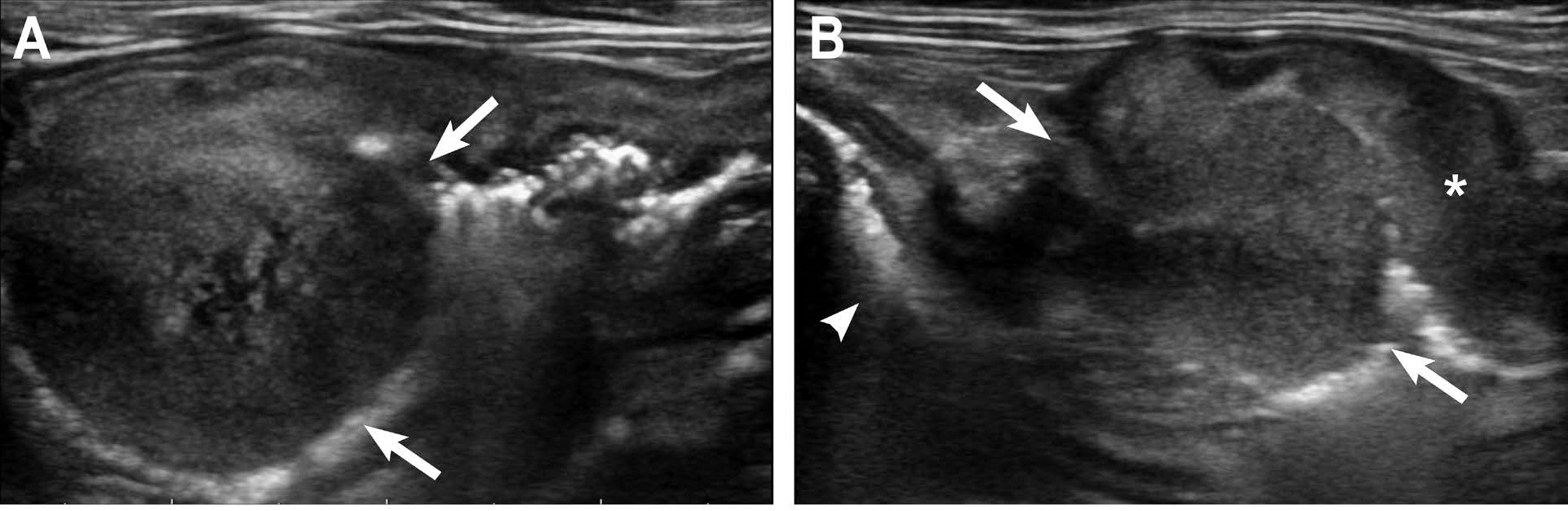
在向胃部充气以识别胃壁后,使用32层CT扫描仪进行胸部和腹部CT扫描。注射600 mg/kg碘海醇造影剂后于10、30和90秒时进行检查。胸部CT未发现异常。
腹部CT发现一个约18×16×14 mm有蒂软组织衰减性肿块,位于幽门窦背侧(下图)。肿块呈轻度弥漫均匀对比增强,壁分层缺损。增厚的胃壁和幽门肿块之间的边界不清晰。胃体和胃底正常。胃和胰十二指肠淋巴结明显肿大,对比度轻度增强,周围有轻度脂肪滞留征象。未发现肺部结节。
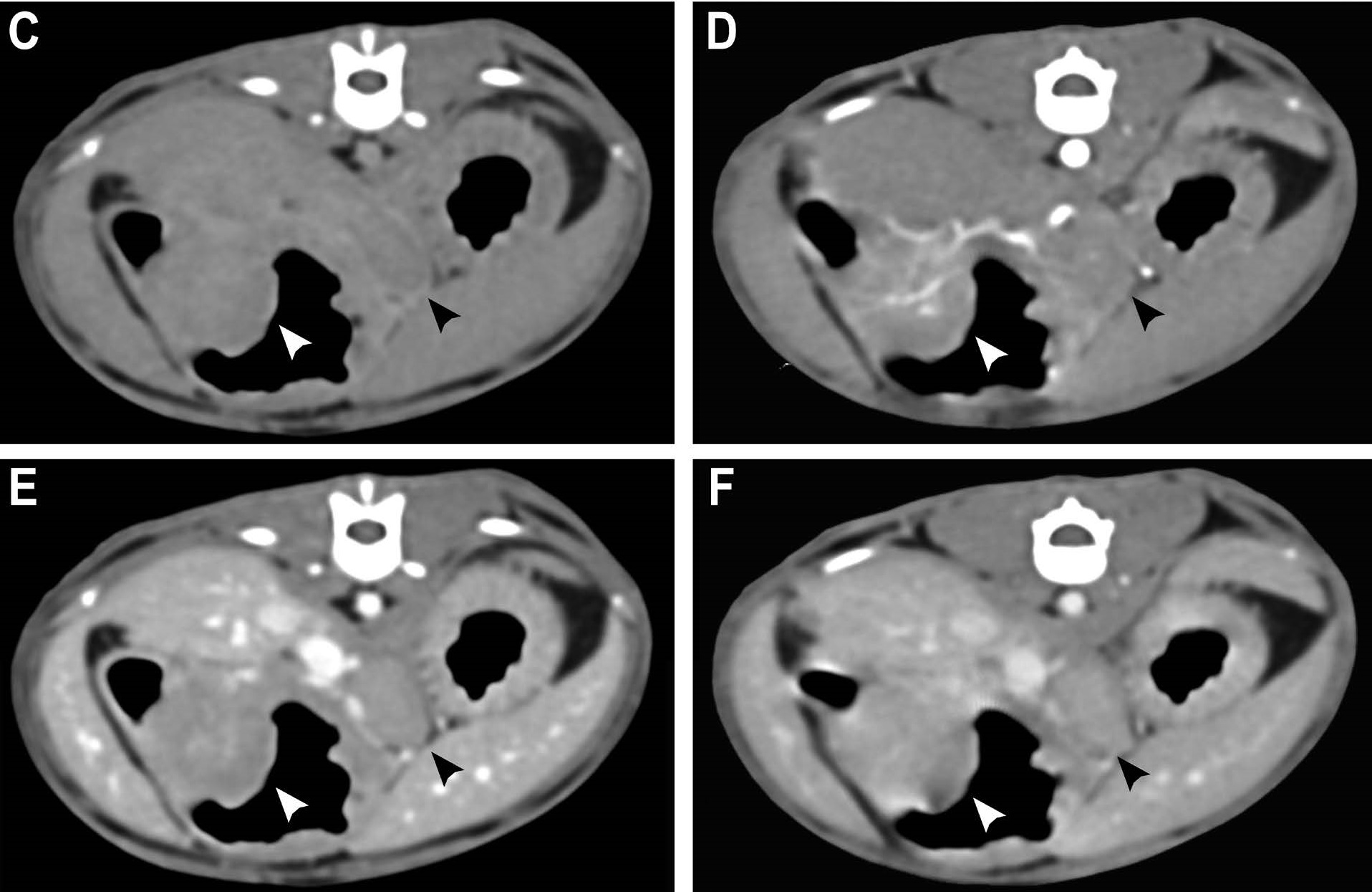
CT扫描后,立即进行了超声引导下的胃淋巴结细针穿刺,诊断出反应性增生。
03 治疗
给予法莫替丁(1 mg/kg q12h)、马罗匹坦(1 mg/kg q24h)和甲硝唑(15 mg/kg q12h)处理,同时喂食处方湿粮(兽用胃肠粮),猫食欲良好,没有呕吐症状。
CT检查一周后,手术切除了幽门肿块,发现幽门十二指肠交界处的幽门壁同心增厚,腔内肿块有牢固的蒂。组织学证实为猫胃肠道嗜酸性硬化性纤维增生症(下图)。
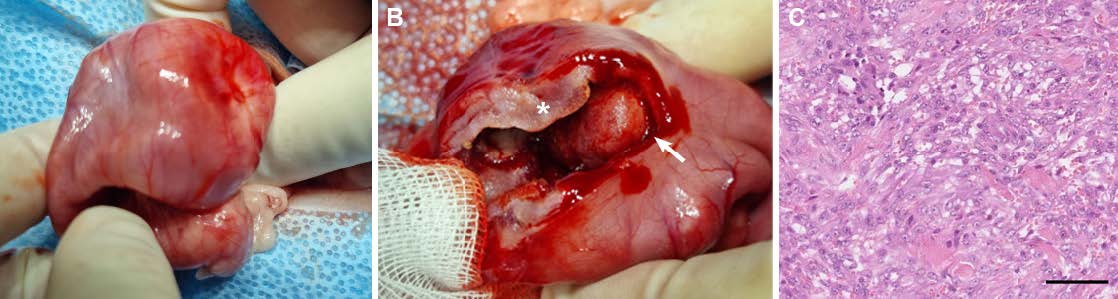
04 预后
手术后,患者出现术后急性胰腺炎并伴有黄疸,强化治疗无效,SNAP猫胰脂肪酶检测呈强阳性,总胆红素水平升高(0.90 mmol/L [0-0.05]),7天后死亡。没有进行尸检。
| 病例2 | |
|---|---|
 | 品种:俄罗斯蓝猫 |
| 年龄:9岁 | |
| 性别:雌 | |
| 是否绝育:否 | |
| 诊断:胃肠道嗜酸性硬化性纤维增生症 | |
05 主诉及病史
因间歇性呕吐就诊。
06 检查
全血细胞计数显示嗜酸性粒细胞增多(0.24×10^9/L [0.1-1.5]),血生化结果无异常,腹部X光片正常。
从最初发病到死亡,连续进行了18周的超声检查,每隔三周检查一次(下图)。
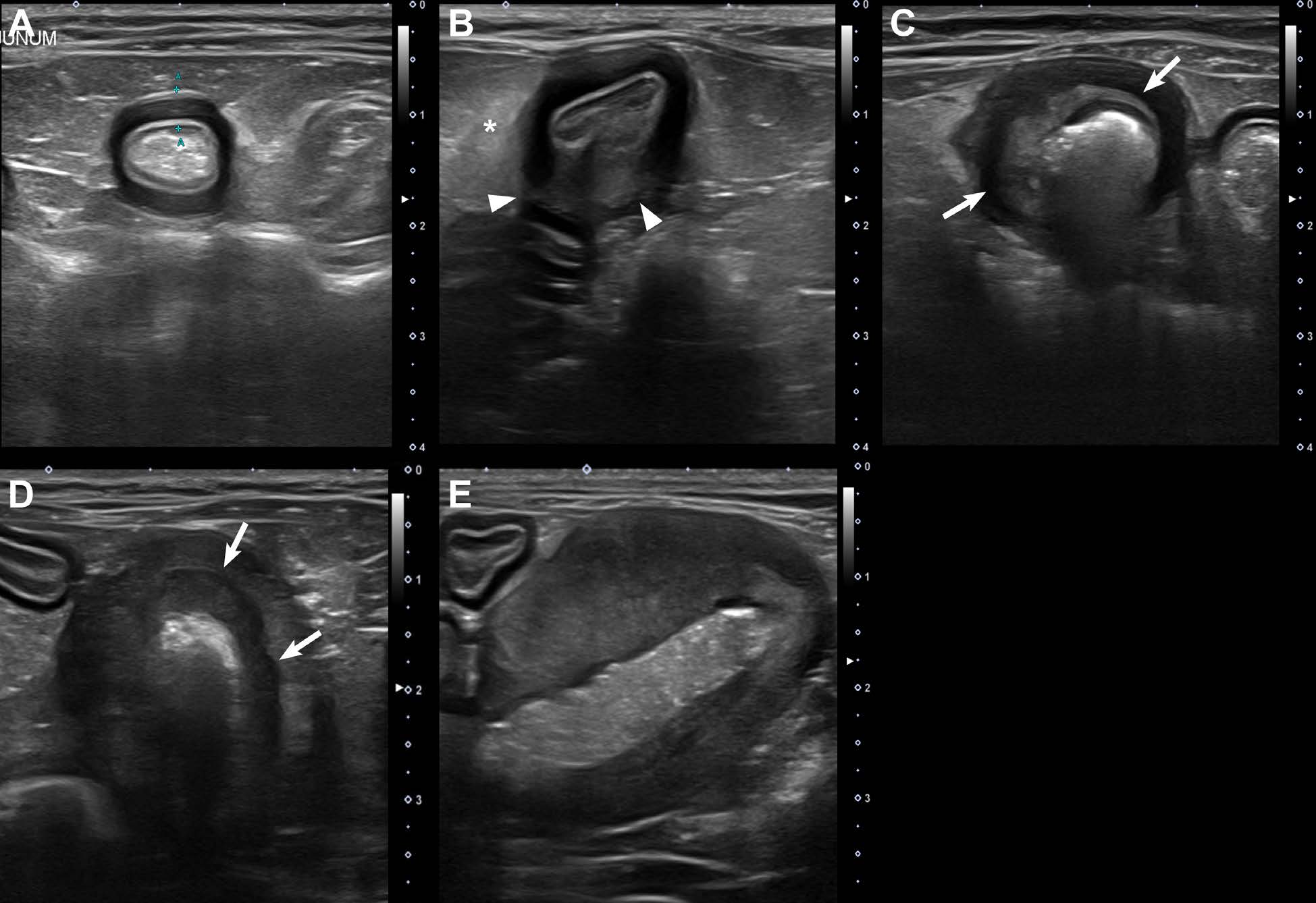
最初,腹部超声检查显示空肠壁弥漫性和普遍性增厚,尤其是在肌肉层,但空肠壁分层正常(上图A)。空肠和回盲部淋巴结正常。给予法莫替丁(0.5 mg/kg q12h)、马罗匹坦(2 mg/kg q24h)、阿莫西林(15 mg/kg q12h)和泼尼松龙(0.5 mg/kg q12h)治疗,但一周后空肠增厚没有改善。
3周后,超声显示空肠内有一个边缘不清、异型、偏心的肿块(7×10×11 mm),空肠最厚处的壁层发生改变,周围肠系膜有低回声改变(上图B)。回盲部和空肠淋巴结周围也有高回声改变。对空肠肿块、一个空肠节段和空肠淋巴结进行了全层穿刺活检。
5周后(活检2周后),组织病理学结果发现疑似间质肿瘤,伴有纤维化、炎症性肠病和皮质旁淋巴结增生。空肠肿块显示出间质来源肿瘤的特征,很可能是间质瘤。肿瘤在肌肉层内呈浸润性生长,伴有水肿和炎症。肿瘤细胞呈圆形至多角形,细胞核肥大,细胞质嗜酸性,并有大量空泡。在高倍视野中,有丝分裂计数为5/10。
此时,泼尼松龙的用量开始增加,每次1.25 mg/kg,q12h。9周后,疑似间质瘤的病变逐渐转变为界限不清的周缘透壁性肿块,壁层完全丧失,而其他节段则表现为类似或轻微增厚(上图C-E)。
07 治疗
9 周后,手术切除了空肠肿块,诊断为胃肠道嗜酸性硬化性纤维增生症,与活检结果不同。经组织病理学检查,空肠肿块显示出广泛的胶原纤维和明显的硬化。病变从粘膜下层延伸至浆膜层,嗜酸性粒细胞浸润较深。在高倍镜下,纤维组织显示出吻合模式、肥大的肌成纤维细胞和突出的嗜酸性粒细胞浸润。
另外还进行了c-Kit免疫组化染色,结果显示c-Kit染色阴性,排除了间质瘤的可能。泼尼松龙剂量增至1.5 mg/kg q12h。
08 预后
术后9周内,每隔1-10天进行一次超声随访。吻合部位没有发现复发,但空肠壁持续增厚,空肠的其他部分也是如此。术后3周,回盲部和空肠淋巴结逐渐增大。术后8天腹泻,进行了粪便常规镜检和细菌培养。细菌培养中检测到细菌过度生长和奇异变形杆菌、大肠杆菌和加里纳氏肠球菌,PCR检测显示肠出血性、肠侵袭性、肠致病性和肠毒性病原体均阴性。
医生给予其他抗生素,包括马勃沙星(3 mg/kg q24h)、甲硝唑(15 mg/kg q12h)以及米氮平(1.88 mg q12h)。尽管接受了强化药物治疗,但患者的病情仍在逐渐恶化。
术后9周又服用了氯霉素(15 mg/m2 q24 h)。然而由于腹泻和厌食无改善,导致恶病质,患者在术后9周死亡。没有进行尸检。
09 讨论
猫胃肠道嗜酸性硬化性纤维增生症(Feline gastrointestinal eosinophilic sclerosing fibroplasia,FGESF)是一种位于胃肠道内的嗜酸性结节性肿块[1,2]。虽然已有一些关于FGESF的研究和病例报告,但CT特征仅限于腹膜外腹膜后区域和直肠[3,4]。
最近一项关于FGESF的研究报告了30只猫的超声检查结果,发现了一些典型特征,如肠道分层消失、增厚、肠壁回声混杂且有高回声区,尤其是在胃或肠道病例中[5]。
然而,目前还缺乏对FGESF连续超声成像变化的详尽描述。在此,本病例报道介绍了两例FGESF病例及其临床和影像诊断特征,包括持续超声和CT。
FGESF主要见于中年成年猫,中位年龄为7-8岁[2]。虽然观察到遗传倾向(尤其是雄性布偶猫)和可能的感染,但病因仍不确定[2,6,7]。临床症状包括呕吐、腹泻、体重减轻和嗜睡[2,8],超过一半的猫伴有外周嗜酸性粒细胞增多[2]。
在对肿块进行细针穿刺细胞学检查时,大多数猫要么显示无诊断结果,要么显示坏死或混合性炎症,只有不到一半的病例显示嗜酸性粒细胞炎症。淋巴结的细针穿刺结果通常是非诊断性或显示反应性淋巴结病,只有少数病例显示嗜酸性粒细胞[5]。
虽然病例1与之前的FGESF病例有许多相同之处,例如雄性布偶猫出现幽门病变,淋巴结细胞学检测中发现的嗜酸性粒细胞很少,但值得注意的是,与之前的病例相比,该病例的临床症状出现的年龄要小得多。由于年龄较小、缺乏外周嗜酸性粒细胞增多以及影像学诊断特征,将FGESF与其他疾病区分开来具有挑战性。这凸显了组织病理学检查的重要性,对于患有幽门肿块的猫,即使是幼猫,也应将FGESF作为一种鉴别诊断。
在大多数FGESF病例研究中,FGESF表现为单个、异质、壁内肿块,超声可见壁分层缺损和区域淋巴结肿大,与肠道肿瘤病变相似[2,8,9]。偶尔FGESF会出现一个高回声区,表明存在纤维化区域,这在肿瘤中通常无法观察到[2,8]。
在病例1中,幽门肿块和区域淋巴结病的整体形态与之前的报告一致,只是突出的肿块延伸到了胃腔内。在病例2中,最初观察到空肠肌层增厚,但后来逐渐发展为空肠小偏心肿块,部分肠壁分层消失,最后发展为周缘肿块,肠壁分层完全消失。淋巴结从正常结构变为结节周围高回声改变,随后出现明显的淋巴结肿大。
与此类似,在之前的一例FGESF病例中,最初仅发现肠壁增厚,但无肠壁分层消失,后来发展为药物难治性肿块[7]。这表明,对于药物治疗效果不佳的肠壁增厚病例,应考虑FGESF早期状态的可能性。考虑到之前的大多数报告都描述了晚期FGESF的成像特征[2,8],这些发现将有助于兽医实践中对早期FGESF的诊断。
总之,本病例报告介绍了两例幽门和空肠部位的FGESF病例以及超声和CT的影像诊断特征。在超声和CT上,其外观与胃肠道肿瘤病变相似。在超声检查中,空肠上的早期FGESF可能仅表现为肌层增厚。即使是幼猫,也应将FGESF作为幽门肿块的鉴别诊断。对于药物治疗无效的肠道肌肉层增厚病例,应进行连续的超声检查和活组织检查,以确认FGESF的存在。
文献来源:Noh D, Jo H, Shin H, Lee SK, Choi S, Lee K. Feline gastrointestinal eosinophilic sclerosing fibroplasia in two cats: Serial ultrasonographic and computed tomography findings. Vet Med (Praha). 2024 May 27;69(5):177-183.
参考文献
[1] Craig LE, Hardam EE, Hertzke DM, Flatland B, Rohrbach BW, Moore RR. Feline gastrointestinal eosinophilic sclerosing fibroplasia. Vet Pathol. 2009 Jan;46(1):63-70.
[2] Linton M, Nimmo JS, Norris JM, Churcher R, Haynes S, Zoltowska A, Hughes S, Lessels NS, Wright M, Malik R. Feline gastrointestinal eosinophilic sclerosing fibroplasia: 13 cases and review of an emerging clinical entity. J Feline Med Surg. 2015 May;17(5):392-404.
[3] Thieme ME, Olsen AM, Woolcock AD, Miller MA, Simons MC. Diagnosis and management of a case of retroperitoneal eosinophilic sclerosing fibroplasia in a cat. JFMS Open Rep. 2019 Aug 16;5(2):2055116919867178.
[4] Goffart LM, Durand A, Dettwiler M, Vincenti S. Feline gastrointestinal eosinophilic sclerosing fibroplasia presenting as a rectal mass. JFMS Open Rep. 2022 Aug 10;8(2):20551169221114330.
[5] Cerna P, Lopez-Jimenez C, Fukushima K, Nakashima K, Nakagawa T, Adam F, Groth A, Denning A, Israeliantz N, Gunn-Mooreet DA. Clinicopathological findings, treatment, and outcome in 60 cats with gastrointestinal eosinophilic sclerosing fibroplasia. J Vet Intern Med. 2024 Mar-Apr;38(2):1005-12.
[6] Grau-Roma L, Galindo-Cardiel I, Isidoro-Ayza M, Fernandez M, Majo N. A case of feline gastrointestinal eosinophilic sclerosing fibroplasia associated with phycomycetes. J Comp Pathol. 2014 Nov;151(4):318-21.
[7] Martineau M, Tilmant C, Risco Castillo V, Guillot J, Reyes-Gomez E, Benchekroun G, Freiche V. A case of feline gastrointestinal eosinophilic sclerosing fibroplasia associated with fungal colonisation: Endoscopic features, treatment and follow-up. JFMS Open Rep. 2023 May 9;9(1):20551169231165246.
[8] Martineau M, Tilmant C, Risco Castillo V, Guillot J, Reyes-Gomez E, Benchekroun G, Freiche V. A case of feline gastrointestinal eosinophilic sclerosing fibroplasia associated with fungal colonisation: Endoscopic features, treatment and follow-up. JFMS Open Rep. 2023 May 9;9(1):20551169231165246.
[9] Simeoni F, Signore FD, Terragni R, Tamburro R, Aste G, Vignoli M. Diagnostic imaging of gastrointestinal tumours in dogs and cats: A review. Am J Anim Vet Sci. 2020 Apr;15(2):89-101.