
| 一般情况 | |
|---|---|
 | 品种:短毛猫 |
| 年龄:6岁 | |
| 性别:雄 | |
| 是否绝育:是 | |
| 诊断:溺水 | |
01 主诉及病史
因在游泳池中溺水而被送往医院。
该猫在3年前被诊断患有特发性癫痫,上一次发作大约6个月前,没有长期接受抗癫痫治疗。这次猫在癫痫大发作时掉进了水池,入水后立即被从水中捞起,直接送往医院,15分钟内到达。
02 治疗
没有任何反应,肌肉张力高、眼球震颤。心动过缓(112次/分)。反应迟钝,脉搏微弱,体温过低(36.6°C),呼吸56次/分。
张口呼吸,双侧胸腔听诊有严重啰音,呼吸明显费力,粘膜发绀,鼻腔流出血性分泌物。氧饱和度(SpO2)为93%。
立即启动氧气治疗,通过面罩以10 L/分的速度吸入100%的氧气,估计FiO2为50%-60%。静脉注射两剂地西泮来阻止癫痫发作。根据估计体重5 kg计算,最初剂量为2.5 mg,然后根据准确体重6.5 kg计算,再注射0.5 mg/kg。然后注射两次5 mL/kg的乳酸林格氏液以解决心血管休克问题。在最初两次注射液体后测量了血压,收缩压为105 mmHg,舒张压为85 mmHg,平均动脉压为94 mmHg。心电图显示窦性心律。
癫痫停止后,猫呈半昏迷状态,但瞳孔正常,大小对称,瞳孔直视和对光反射完好。改良格拉斯哥昏迷评分为10分。
注射5 mL/kg高渗盐水(7%),以减轻疑似脑水肿。头部保持抬高,以帮助静脉引流并降低颅内压。在没有癫痫发作的情况下,体温迅速降至33°C。心率也进一步降至80次/分。
为了增加心输出量和脑灌注,又注射了5 mL/kg的乳酸林格氏液,并开始使用 Bair Hugger升温系统主动升温至43°C。
血气分析采血未成功。尝试从两个头静脉、内侧隐静脉和脚背静脉进行静脉采样,但没有成功。由于担心脑水肿,为了不妨碍脑部静脉引流,避免了颈静脉穿刺。
超声检查显示胸部和双侧心包有凝聚的B线和碎裂征。未发现游离液体或膀胱壁异常,但发现胆囊内有几个带有声影的高回声病变。
初步稳定后进行了胸片检查,结果显示双侧颅叶、中叶和尾叶腹侧有大片的阴影(下图)。同时还发现胃部严重气体扩张,很可能是呼吸困难引起的吞咽困难。
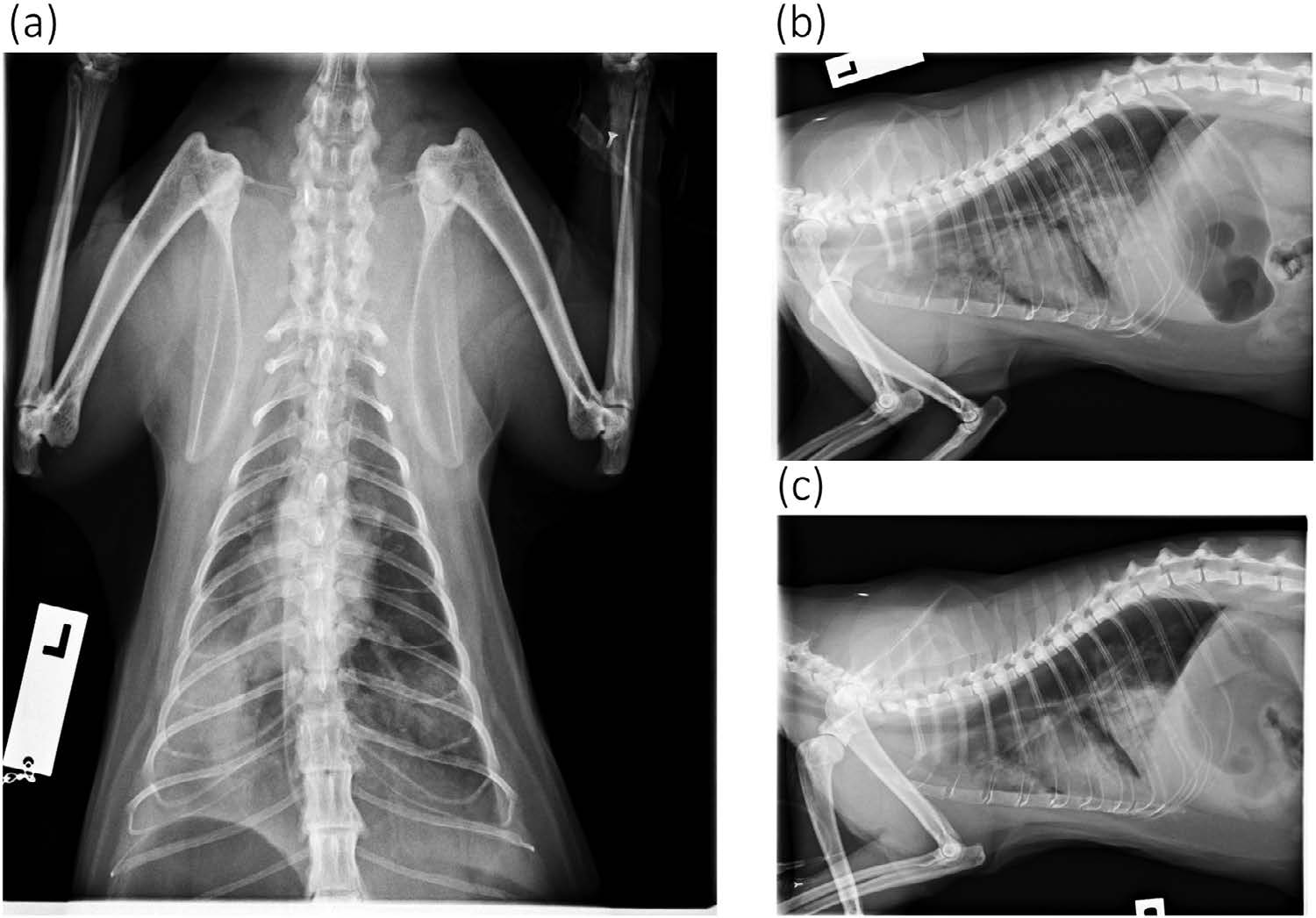
03 治疗
用氧气面罩持续监测6小时后,猫情况稳定,可以放入氧气笼,每分钟30升100%的氧气,FiO2在50%-60%之间,并开始接受抗生素治疗,每8小时静脉注射22 mg/kg阿莫西林,以防止继发性细菌性肺炎的发生。心动过缓和体温过低的情况有所改善,猫的神经状况也有所改善。
心率为150次/分,直肠温度为36.3°C,虽然昏迷不醒,但对刺激有反应,可以抬头。改良格拉斯哥昏迷评分16分。脉压明显改善,收缩压为149 mmHg,舒张压为68 mmHg,平均动脉压为95 mmHg。
第一次自主排尿后,发现尿液呈葡萄酒色。对尿液进行离心后发现没有颗粒,颜色仍然很深,证实为色素尿。继续使用乳酸林格氏液(13 mL/h)进行静脉输液治疗,以防止肾小管受损。
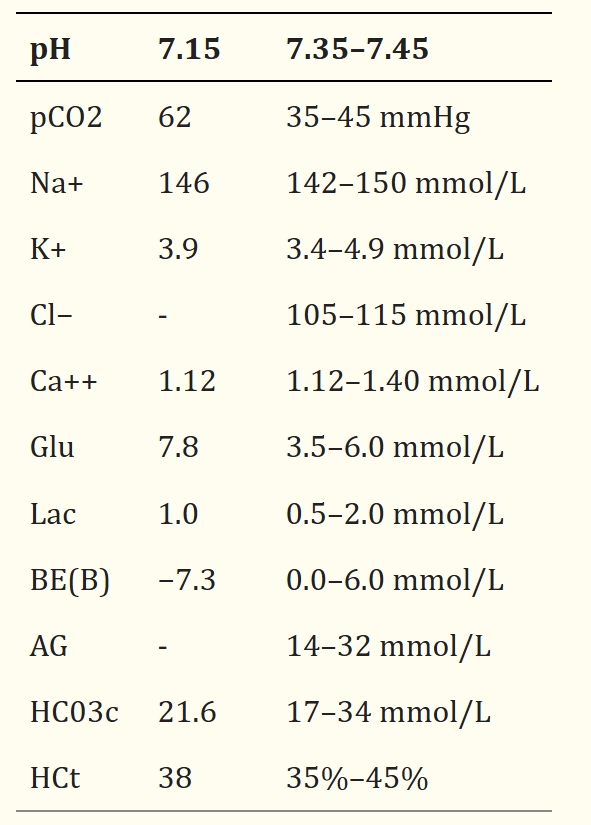
再次尝试静脉穿刺后,采集到了足够的血液进行分析,但采集的血量不足以进行全血细胞计数或血生化分析。充盈细胞体积为54% [25-45],总蛋白68 g/L [55-85]。表明是血红蛋白尿而不是肌红蛋白尿。静脉血气分析显示存在混合性代谢性和呼吸性酸中毒以及应激性高血糖(下表)。
04 预后
入院8小时后,精神状态大有好转,并开始尝试行走。尽管补充了氧气,但患者的呼吸强度仍然明显增加,SpO2在93%-97%之间波动。色素尿仍持续。
由于患者血氧饱和度差、血气碳酸过高(62 mmHg [35-45])以及呼吸强度难以为继,医生建议对其进行机械通气,但主人拒绝。
由于临床改善不理想,且预后不佳,患者在入院约10小时后被安乐死。
05 讨论
溺水被定义为因浸入液体或气道吸入液体而出现呼吸障碍[1]。吸入的液体会导致肺泡内液体过多,表面活性物质被冲走,造成肺泡塌陷,最终导致氧气交换不足和低氧血症[2],伴随而来的是高碳酸血症和酸中毒。
缺氧、酸中毒和常见的低体温会导致心血管和神经系统失调,危及生命。溺水可分为淡水溺水和咸水溺水,还可进一步分为冷水伤害和温水伤害。
关于淡水溺水与海水溺水的临床重要性以及水的补给对全身生化和心血管事件的影响,文献中的观点不一[2,3]。不过研究表明,在淡水溺水中,左心的各种血液成分比右心更稀释,而在咸水溺水中则相反[4]。
从肺部吸收的淡水进入血液循环,导致左心血液快速稀释[2,4-6]。由此产生的渗透压会导致红细胞溶解,在死后留下特征性病变:主动脉内膜溶血染色[4-6]。病理学家在动物模型和溺水受害者身上早已认识到这一点[4-6]。如果从溺水中存活下来,随后可能会观察到溶血导致的血红蛋白尿。
当红细胞暴露在低渗溶液中时,会导致水分通过渗透作用流入细胞。细胞会膨胀,一些细胞会溶血,释放出游离血红蛋白。在正常生理条件下,受损红细胞中的游离血红蛋白会被循环中的血红蛋白和血红蛋白素结合[7]。
然而,当这一系统不堪重负时,血红蛋白就会自由进入组织,促进过氧化反应和炎症级联反应[7]。大量溶血产生的游离血红蛋白主要由肾脏排出,导致血红蛋白尿[7]。在严重的情况下,尿液中沉淀的血红蛋白会导致近端肾小管因铸型形成而阻塞,继而引起急性肾小管坏死[7]。
Yamakami在1922年进行的一系列实验中发现,快被淹死在低渗水中的兔子在失去知觉前无一例外都会出现血红蛋白尿[8]。1953年,Rath首次发布了人类溺水者出现血红蛋白尿的病例报告,最近又有更多报告浮出水面[9,10]。兽医领域尚未有自然发生的临床濒临溺水病例中出现血红蛋白尿的报道。
在严重缺氧的情况下,无氧代谢过程中乳酸生成增加以及肝代谢减少会导致进行性乳酸酸中毒[2]。因此,溺水者通常会出现呼吸性和代谢性混合酸中毒[2]。在极少数情况下,血红蛋白尿或肌红蛋白尿、弥散性血管内凝血、低氧血症或低血压可能会导致急性肾小管坏死[2]。
浸入液体后,受害者可能会缺氧、酸中毒或体温过低,最终导致心律失常,如室颤或窦性心动过缓[1,2]。本病例中观察到的窦性心动过缓很可能是由于体温过低造成的。没有观察到快速性心律失常。医生采用了主动加温的方法来应对这种情况。
脑缺氧和随后的神经元损伤也可能导致弥漫性脑水肿和颅内压增高[1,2]。由于该患者的改良格拉斯科评分异常,怀疑其脑压增高,这可能是溺水过程中缺氧性脑损伤造成的,也可能是长时间癫痫发作造成的。
对疑似脑水肿的患者进行了高渗和等渗晶体液注射、氧疗和保持头部抬高以协助静脉引流。治疗性低温疗法适用于溺水后仍处于昏迷状态的人类患者,因为代谢需求的减少会增强大脑对缺血的耐受性[2,11]。然而,在本病例中没有使用治疗性低温疗法,因为担心低温会导致心动过缓,而且在兽医领域支持对溺水的受害者使用这种技术的证据有限[11]。
处理溺水最关键的措施是通过氧疗和正压通气纠正缺氧和酸中毒,然后是复温和输液[1,2]。在淡水中浸泡可能会因液体重新分布而导致血管内低血容量[12]。通过血气分析密切监测酸碱平衡,可以更好地处理该病例。本病例的液体复苏仅以神经状态和灌注参数(如粘膜颜色和脉压质量)为指导。
本病例报告有许多局限性,尤其是缺乏全面的血液学和血生化评估以及尿液分析。在没有进行全血细胞计数、常规血生化和血涂片分析的情况下,无法排除导致溶血的其他原因,如免疫介导的溶血性贫血和合并症。同样,凝血参数评估、库姆斯凝集试验和玻片凝集试验、血浆聚合酶链反应和蛇毒检测也有助于排除导致溶血的其他原因。
血清肌酸激酶水平的检测有助于进一步排除或确认因癫痫发作引起肌肉损伤而并发肌红蛋白尿的可能性。不过,离心后血清和尿液中出现持续的色素沉着,这也是血红蛋白尿的有力证据。由于没有进行尸检,也无法确认主动脉内膜的溶血染色,而这种染色本可进一步支持因左心内血液稀释和溶血而导致血红蛋白尿的假设。
由于患者病情危重,血流灌注不足,入院时无法进行静脉血气分析,因此直到6小时后才进行了静脉血气分析,此时患者已经接受了输液治疗,包括高渗盐水输注。此时,猫没有出现电解质紊乱,只有呼吸和代谢性混合酸中毒以及应激性高血糖。因此,患者溺水后的电解质状况尚不清楚。
不过,先前的研究表明,溺水患者的全身电解质紊乱很少有临床意义[2]。根据最近的研究,淡水吸收引起的血液稀释和低钠血症似乎是短暂的,随后会在全身重新分布[13]。如果吸入的淡水量超过22 mL/kg,血液稀释和电解质紊乱可能会持续存在,但这个量比引起低氧血症所需的量要大得多[2,5]。
鉴于在进行血气分析时乳酸已经正常,导致负碱基过量的原因可能是未测量的阴离子。由于机器故障,无法读取阴离子间隙和氯化物,也没有进行生化分析,因此无法确认是否存在氮质血症,这是最有可能导致负碱基过量的原因。
由于没有进行血液采样,因此无法计算A-a梯度。充盈细胞体积为54% [25-45],总蛋白为68 g/L [55-85]。充盈细胞体积升高而总蛋白正常表明肾上腺素释放导致脾脏收缩,而不是脱水导致的血液浓缩。
总之,我们不能肯定地说,这只猫出现的血红蛋白尿是淡水吸收和左心溶血的直接结果,但根据临床病史,这是最有可能的解释,而且与以前对溺水者死后特征的描述、动物模型和人类溺水后出现血红蛋白尿的病例相吻合。需要进一步研究兽医学中的溺水现象,以证实这一现象的存在。临床医生应认识到溺水可能导致血红蛋白尿,因为这对预后有影响。
文献来源:Hansen WL. A case of haemoglobinuria in a cat after near-drowning. Vet Med Sci. 2024 Jul;10(4):e1451.
参考文献
[1] Bierens, J., Lunetta, P., Tipton, M., & Warner, D. S. (2016). Physiology of drowning: A review. Physiology, 31(2), 147–166.
[2] Haas, S. A., & Davidow, E. (2008). Successful management of saltwater submersion injury in a dog using mechanical ventilation. Journal of Veterinary Emergency and Critical Care, 18(6), 646–653.
[3] Heffner, G. G., Rozanski, E. A., Beal, M. W., Boysen, S., Powell, L., & Adamantos, S. (2008). Evaluation of freshwater submersion in small animals: 28 cases (1996–2006). Journal of the American Veterinary Medical Association, 232(2), 244–248.
[4] Byard, R. W. (2015). Aortic intimal staining in drowning. Forensic Science, Medicine and Pathology, 11(3), 442–444.
[5] McEwen, B. J., & Gerdin, J. (2016). Veterinary forensic pathology: Drowning and bodies recovered from water. Veterinary Pathology, 53(5), 1049–1056.
[6] Zatopkova, L., Hejna, P., & Janik, M. (2015). Hemolytic staining of the endocardium of the left heart chambers: A new sign for autopsy diagnosis of freshwater drowning. Forensic Science Medicine and Pathology, 11(1), 65–68.
[7] Scott, M. D., Kuypers, F. A., Butikofer, P., Bookchin, R. M., Ortiz, O. E., & Lubin, B. H. (1990). Effect of osmotic lysis and resealing on red cell structure and function. Journal of Laboratory and Clinical Medicine, 115(4), 470–480.
[8] Yamakami, K. (1922). Drowning hemoglobinuria. The Tohoku Journal of Experimental Medicine, 3, 295–304.
[9] Mirvis, E., & Bain, B. J. (2022). Fresh water‐induced hemolysis in near‐drowning. American Journal of Hematology, 97(5), 657–658.
[10] Rath, C. E. (1953). Drowning hemoglobinuria. Blood, 8(12), 1099–1104.
[11] Brodeur, A., Wright, A., & Cortes, Y. (2017). Hypothermia and targeted temperature management in cats and dogs. Journal of Veterinary Emergency and Critical Care, 27(2), 1–13.
[12] Weinstein, M. D., & Krieger, B. P. (1996). Near‐drowning: Epidemiology, pathophysiology, and initial treatment. The Journal of Emergency Medicine, 14(4), 461–467.
[13] Modell, J. H., Gaub, M., Moya, F., Vestal, B., & Swarz, H. (1966). Physiologic effects of near drowning with chlorinated fresh water, distilled water and isotonic saline. Anesthesiology, 27(1), 33–41.